Изменение первичной структуры гемоглобина
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
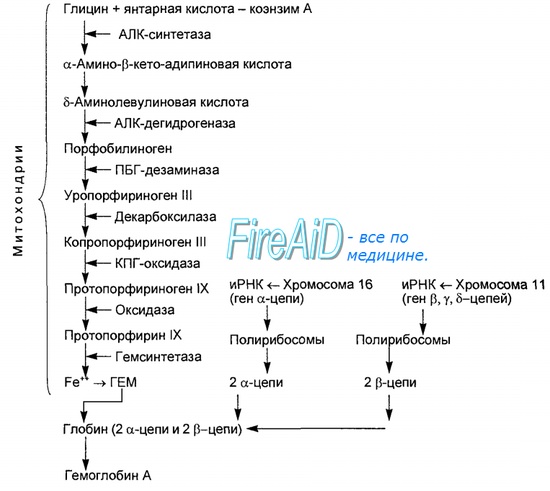
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Строение гемоглобина влияет на его способность присоединять кислород, он содержит красный пигмент гем с железом и белок глобин. Они соединяются в субъединицы, а потом четыре из них скрепляются в один комплекс. Каждый гем с глобином могут переносить кислород и забирать из тканей углекислый газ.
Биологическая роль гемоглобина состоит в обеспечении тканевого дыхания, он также регулирует кислотность крови, связывает токсины. Нормальными формами считается оксигемоглобин (соединение с кислородом), дезоксигемоглобин (углекислота вместо кислорода). В норме в крови есть и немного окисленной формы (метгемоглобин), но при повышении ее уровня нарушается способность гемоглобина обеспечивать ткани кислородом.
Строение гемоглобина и его структура
Гемоглобин имеет в структуре две части – белок глобин и небелковый гем, строение молекулы позволяет ему присоединять и отдавать кислород, воду и углекислый газ. Гем относится к пигментам, то есть красящим веществам. Он придает крови алый цвет. Внутри гема есть железо. Гемоглобин содержит 4 гема, каждый со всех сторон обвит цепочкой аминокислот белка глобина. Эти 4 субъединицы позволяют связывать 4 молекулы кислорода из воздуха в легких.
Эритроциты, состоящие на 95% из гемоглобина, захватывают кислородные молекулы и переносят его к клеткам организма. Гемоглобин отдает кислород, а взамен забирает воду и углекислый газ, которые выделяются также через легкие. Соединение гемоглобина с кислородом называется оксигемоглобин, а с углекислотой – дезоксигемоглобин. Все они в норме есть в эритроцитах.
Если гемоглобин соединяется с угарным газом, то блокируются все 4 части молекулы, в результате она теряет способность соединяться с кислородом. Если есть отравление азотом или цианидами, то железо становится из двухвалентного (нормального) трехвалентным. Это тоже нарушает перенос кислородных молекул, образуется метгемоглобин. Подобная реакция бывает и при отравлении некоторыми медикаментами, наследственных болезнях.
Виды
Все виды гемоглобина делятся на нормальные (физиологические) и с нарушенной структурой (патологические). Для их обозначения используют латинские буквы и сокращение Hb (haemoglobinum).
Нормальные формы
В норме можно найти в крови:
- зрелый гемоглобин HbA, его у взрослого 95-98%, а у новорожденного 80%;
- фетальный гемоглобин HbF (фетус означает плод) образуется со 2 месяца беременности у плода, циркулирует до рождения, разрушается в первую неделю жизни, отличается большей способностью захватывать кислород;
- эмбриональный HbE образуется у плода до 2 месяца внутриутробного развития.
В зависимости от того, что присоединил гемоглобин, выделены формы:
- HbО2 – соединение с кислородом (оксигемоглобин);
- HbСО2 – гемоглобин с углекислым газом, он называется дезоксигемоглобин;
- HbMet – метгемоглобин с окисленным железом, его количество в норме допускается до 3%.
Патологические
Патологических гемоглобинов известно более 300 форм. Наиболее часто находят:
- HbS – гемоглобин при серповидно-клеточной анемии;
- HbCO – карбоксигемоглобин, образующийся при отравлении угарным газом;
- HbA1С – гликозилированный гемоглобин, его уровень возрастает при сахарном диабете.
Железо входит в состав гемоглобина крови?
Ионы металла железа входят в состав гемоглобина и находятся в центре каждой из 4 субъединиц. У них есть 4 связи постоянные и две свободные валентности, одна из них соединена с белком, а ко второй может прикрепиться кислород или вода, азот, углекислота.
Небелковая часть гемоглобина
Гем – это небелковая часть гемоглобина, составляющая 4% от его массы. По химическим свойствам он является пигментом красного цвета. Молекула гемоглобина содержит ионы железа двухвалентного, при окислении оно переходит в трехвалентное, а гем – в гематин, гемоглобин – в метгемоглобин. Перенос кислорода при этом нарушается.
Провоцируют потерю способности к транспортировке молекул свободные радикалы. Они образуются при обменных нарушениях, сахарном диабете, применении некоторых медикаментов (Парацетамол, сульфаниламиды), попадании нитратов из воды и продуктов. Препятствуют окислению гема витамины С, А, Е и микроэлемент селен. Они относятся к системе антиоксидантной защиты организма. Больше всего их содержится в таких продуктах:
- болгарском перце, черной смородине, цитрусовых, зеленом горошке (витамин С);
- говяжьей печени, молоке, твороге, моркови, шпинате (витамин А и провитамин каротин);
- растительном масле, зародышах пшеницы, орехах (витамин Е);
- яйцах, кукурузе, чечевице, миндале, бразильских орехах (селен).
Биологическая роль гемоглобина
Основная биологическая роль гемоглобина – это обеспечение тканевого дыхания, переноса кислорода для образования энергии и удаления углекислого газа. При этом первая его функция основная для организма, так как без гемоглобина кислородное обеспечение невозможно. Для выведения углекислоты есть и другие пути – 80% ее просто растворяется в крови и только 20% переносит гемоглобин.
Нарушение этих процессов происходит при снижении абсолютного числа гемоглобина или потери его активности. Чтобы проверить достаточность питания клеток кислородом, назначается общий анализ крови, а последствия нехватки показывает биохимия:
- напряжение кислорода;
- кислородная емкость;
- артерио-венозная разница по кислороду;
- насыщение гемоглобина кислородом.
Какое число гемов в составе молекулы гемоглобина
Каждая молекула гемоглобина содержит 4 единицы гема. Они образуются из аминокислоты глицина и органической янтарной кислоты. Первый компонент (глицин) содержатся в мясных и рыбных продуктах (говядина, курица, тунец, окунь, щука, скумбрия). Источником янтарной кислоты может стать:
- кефир, простокваша, йогурт, творог;
- крыжовник, вишня, яблоки;
- семена и масло подсолнечника;
- ржаной хлеб.
Физиологическая роль гемоглобина
Физиологическая роль гемоглобина не ограничивается только процессом тканевого дыхания, он также:
- поддерживает равновесие между кислотами и щелочами;
- выводит из клеток кислоту, предупреждая их закисление, снижающее иммунную реакцию;
- тормозит защелачивание крови в легких;
- связывает токсические соединения (нитраты, углекислый газ, сероводород, цианиды), но при их высокой концентрации возникает кислородное голодание или даже смерть.
Гемоглобин: клиническое значение
При снижении нормальных форм гемоглобина в крови ставят диагноз анемии, клиническое значение имеют показатели ниже 100 г/л при норме 120-140 г/л для женщин и 135-160 г/л для мужчин. Для детей результат рассматривают в зависимости от возраста – нижняя граница может быть от 90 единиц для грудничков и 105-115 для ребенка в 7-12 лет.
Симптоматика сниженного гемоглобина в крови включает признаки дефицита кислорода: общая и мышечная слабость, одышка, частый пульс, быстрая утомляемость, головная боль, головокружение, обморочные состояния. Анализ крови на эритроциты и гемоглобин покажет их нехватку, но не дает возможности определить причину. Поэтому требуется обследование: тесты на ферритин, трансферрин, железо и способность к его связыванию.
Реже обнаруживают гемоглобин выше нормы, это состояние называется полиглобулией и бывает при опухолевом процессе, длительной дыхательной и сердечной недостаточности. Для высоких показателей типично покраснение кожи, синева в носогубном треугольнике, головные боли, снижение зрения, тяжесть в правом подреберье.
Миоглобин и гемоглобин – отличия
Миоглобин и гемоглобин похожи, но первый находится в мышечной ткани, в отличие от гемоглобина, циркулирующего в крови. Он способен присоединять и временно удерживать кислород, перемещать его внутри клеток. При недостаточном поступлении кислорода миоглобин временно устраняет его дефицит.
Молекула гемоглобина имеет сложную структуру, состоит из нескольких белковых цепей, а миоглобин имеет только одну цепочку. В норме миоглобина в крови нет, он появляется только при разрушении мышечной ткани. Этим признаком пользуются при постановке диагноза инфаркта миокарда, так как в сердечной мышце содержится особый вид этого белкового комплекса.
Частые вопросы по структуре гемоглобина
Какая валентность железа в гемоглобине? В норме железо двухвалентное, при окислении переходит в трехвалентное, что ухудшает перенос кислорода.
В чем особенность химического строения гемоглобина? Гемоглобин имеет четвертичную структуру, то есть белковые цепи и пигмент вначале соединены в комплексы (первичная структура), а потом эти четыре субъединицы скрепляются между собой.
Что такое нативный гемоглобин и какую он имеет структуру? Нативный гемоглобин – это нормальный, не поврежденный, в его структуре есть гем и глобин, соединенные в 4 комплекса.
Сколько атомов железа в молекуле гемоглобина? В составе гемоглобина 4 гема с железом, поэтому в одной молекуле содержится 4 атома этого микроэлемента.
Строение гемоглобина позволяет ему присоединить кислород, переносить его к клеткам, забирать углекислый газ. При снижении возникает анемия с симптомами кислородного голодания.
Hb взрослого
организма состоит, как упомянуто выше,
из двух α- и двух β-цепей (α2β2). Наряду с
этой основной формой (HbA1)
в крови присутствуют незначительные
количества второй формы с более высоким
сродством к O2, у второй β-цепи заменены
δ-цепя-ми (HbA2,
α2δ2). Две другие формы Hb встречаются
только в эмбриональном периоде развития.
В первые три месяца образуются
эмбриональные гемоглобины состава
α2ε2-P
и α2γ2-F.
Затем вплоть до рождения доминирует
фетальный гемоглобин (HbF),
который постепенно заменяется на первом
месяце жизни на HbА. Эмбриональный и
фетальный гемоглобины обладают более
высоким сродством к О2 по сравнению с
HbА, так как они должны переносить кислород
из системы материнского кровообращения.
Классическим
примером наследственной гемоглобинопатии
является серповидно-клеточная анемия.
При этой патологии эритроциты в условиях
низкого парциального давления кислорода
принимают форму серпа. Гемоглобин S
после отдачи кислорода в тканях он
превращается в плохо растворимую
дез-окси-форму и начинает выпадать в
осадок в виде веретенообразных
кристаллоидов, названных тактоидами.
Последние деформируют клетку и приводят
к массивному гемолизу. Болезнь протекает
остро, и дети, гомозиготные по мутантному
гену, часто умирают в раннем возрасте.
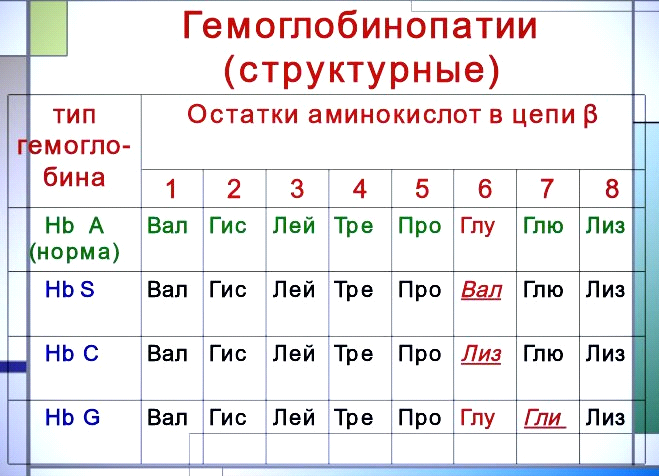
Химический дефект при серповидно-клеточной
анемии был раскрыт В. Ингремом и сводится
к замене единственной аминокислоты, а
именно глутаминовой,
в 6-м положении с N-конца на валин в β-цепях
молекулы гемоглобина HbS. Это результат
мутации в молекуле ДНК, кодирующей
синтез β-цепи гемоглобина.

Вопрос
№ 6
Схема
связывания газов гемоглобином. Карбокси
– и метгемоглобин.
Связывание
газов гемоглобином
□Оксигемоглобин
Hb O2 (Fe2+)
□Карбоксигемоглобин Hb CO
(Fe2+)
□Карбгемоглобин Hb-NH-COOH
(Fe2+)
□Метгемоглобин Мet
Hb(Fe3+)
Карбоксигемоглобин (HbCO) —
прочное соединение гемоглобина и
угарного газа. Избыток карбоксигемоглобина
в крови приводит к кислородному голоданию,
головокружению, тошноте, рвоте или даже
смерти, так как угарный газ, связанный
с гемоглобином, лишает его возможности
присоединять к себе кислород.
МЕТГЕМОГЛОБИН
– форма гемоглобина, в которой железо
гема окислено до Fe (III); не способен
переносить кислород. Образование
метгемоглобина в организме (напр., при
отравлениях нитратами, анилином) приводит
к кислородному голоданию.
Вопрос
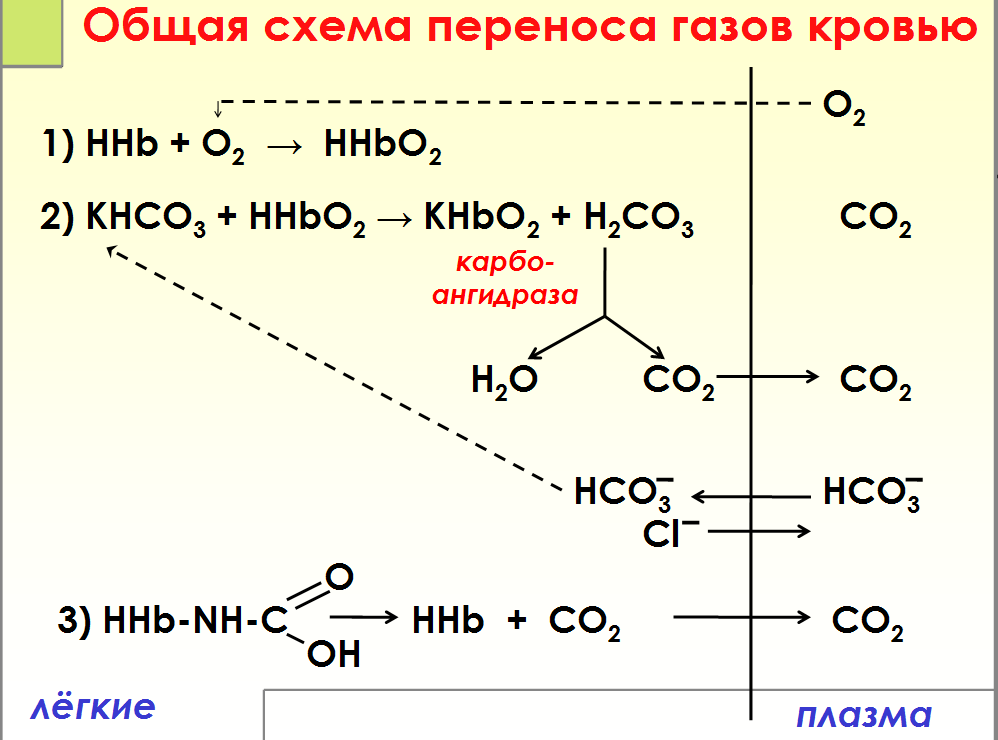
№ 7
Транспорт
кровью кислорода и двуокиси углерода(
схема)
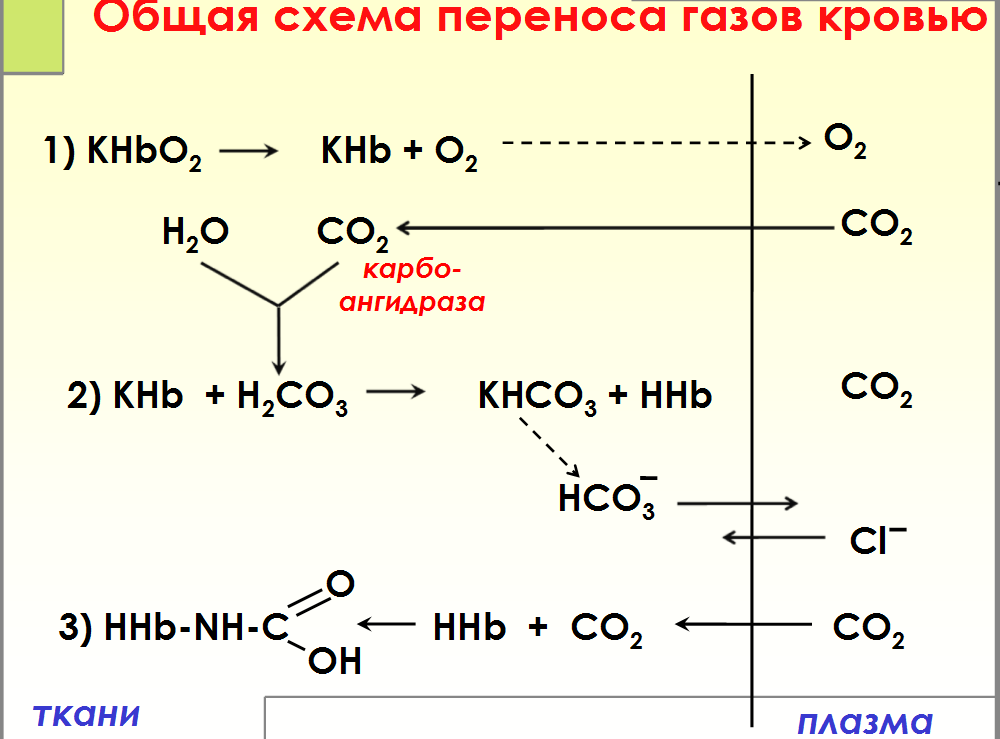
Вопрос
№ 8
Биосинтез
гема. (формулы, ферменты) и его регуляция.
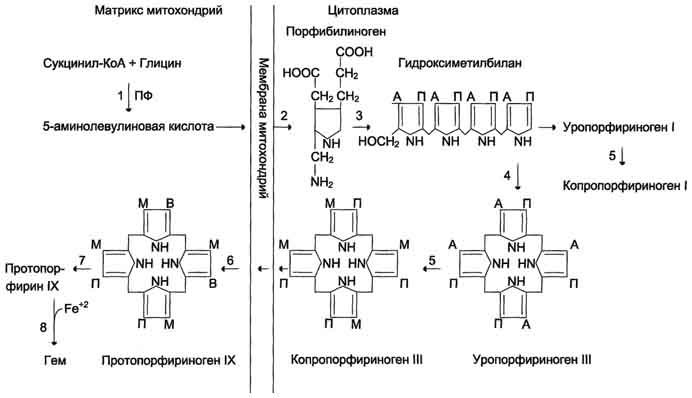
Рис.
13-2. Синтез гема. Цифрами
на схеме указаны ферменты: 1 –
аминолевулинатсинтаза; 2 –
аминолевулинатдегидратаза; 3 –
порфобилиногендезаминаза; 4 – уропорфириноген
III косинтаза; 5 – уропорфириногендекарбоксилаза;
6 – копропорфи-риноген III оксидаза; 7 –
протопорфириногеноксидаза; 8 –
феррохелатаза. Буквами обозначены
заместители в пиррольных кольцах: М –
метил, В – винил, П – остатки пропионовой
кислоты, А – ацетил, ПФ – пиридоксальфосфат.
Донором железа служит депонирующий
железо в клетках белок ферритин.
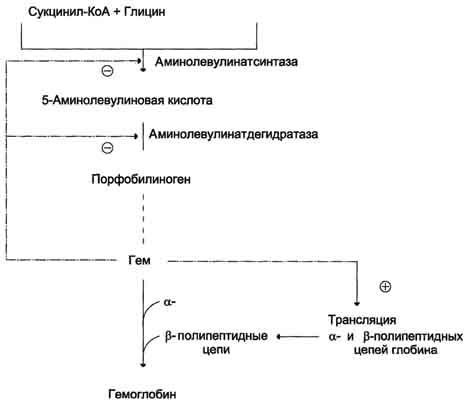
Регуляторную
реакцию синтеза гема катализирует
пиридоксальзависимый фермент
аминолевулинатсинтаза. Скорость реакции
регулируется аллостерически и на уровне
трансляции фермента.
Аллостерическим
ингибитором и корепрессором синтеза
аминолевулинатсинтазы является гем
(рис. 13-5).

Рис.
13-5. Регуляция синтеза гема и гемоглобина. Гем
по принципу отрицательной обратной
связи ингибирует аминолевулинатсинтазу
и аминолевулинатдегидратазу и является
индуктором трансляции α- и β-цепей
гемоглобина
В
ретикулоцитах синтез этого фермента
на этапе трансляции регулирует железо.
На участке инициации мРНК, кодирующей
фермент, имеется
последовательность
нуклеотидов, образующая шпилечную
петлю, которая называется железочувствительным
элементом (от англ, iron-responsive
element, IRE)
(рис. 13-6).
При
высоких концентрациях железа в клетках
оно образует комплекс с остатками
цистеина регуляторного железосвязывающего
белка. Взаимодействие железа с регуляторным
железосвязывающим белком вызывает
снижение сродства этого белка к
IRE-элементу мРНК, кодирующей
аминолевулинатсинтазу, и продолжение
трансляции (рис. 13-6, А). При низких
концентрациях железа железосвязывающий
белок присоединяется к железо-чувствительному
элементу, находящемуся на 5′-нетранслируемом
конце мРНК, и трансляция аминолевулинатсинтазы
тормозится (рис. 13-6, Б).
Аминолевулинатдегидратаза
также аллостерически ингибируется
гемом, но так как активность этого
фермента почти в 80 раз превышает
активность аминолевулинатсинтазы, то
это не имеет большого физиологического
значения.
Дефицит
пиридоксальфосфата и лекарственные
препараты, которые являются его
структурными аналогами, снижают
активность аминолевулинатсинтазы.
Вопрос
№ 9
Нарушение
биосинтеза гема. Порфирии
Порфирии
– заболевания, обусловленные нарушениями
начальных этапов синтеза гема и
сопровождающиеся накопление порфиринов
и их предшественников.
Первичные –
генетический дефект ферментов синтезаВторичные –
нарушения регуляции биосинтезаНаследственные:
Эритропоэтические
уропорфирия
протопорфирия
Печёночные
острая перемежающаяся
порфириякопропорфирия
урокопропорфирия
Смешанные
Наследственные
и приобретённые нарушения синтеза гема,
сопровождающиеся повышением содержания
порфириногенов, а такие продуктов их
окисления в тканях и крови и появлением
их в моче, называют порфириями.
Наследственные
порфирии обусловлены генетическими
дефектами ферментов, участвующих в
синтезе гема, за исключением
аминолевулинатсинтазы. При этих
заболеваниях отмечают снижение
образования гема. Поскольку гем –
аллостерический ингибитор
аминолевулинатсинтазы, то активность
этого фермента повышается, и это приводит
к накоплению промежуточных продуктов
синтеза гема – аминолевулиновой кислоты
и порфириногенов.
В зависимости от
основной локализации патологического
процесса различают печёночные и
эритропоэтические наследственные
порфирии. Эритропоэтические порфирии
сопровождаются накоплением порфиринов
в нормобластах и эритроцитах, а печёночные
– в гепатоцитах.
При тяжёлых формах
порфирии наблюдают нейропсихические
расстройства, нарушения функций РЭС,
повреждения кожи. Порфириногены не
окрашены и не флуоресцируют, но на свету
они легко превращаются в порфирины.
Последние проявляют интенсивную красную
флуоресценцию в ультрафиолетовых лучах.
В коже на солнце в результате взаимодействия
с порфиринами кислород переходит в
синглетное состояние. Синглетный
кислород вызывает ускорение ПОЛ клеточных
мембран и разрушение клеток, поэтому
порфирии часто сопровождаются
фотосенсибилизацией и изъязвлением
открытых участков кожи. Нейропсихические
расстройства при порфириях связаны с
тем, что аминолевулинат и порфириногены
являются нейротоксинами.
Иногда
при лёгких формах наследственных
порфирии заболевание может протекать
бессимптомно, но приём лекарств,
являющихся индукторами синтеза
аминолевулинатсинтазы, может вызвать
обострение болезни. Индукторами синтеза
аминолевулинатсинтазы являются такие
известные лекарства, как сульфаниламиды,
барбитураты, диклофенак, вольтарен,
стероиды, гестагены. В некоторых случаях
симптомы болезни не проявляются до
периода полового созревания, когда
повышение образования β-стероидов
вызывает индукцию синтеза
аминолевулинатсинтазы. Порфирии
наблюдают и при отравлениях солями
свинца, так как свинец нгибирует
аминолевулинатдегидратазу и феррохелатазу.
Некоторые галогенсодержащие гербициды
и инсектициды являются индукторами
синтеза аминолевулинатсинтазы, поэтому
попадание их в организм сопровождается
симптомами порфирии.
Вопрос
№ 10
Схема
распада гемоглобина. “Непрямой”
билирубин.
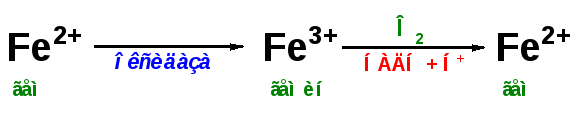
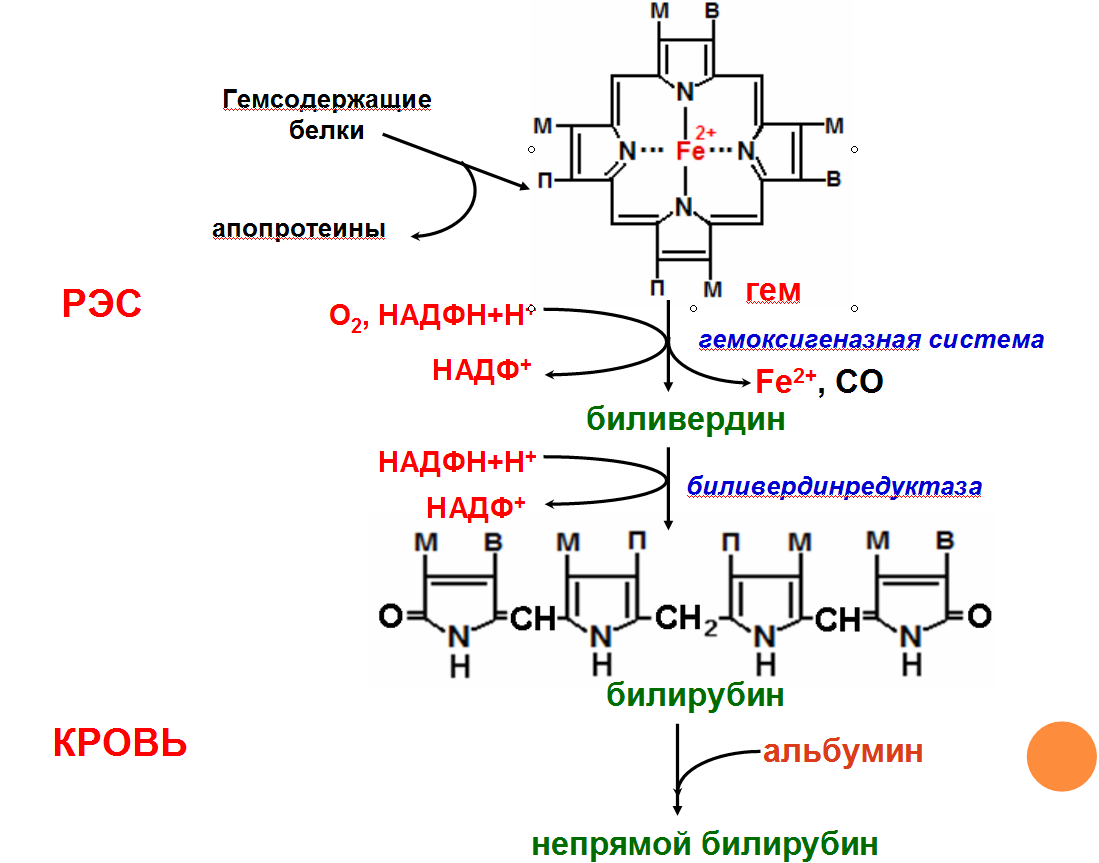
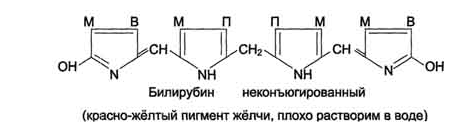
Катаболизм
гема
Первая
реакция катаболизма гема происходит
при участии NADPH-зависимого ферментативного
комплекса гемоксигеназы. Ферментная
сисгема локализована в мембране ЭР, в
области электронтранспортных цепей
микросомального окисления. Фермент
катализирует расщепление связи между
двумя пиррольными кольцами, содержащих
винильные остатки, – таким образом,
раскрывается структура кольца (рис.
13-11). В ходе реакции образуются линейный
тетрапир-рол – биливердин(пигмент
жёлтого цвета) и монооксид углерода
(СО), который получается из углерода
метениловой группы. Гем индуцирует
транскрипцию гена гемоксигеназы,
абсолютно специфичной по отношению к
тему.
Ионы
железа, освободившиеся при распаде
гема, могут быть использованы для синтеза
новых молекул гемоглобина или для
синтеза других железосодержащих белков.
Биливердин восстанавливается до
билирубина NADPH-зависимым
ферментом биливердинредуктазой.Билирубин
образуется не только при распаде
гемоглобина, не также при катаболизме
других гемсодержащю белков, таких как
цитохромы и миоглобин. При распаде 1 г
гемоглобина образуется 35 мг билирубина,
а в сутки у взрослого человека – примерно
250-350 мг билирубина. Дальнейший метаболизм
билирубина происходит в печени
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #