Электрофорез гемоглобина при талассемии
Лабораторная диагностика бета-талассемии – анализы
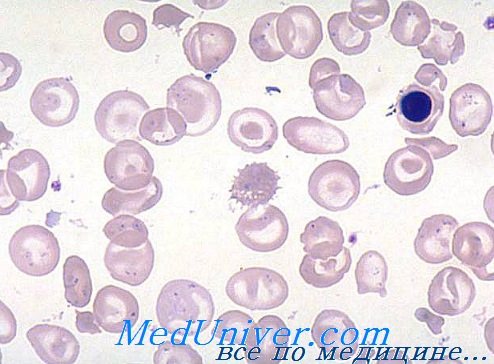
При тяжелой талассемии анемия неизменно тяжелая и резко гипохромная, при этом значения гемоглобина колеблятся от 5 до 7 г/100 мл крови, а показатели гематокрита и численности красных кровяных клеток соответственно уменьшаются. Постоянные эритроцита НЕМ и СНЕМ меньше нормы, соответственно недостаточности гемоглобина в эритроцитах. Вместе с тем, показатель РОЭ колеблется в соответствии с недостаточностью фолиевой кислоты и связанным с ней вторичным макроцитозом.
Мазок периферической крови характерен и с самого же начала исследования подсказывает диагноз. Гипохромия резко выражена, ей сопутствует анизопойкилоцитоз высокой степени. Многочисленные точечные и частые капельные гематии и овалоциты, наряду с большим числом красных кровяных телец искаженного очертания и шизоцитов различной формы и величины, в целом характеризуют мазок при анемии Кули.
Звездочкообразные гематии с подвернутыми краями напоминают «мексиканскую шляпу», при этом иногда они макромегалоцитные (12—15 u). В случаях очень низкого показателя гемоглобина отдельные гематии как бы лишены содержания, в связи с чем принимают аспект «эритроцитной тени». Часто отмечается наличие красных кровяных телец с кольцами Cabot, телец Jolly и базофильными точками. Неизменно присутствие эритробластов (5—20/100 лейкоцитов), при этом, после удаления селезенки, их численность в несколько раз больше лейкоцитов (300—500/100 лейкоцитов).
Выраженная полихроматофилия мазка отражает повышенный ретикулоцитоз (5—15%).
При легкой талассемии анемия умеренная (гемоглобин от 7 до 10 г/100 мл) или небольшая, причем в формах отягчения могут наблюдаться нормальные значения гемоглобина. Степень эритроцитной беспорядочности значительно меньше, чем при тяжелой талассемии. Мазок периферической крови отражает общий аспект микроцитной гипохромной анемии. Тем не менее пойкилоцитоз, наличие звездочкообразных и точечнобазофильных красных кровяных телец делает возможным отличить это заболевание от однородной микроцитно-гипохромной картины железодефицитной анемии.
Небольшая полихроматофилия соответствует слегка увеличенной численности ретикулоцитов (2—5%). Эритробласты редкие (1—2 на несколько сот лейкоцитов) или, как это бывает в большинстве случаев, просто отсутствуют.
Умеренный лейкоцитоз постоянное явление при тяжелой талассемии (10 000—20 000/мм3), ему нередко сопутствует отклонение влево лейкоцитной формулы. У большинства больных наблюдается и небольшой рост показателя численности тромбоцитов. В принципе, при легких формах, число лейкоцитов и тромбоцитов укладывается в норму или у высшего предела.

Мазок при бета-талассемии
Косвенный билирубин увеличен (1—3 мг/100 мл), показатели уробилиногена в моче и выделения стеркобилиногена с испражнениями — весьма высокие. При легкой талассемии все эти признаки разрушения красных кровяных клеток существуют, но в значительно сокращенном виде в зависимости от клинической формы и степени расплавления крови.
Осмотическая устойчивость эритроцитов в гипотонном солевом растворе почти неизменно повышена, общее расплавление крови часто отмечается при концентрации примерно 0,2 г NaCl/100 мл или даже меньше в случае выраженного платицитоза. Для диагностирования талассемии реакция весьма полезна, но отнюдь не патогномонична. Отмечаются случаи железодефицитиой анемии с высокой осмотической устойчивостью, подобно случаям талассемии-отягчение, при которой показатели близки к норме.
Сидервмия, общая способность связывания сидерофилина (СС), латентная способность (ЛС), коэффициент насыщения (КН) сидерофилина железом выявляют степень нагрузки организма железом. В большинстве случаев тяжелой талассемии СС меньше нормы (300—330 мкг), показатель сидеремии всегда повышен и КН колеблется от 60 до 100%, подобно тому как наблюдается при гемохроматозе. Окраска на определение костномозгового гемосидерина выявляет увеличенное количество последнего в макрофагах и значительный процент сидеробластов.
При легкой талассемии сидеремия несколько повышена или нормальна, причем в отдельных случаях показатель СС несколько занижен а значения КН сидерофилина укладываются в перделы от 33 до 60%. Вообще процент сидеробластов превышает норму. Определение сидеремии, СС, КН и костномозгового железа особо полезны при дифференциальной диагностике с гипохромной железодефицитиой анемией.
В условиях тяжелой талассемии костный мозг отличается выраженной гиперплазией с явным преобладанием эритробластического ряда (Г/Э = 1/4—1/8). В случае недостатка фолиевой кислоты некоторые эритробласты приобретают мегалобластовидный аспект. При легкой талассемии костномозговой мазок выявляет наличие обильной клеточной массы с умеренным преобладанием эритробластического ряда. В принципе исследование костного мозта не обязательно для постановки диагноза, тем не менее оно полезно для определения запасов железа, в основном при легкой талассемии с электрофорезом гемоглобина в пределях нормы или при осложнениях с хронической кровоточивостью и недостатком железа.
Электрофорез гемоглобина основной способ для уточнения диагноза бета-талассемии. Тяжелая талассемия или анемия Кули характеризуется весьма высоким показателем гемоглобина F (N > 2% у детей старше 1 года), составляющим 20—90% всего гемоглобина, в остальной части отмечается наличие гемоглобин А и нормальные или завышенные значения гемоглобин А2. Наиболее часто значения гемоглобин F составляют 30—60%. В случаях гомозиготной бета-талассемии вида дельта-бета все количество гемоглобина состоит лишь из вида F, при полном отсутствии видов А и А2. Значения Гб в результате электрофореза следует сопоставить со значениями химического теста на определение щелочноустойчивого гемоглобина, в целях исключения аномального гемоглобина, электрофоретическая миграция которого может оказаться одинаковой с гемоглобином F.
Гетерозиготная бета-талассемия характеризуется ростом показателя гемоглобина А2 и/или гемоглобина F, в процентном выражении. Большинство случаев гетерозиготной талассемии (примерно 90%) относятся к виду I при этом показатель гемоглобина А2 колеблется в пределах от 4 до 6% (N > 3%). Значения от 3 до 4%, в частности от 3 до 3,5% следует толковать осторожно и сопоставлять с результатами остальных исследований. Примерно в 50% случаев гетерозиготной бета-талассемии, с высоким показателем гемоглобина А2, отмечается и слегка повышенный показатель гемоглобина F (2—5%), причем для их определения применяется тест на устойчивость к щелочам.
Бывают случаи легкой бета-талассемии, осложняющиеся недостатком железа (повторные роды, хроническая кровоточивость и пр.), при которых значения гемоглобина А2 при электрофоретическом исследовании укладываются в норму. После проведения железотерапии повторный электрофорез выявляет рост показателя гемоглобина А2 за пределы нормы.
Случаи гетерозиготной бета-талассемии, характеризующиеся ростом лишь гемоглобина F редки (среди нашего населения примерно 10% всех гетерозиготов), при этом соответствующий показатель составляет примерно 2—30%, наиболее часто 5—15%; у подобных больных гемоглобин А2 нормальный или заниженный, остальную долю — составляет гемоглобин А. Такие случаи следует отличать от физиологических или патологических состояний с высоким показателем гемоглобин F, таких как, беременность, бирмеровская и сидероакрестическая анемия, лейкемия и пр.
Диагностирование бета-талассемии относительно несложное. Проявление болезни в детстве, клинические и гематологические признаки тяжелой гемолитической анемии подсказывают диагноз наследственной гемолитической анемии. Аспект мазка периферической крови исключает остальные виды наследственной гемолитической анемии, в первую очередь врожденного сфероцитоза. Электрофорез и определение щелочноустойчивого гемоглобина выявляют весьма высокий показатель гемоглобина F, и тем самым подтверждают диагноз.
При легкой форме бета-талассемии клиническое и гематологическое исследования менее убедительны. Наиболее частая ошибка заключается в определении заболевания как гипохромная железодефицитная анемия. Однако пойкилоцитоз, звездочкообразные красные кровяные тельца, базофильноточечные гематии, равно как и признаки расплавления крови свидетельствуют о наличии легкой формы талассемии.
Высокие показатели сидеремии и костномозгового гемосидерина лишний раз подтверждают это предположение. Диагноз подтверждается электрофорезом и определением щелочноустойчивого гемоглобина, поскольку эти исследования выявляют высокие показатели гемоглобина А2 и/или гемоглобина F. Исследования в семейном плане подтверждают наследственный характер заболевания. Так, при тяжелой талассемии, как у отца, так и у матери выявляется наличие легкой талассемии, в то время как при легкой форме этого заболевания, по меньшей мере у одного из них.
– Также рекомендуем “Механизмы развития бета-талассемии – патофизиология”
Оглавление темы “Талассемии”:
- Талассемические синдромы – история изучения, классификация
- бета-Талассемия (анемия Кули) – причины, классификация
- Клиника бета-талассемии – признаки
- Лабораторная диагностика бета-талассемии – анализы
- Механизмы развития бета-талассемии – патофизиология
- Течение бета-талассемии (анемии Кули) – осложнения
- Лечение бета-талассемии – анемии Кули
- а-Талассемия – причины, диагностика, классификация
- Легкие талассемические и талассемическоподобные синдромы: дельта- и гамма-талассемии, синдром Lepore
- Анемии вследствие энзимопатий: недостаток глюкозо-6-фосфатдегидрогеназы (Г-6-ФД) в эритроцитах
[13-165]
Электрофорез гемоглобина для диагностики гемоглобинопатий
3045 руб.
Электрофорез гемоглобина в щелочном геле позволяет определить процентное содержание основных изоформ гемоглобина и провести скрининг гемоглобинопатий. В норме в крови взрослого человека не менее 96,5 % гемоглобина представлено изоформой HbA, которая состоит из двух пар полипептидных цепей (глобинов): 2α и 2β, каждая из которых связана с гемом. Гемоглобинопатии связаны с наличием аномального варианта гемоглобина. Посредством электрофореза гемоглобина можно проводить скрининг состояний, связанных со структурными аномалиями гемоглобина. При этом метод не позволяет установить тип и характер гемоглобинопатии.
Синонимы английские
Serum Hemoglobin Electrophoresis.
Метод исследования
Электрофорез и денситометрия.
Единицы измерения
Мг/дл (миллиграмм на децилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Электрофорез гемоглобина в щелочном геле позволяет определить процентное содержание основных изоформ гемоглобина и провести скрининг гемоглобинопатий. В норме в крови взрослого человека не менее 96,5 % гемоглобина представлено изоформой HbA, которая состоит из двух пар полипептидных цепей (глобинов) – 2α и 2β, – каждая из которых связана с гемом. HbA обеспечивает адекватный газообмен и тканевую оксигенацию. Фракция HbA2 – второстепенная форма гемоглобина, имеет формулу 2α2δ. Также у взрослого допустимо наличие следовых количеств фетального гемоглобина HbF (2α2γ), который является преобладающей фракцией в течение внутриутробного периода. В течение первых 6 месяцев жизни HbF замещается HbA.
Нарушения структуры гемоглобина обычно разделяют на две группы: гемоглобинопатии и талассемии, хотя талассемии являются формой гемоглобинопатии. Талассемии представляют собой нарушения синтеза α-, β- или обеих цепей гемоглобина. Также могут отмечаться нарушения синтеза δ-, γ- цепей. Большинство вариантов α- и β-талассемий сопровождается изменением уровня HbF и HbA2, поэтому определение этих изоформ может быть использовано для скрининга этих состояний.
Остальные гемоглобинопатии связаны с наличием аномального варианта гемоглобина. Наиболее распространённые и клинически значимые аномальные варианты гемоглобина: S, D, E, C. Варианты HbS и HbD – патологические формы гемоглобина, которые обладают идентичной миграцией в щелочном геле и являются результатом точечных мутаций гена, кодирующего β-глобин. Варианты Е и С при данном методе мигрируют в составе фракции HbA2, при их наличии фракция HbA2 достигает более 25 %. Наибольшее клиническое значение представляет HbS-вариант, который приводит к серповидноклеточной анемии.
Электрофорез гемоглобина в щелочном геле позволяет проводить скрининг состояний, связанных со структурными аномалиями гемоглобина. При этом метод не позволяет установить тип и характер гемоглобинопатии.
Электрофорез является чувствительным методом, с помощью которого можно исключить гемоглобинопатии либо определить тактику дальнейшего обследования для установления точного диагноза заболевания. Метод характеризуется высокой внутрипостановочной (SD
Метод исследования основан на электрофорезе гемоглобина, полученного при лизисе отмытых эритроцитов обследуемого. После разделения гемоглобина на фракции производится окрашивание зон миграции. Содержание гемоглобина в составе фракций измеряется с помощью цифровой денситометрии.
Когда назначается исследование?
- Скрининг гемоглобинопатий;
- наличие семейного анамнеза гемоглобинопатий, планирование семьи;
- микроцитарная анемия, не связанная с дефицитом железа;
- гемолитическая анемия неустановленной этиологии;
- обнаружение изменённых эритроцитов (серповидная деформация) при микроскопическом исследовании крови.
Что означают результаты?
Референсные значения
Гемоглобин A | ≥ 96,5% |
Гемоглобин A2 | |
Гемоглобин F | |
Гемоглобин S/D | 0 % |
Важные замечания
- Тест обладает высокой достоверностью при скрининге β-талассемий, вариантов, приводящих к серповидноклеточной анемии, и синдромов персистенции фетального гемоглобина.
- При использовании данного метода может быть затруднена индентификация α+-талассемии (талассемия с одной мутацией).
Также рекомендуется
02-029 Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
06-276 Гепсидин-25
06-017 Железо в сыворотке
Кто назначает исследование?
Гематолог, терапевт, врач общей практики.
Материалы представлены из учебного пособия РУДН
Анемии. Клиника, диагностика и лечение / Стуклов Н.И., Альпидовский В.К., Огурцов П.П. – М.: ООО «Медицинское информационное агентство», 2013. – 264 с.
Копирование и тиражирование материалов без указания авторов запрещено и преследуется по закону.
Талассемии – это группа наследственных заболеваний, относящихся к количественным гемоглобинопатиям, при которых имеет место нарушение синтеза полипептидных цепей глобина β или α, что приводит к уменьшению образования одной или нескольких фракций нормального гемоглобина или, в редких случаях, – формированию гемоглобина, не встречающегося у здоровых людей.
При гомозиготных состояниях этот дефект синтеза цепей глобина проявляется гемолитической анемией разной степени выраженности. При гетерозиготных β-талассемиях, когда патологический ген наследуется от одного из родителей, а также у некоторых больных с гомозиготной α-талассемией заболевание проявляется слабовыраженной гипохромной анемией, а признаки гемолиза отсутствуют.
Впервые талассемия была описана Cooley и Lee в 1925 году при наблюдении 5 детей из итальянской семьи. У всех детей в семье наблюдалась гипохромная гемолитическая анемия со значительным увеличением селезенки и печени, изменения костей скелета. Заболевание назвали болезнью Кули. Позднее были описаны более легкие формы, и в 1936 году болезнь получила название «талассемия».
В зависимости от нарушения синтеза α- или β-цепей глобина выделяют две основные формы заболевания: α- и β-талассемию.
β-талассемии
β-талассемия обусловлена рядом мутаций в локусе β-глобина на 11 хромосоме, нарушающих синтез β-цепей. Эти мутации могут происходить на разных стадиях экспрессии гена, отвечающего за синтез β-цепей: дефект ДНК, нарушение гена-регулятора цепей глобина или транспортной РНК. При ограничении транскрипции т-РНК обычно снижается синтез β-цепей – β+-талассемия. При β0-талассемии мутация происходит в зоне кодирования и вызывает полную остановку синтеза β-цепей. Всего описано более 100 различных мутаций локуса β-глобина, которые передаются доминантно, но иногда возникают в результате спонтанных мутаций.
Патогенез клинических проявлений при гомозиготной β-талассемии связан не только с недостаточной продукцией нормального гемоглобина, но и с относительной избыточной выработкой малорастворимых α-цепей, свободные α-цепи образуют тетрамеры. В количественном отношении α-цепи вырабатываются нормально. Эти избыточные α-цепи в виде внутриклеточных преципитатов выпадают в осадок, разрушая мембрану клеток-предшественников эритроцитов, вызывая их внутрикостномозговую гибель (неэффективный эритропоэз) и гемолиз уже образовавшихся эритроцитов. Все это приводит к развитию основного симптома гомозиготной талассемии – анемии.
В ответ на развитие тканевой гипоксии, сопровождающей анемию, почки значительно повышают выработку эритропоэтина, который стимулирует формирование кроветворной ткани в костях, где она обычно отсутствует, вызывая деформацию костей (башенный череп, монголоидность и др.), а также образование экстрамедуллярного кроветворения в печени и селезенке с их выраженным увеличением.
β-талассемия широко распространена в странах Средиземного моря (Италия, Греция, Кипр, Турция и др.), Центральной и Восточной Африке, Ближнем и Среднем Востоке, Индии, Юго-Восточной Африке. Широкая распространенность заболевания, предполагается, является результатом лучшей переносимости малярии больными-гетерозиготами по β-талассемии – механизм остается неясным.
Выраженность клинических проявлений при гомозиготной β -талассемии зависит от степени нарушения синтеза β-цепей.
Самая тяжелая форма, или болезнь Кули, обозначается как большая β0-талассемия. При этой форме полностью отсутствует синтез β-цепей.
Клиника
Анемия при большой талассемии развивается уже к первому году жизни ребенка и сопровождается отставанием в психическом и физическом развитии. Со временем анемия прогрессирует, появляется желтушность кожи и склер, значительно увеличиваются селезенка и печень, нередко на коже ног образуются трофические язвы. Характерен внешний вид больных детей с болезнью Кули: непропорционально большая деформированная голова («башенный череп»), приплюснутый нос, суженые глазные щели и выпуклые скулы (признаки «монголоидности»). Дети резко отстают в развитии, отмечается повышенная восприимчивость к инфекциям, половое недоразвитие.
При рентгенологическом исследовании трубчатых костей отмечается истончение кортикального слоя и расширение костномозгового канала. Для рентгенографической картины костей черепа характерно расширение диплоического пространства костей свода черепа и появление радиальной исчерченности – вид «ёжика» или «щетки». Сходные изменения структуры наблюдаются в метафизах трубчатых костей, плоских костях таза, лопатках и ребрах.
В анализах крови – глубокая анемия, концентрация гемоглобина – 30-50 г/л, выраженная гипохромия, анизоцитоз, значительная мишеневидность эритроцитов, базофильная пунктация. При электрофорезе гемоглобина эритроцитов 98% составляет HbF, 2-3% – HbA2 и большое количество свободных α-цепей.
Ранее прогноз при этой форме заболевания был крайне неблагоприятным, поскольку большинство детей погибало в возрасте 3-4 лет. В настоящее время выздоровление детей с той тяжелой патологией возможно после проведения трансплантации аллогенного костного мозга.
При среднетяжелой и промежуточной форме β+-талассемии смягчение тяжести заболевания обусловлено частичным сохранением синтеза β-цепей, а, следовательно, присутствием в эритроцитах нормального HbA.
От способности синтезировать β-цепи зависит тяжесть течения заболевания. При незначительной продукции β-цепей эта форма β+-талассемии, тип I, обозначается как среднетяжелая и по клинике приближается к болезни Кули. Больные доживают до школьного возраста, а в их эритроцитах преобладает HbF 60 – 80%, HbA2 3-9%, свободные α-цепи и появляется небольшое количество HbA.
Больные с β+-талассемией, тип II, с более выраженной продукцией β-цепей, описывается как промежуточная форма (thalassemiaintermedia), с менее выраженной анемией. Больные доживают до зрелого возраста, при адекватной гемотрансфузионной терапии практически не отстают в развитии и способны заканчивать школы, колледжи и даже университеты.
Диагностика гомозиготной β-талассемии не вызывает больших трудностей:
– признаки гемолитической анемии с детства;
– отставание в развитии и деформация скелета (болезнь Кули и среднетяжелая форма);
– гепато-, спленомегалия;
– мишеневидность и гипохромия эритроцитов;
– преобладание при электрофорезе гемоглобина HbF и свободных α-цепей, увеличение А2 Hb;
– молекулярная диагностика (исследование мутаций генов, кодирующих цепи Hb).
Лечение
Большим достижением в лечении тяжелой и среднетяжелой форм β-талассемии стало применение аллогенной трансплантации костного мозга (чаще от брата или сестры), позволившее в 80 – 90% добиться выздоровления ранее некурабельных больных.
Больные с промежуточной формой β+-талассемии, как и больные с тяжелой формой заболевания, не могут жить без периодических трансфузий эритроцитарной массы, частота которых регулируется уровнем концентрации гемоглобина.
Для нормального развития ребенка рекомендуется поддерживать концентрацию гемоглобина на уровне 100 – 110 г/л. Регулярные гемотрансфузии, в сочетании с повышенным всасыванием железа в кишечнике у анемизированных больных создает опасность развития гемосидероза с поражением сердца (кардиомегалия), печени (фиброз), поджелудочной железы (сахарный диабет), почек (почечная недостаточность) и других органов. Поэтому гемотрансфузионная терапия должна сочетаться с применением хелатирующих лекарственных препаратов (десферал, эксиджад), которые способны связывать свободное сывороточное железо, внутриклеточное железо из гепатоцитов, извлекать его из комплекса с трансферрином и ферритином.
Десферал вводится внутривенно, длительно, по 1-2 г препарата на каждые 500 мл донорской эритроцитарной массы. Возможно длительное подкожное введение с помощью инжектора с одновременным определением сывороточного ферритина.
В последние годы разработан препарат со свойствами десферала – эксиджад (деферазирокс), обладающий выраженным преимуществом, поскольку он может применяться внутрь, по 20 мг/кг массы тела больного.
При массивной спленомегалии рекомендуется проведение спленэктомии. Показания:
– прогрессирующе увеличение размеров селезенки (>8 см из-под края реберной дуги),
– увеличение потребности в гемотрансфузиях более, чем на 50% от исходного уровня в течение 6 месяцев,
– при повышении потребности в эритроцитарной массе более, чем на 250 мл в течение года.
α-талассемии
α-талассемия впервые была описана в 1955 году. Выявляется в Греции, Таиланде, Нигерии, Азербайджане, Дагестане. В основе α-талассемии лежит нарушение синтеза α-цепей глобина. Поскольку эти цепи входят в состав всех нормальных фракций гемоглобина, при α-талассемии происходит равномерное снижение их синтеза.
Две почти идентичные копии гена α-глобина находятся на хромосоме 16. Наиболее часто встречается потеря одного или нескольких их этих 4 генов – 80-85% случаев α-талассемии.
Клинические проявления α-талассемии напрямую коррелируют со степенью нарушения синтеза α-глобиновых цепей. При данном виде аномалии симптомы менее выражены, чем при β-талассемии, что связано с наличием 4 генов α-глобина. Адекватное количество α-цепей образуется до тех пор, пока не утрачиваются 3 или 4 гена. Кроме того, β4-тетрамер (или HbH), образующийся при недостатке α-цепей, более растворим, чем тетрамер α4. Вследствие этого даже при выраженном нарушении синтеза α-цепей при α-талассемии гемолиз гораздо менее выражен, а эритропоэз более эффективен, чем при β-талассемии.
Гемоглобин Барт – гомозиготная α-талассемия I – поражены все 4 гена, ответственные за синтез α-цепей – самая тяжелая форма α-талассемии. Встречается такая форма только в странах Юго-Восточной Азии. Это состояние не совместимо с жизнью. Беременность в подобных случаях заканчивается самопроизвольным выкидышем, мертворождением или гибелью плода в первые часы жизни (водянка плода), так как у плода не синтезируется фетальный гемоглобин (α2γ2). Свободные γ-цепи образуют тетрамеры (γ4), так называемый гемоглобин Барт. Такой гемоглобин обладает высоким сродством к кислороду, что приводит к гипоксии тканей плода, сердечной недостаточности, и, в итоге, к гибели плода. В крови – выраженные эритробластемия, гипохромия, макроцитоз, мишеневидность, анизо- и пойкилоцитоз. Электрофоретически в эритроцитах обнаруживается Hb Барт (80-90%) в сочетании с HbH.
H-гемоглобинопатия
Н-гемоглобинопатия вызвана утратой или дисфункцией трех α-глобиновых генов. Гемоглобин Н представляет собой тетрамер β4, образующийся при избытке β-цепей. Клинически близок к промежуточной форме β-талассемии.
Заболевание проявляется к концу первого года жизни гемолитической анемией различной степени выраженности. Характеризуется нетяжелым течением, значительным увеличением селезенки и печени. Отмечается слабо выраженная желтуха из-за увеличения непрямого билирубина. Концентрация гемоглобина – в пределах 70 – 80 г/л, выявляется гипохромия, мишеневидность и базофильная пунктация эритроцитов.
На фоне приема лекарственных препаратов или интеркуррентной инфекции могут развиваться гемолитические кризы с падением уровня гемоглобина до 50 г/л. При электрофорезе доля HbH составляет 5-30% при нормальном уровне HbF и снижении HbA2.
Лечение практически не отличается от лечения гетерозиготной β-талассемии.
