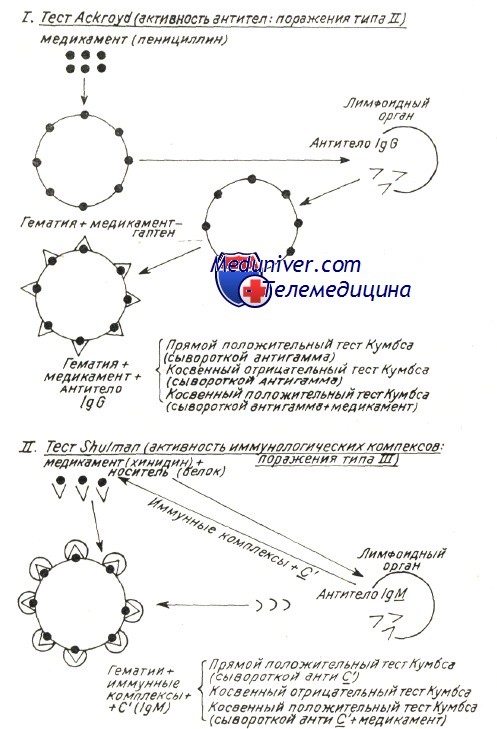
Этиология аутоиммунной гемолитической анемии
Механизмы развития аутоиммунной гемолитической анемии – патогенезВ механизме развития аутоиммунного гемолиза, независимо от вида антител, спорными представляются две проблемы: Начало аутоиммунного процесса общая проблема механизмов при всех аутоиммунных заболеваниях (Берчану), среди которых аутоиммунная гемолитическая анемия представляется как постоянная модель патогенетического исследования, применимая ряду аутоиммунных процессов. Существует ряд объяснений, в зависимости от вида аутоиммунной гемолитической анемии. Так, при вторичных формах после вирусной инфекции или сенсибилизации к медикаментозным препаратам происходит изменение антигенных структур оболочки эритроцита в результате собственно действия вируса или медикаментозного препарата. Прикрепление частиц вируса и химических антигенов к оболочке может создать новый иммуногенный комплекс, в котором инородные антигены выполняют роль сенсибилизирующего гаптена. Развивающиеся при этом антитела активны также в отношении антигенов эритроцитной оболочки и обусловливают расплавление крови. Таков механизм гемоцитолиза, описанный Ackroyd при гемоцитопении за счет сенсибилизации к медикаментозным препаратам. Поражение оболочки под воздействием вируса, медикаментозного препарата и прочих токсических веществ химической или инфекционной природы — среди широкого диапазона антигенов эритроцита — может «вскрыть» и его слабые антигены. Известно, что к последним иммуная переносимость небольшая, и что, под действием собственно острого, в частности хронического инфекционного процесса она нарушается, в результате чего развиваются аутоиммуные антиэритроцитные антитела, специфичные в отношении слабых антигенов. Проведенные в этом направлении исследования в условиях аутоиммунной гемолитической анемии доказали, что полные или неполные тепловые или холодовые антитела, выявляемые описанными выше способами в своем большинстве располагают групповой специфичностью, подобно изоантителам изоиммуной гемолитической анемии. Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy) В таблице приведены не только физическая и биологическая характеристики антител, но и их групповая специфичность. Тепловые антитела вида IgG, выявляемые посредством прямой или косвенной реакции Кумбса с применением сыворотки антигамма и исследованные после их смыва с красных кровяных клеток, равно как и свободные антитела сыворотки специфично изоиммунные в отношении определенного резус-фенотипа. По данным Worlledge 38% тепловых антител антирезус, в то время как Weiner и Vos утверждают, что, с учетом форм резус с «делецией гена» эта пропорция равняется 70%. Доказать это удалось после пересмотра случаев, оказавшихся отрицательными к резус-специфичным антителам, но в которых, тем не менее, определяется наличие специфичности к более слабым резус-антигенам. Это антитела специфичные в отношении «нулевых» резус-гематий или тех, которые содержат лишь антигены ZW, рассматриваемые как D-like (Dacie и Worlledge, Eyster). Видимо они представляют собой антигенное вещество предшествующее антигенам резус-группы (Weiner и сотр.). Итак, иммунологические анализы доказали специфичность тепловых антител, при этом был уточнен ряд подгрупп Rr”, h’ в рамках Rh наряду с группами ZW, реже JK и К (Yokoyama). Резус и иммуноглобулиновая специфичности объясняют их закрепление на красных кровяных клетках, но без связывания комплемента; это последнее явление видимо можно проследить лишь в отдельных подклассах иммуноглобулинов. По Muller-Eberhard связывание комплемента наблюдается только на подгруппах IgG1…IgG3 (исключается IgG4). В связи с этим не дано объяснение тому факту, что тепловые антитела, в принципе относящиеся к подгруппе IgG1 с анти-резус специфичностью, либо не связывают комплемент, либо связывают его очень редко.
Холодовые антитела проявили специфичность также к слабым антигенам, таким как антиген 1, который, вопреки этой слабости выявляется в размере примерно 100% той или иной популяции, как отметили Weiner и Vos на 20 тыс. образцов отобранной сыворотки. Лишь небольшой процент располагает специфичностью к антигену i, как было обнаружено в редких случаях гемолитической анемии после инфекционного моно-нуклеоза (Walheim и сотр.). Итак, удалось определить, что располагающие групповой специфичностью анти-I антитела это связывающие комплемент IgM. Другой механизм развития аутоантител можно проследить при гемолитической анемии за счет злокачественной лимфопролиферации, когда происходит расстройство клеточной системы иммунитета (КСИ). Следует предполагать, что в процессе злокачественной эволюции лимфоцитов в условиях хронической лимфатической лейкемии, ЛС или даже ОЛЛ разрастанием охвачены также «клоны» клеток, которые, по теории Burnet, рассматриваются как «запрещенные ». Таковыми являются линии лимфоидных клеток, ответственных за переносимость к сельфу, но остающихся неактивными или «спящими» в период зародышевой «клональной селекции» (Burnet). Их злокачественная пролиферация видимо обусловливает и развитие специфических антител к сельф-антигенам эритроцита в результате активации последних. Однако злокачественная пролиферация может ограничиться активными лимфоидными клетками вида В, ускальзывающими от избирательного угнетающего контроля клеток Т, сохраняющих врожденную иммуную переносимость. Таким образом создается иммуная функциональная диссоциация, обусловливающая выработку аутоиммуных антител. Независимо от гипотезы клиническое наблюдение доказало, что развитие антител и гемолиз прекращаются лишь после уничтожения образующего аутоантитела злокачественного клонуса, посредством цитостатической терапии. Возможно, что механизм пролиферации «запрещенных» клонусов действует и при гемолитической анемии с холодовыми антителами как следствие вирусной инфекции, такой как вирусная пневмония. Известно, что у индивидов в норме титр антител — холодовых агглютининов — невелик, составляя примерно 1/8—1/16. Резкая пролиферация за счет вирусной инфекции обусловливает активацию отдельных латентных лимфоидных клонусов, которые, возможно, ответственны за образование холодовых агглютининов (Van Loghem). В таких случаях, когда, по истечении определенного периода, расплавление крови не прекращается, показанная при гемолитической анемии с Холодовыми антителами цитостатическая терапия может оказать угнетающее действие на эти разросшиеся и образующие аутоантитела клонусы, подобно тому как наблюдается при злокачественной лимфопролиферации. Поскольку присутствие гемолитических аутоантител наблюдается и при некоторых реактивных процессах пролиферации во многих аутоиммунных и иммунодефицитных заболеваниях (Берчану) принято считать, что у подобных больных происходит более сложное нарушение иммунитета, неустойчивость гомеостатической системы иммунитета. В связи с этим, у страдающих иммунодефицитом к нонсельфу возможны отклонения иммунитета с понижением переносимости к сельфу. В механизме развития аутоиммунных заболеваний выявлено определенное отношение между иммунодефицитами к нонсельфу, состояниями гиперсенсибилизации, обусловливающими иммуные комплексы путем хронических неконтролируемых инфекций и развитием аутоиммуной болезни (Берчану). Тот факт, что аутоиммунные процессы, такие как аутоиммунная гемолитическая анемия при заболеваниях за счет отсутствия антител, улучшаются или даже исцеляются правильным назначением иммуноглобулина, подтверждает наличие нарушенного равновесия и лабильности иммунитета. И наконец, принято считать, что при определенных вирусных или микробных инфекциях, в частности отдельных новообразованиях — яичниковых и желудочных (Van Loghem) — в организме появляются антигены, структура которых близка к структуре антигенов отдельных эритроцитных групп. Эти перекрестнореагирующие антигены определяют развитие перекрестнореагирующих антител гемолитического действия и в отношении эритроцитов.
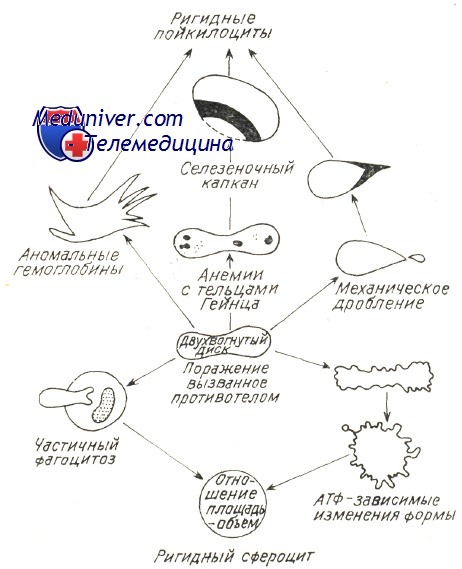
Во всех отмеченных стимулирующих иммунитет механизмах в патологических условиях (злокачественная лимфопролиферация, хроническое заболевание с чрезмерной нагрузкой на иммуную систему, заболевать за счет иммунодефицита), особенно когда аутоиммуная гемолитическая болезнь носит многолетний затяжной характер, следует предполагать нарушение врожденной иммуной переносимости с образованием гемолитических аутоантител, равно как и прочие аутоиммуные расстройства (Берчану). В принципе нарушается наиболее слабая иммуная переносимость к антигенам невысокой иммуногенной способности — Rh, I, i, Т. Реже встречаются случаи нарушения переносимости к крепким антигенам группы АВО, причем они редки в условиях злокачественной лимфопролиферации, когда развиваются «панагглютинины», расплавляющие эритроциты всех групп и переливание крови становится весьма опасным. По новым гипотезам о развитии аутоиммуных заболеваний предполагается наличие нарушения сотрудничества систем Th и Т8; дефицит Ts способствует дерепрессии «запрещенных » клонов В и выделению аутоантител (Берчану). Разрушение красных кровяных клеток в условиях аутоиммуного гемолиза подвергалось основательным исследованиям, в частности изучением реакций в пробирке между антителами и эритроцитами; при этом наблюдалось и действие комплемента в условиях гемолиза за счет холодовых антител, в частности при пароксизмальной холодовой анемии (Rosse и Dovramashkin). Электронномикроскопическое исследование оболочки эритроцита в условиях острого гемолиза при пароксизмальной гемоглобинурии показало, что, под воздействием связывающих комплемент холодовых антител на оболочке образуются «поры ». В связи с этим нарушается обмен катионов после проникновения воды в гематии и развивается острое внутрисосудистое расплавление крови. Поскольку существуют не расплавляющиеся гематии, со связанным на их оболочке комплементом, равно как и находящиеся в процессе расплавления гематии, на которых закрепляются лишь антитела (IgG), принято считать, что антитела необходимы для развертывания приоцесса гемолиза, который, следовательно, прижизненно не представляется возможным лишь под воздействием комплемента (Evans и сотр.). Фракции связанного комплемента видимо направляют механизм расплавления. Фракция С3 играет первостепенную роль в процессе гемолиза с холодовыми антителами. Issit установил роль фракции С3b, как при внутрисосудистом, так и печеночном внутриклеточном расплавлении крови. Явление пожирания красных кровяных клеток периферическими моноцитоидными макрофагами, неизменно наблюдаемое при гемолизе в условиях пароксизмальной гемоглобинурии, равно как и гистопатологическое исследование оперированной селезенки (Jandl) уже давно уточнили этот механизм. Недавно проведенные исследования выявили, что, в концентратах периферических лейкоцитов, несущие на себе Иг и комплемент эритроциты пожираются моноцитами. В зависимости от концентрации иммунных комплексов на эритроцитах увеличивается процент эритрофагоцитоза и наблюдается явление расположения розеткой гематий вокруг макрофагов (Abramson и сотр., Huber, и сотр.). В условиях аутоиммуной гемолитической болезни доказано наличие ряда механизмов внутриклеточного патологического расплавления крови, сокращающего продолжительность жизни красных кровяных телец. Возможно неполные антитела типа IgG или закрепленный на оболочке комплемент изменяют функциональную структуру эритроцита в отношении его подвижности в синусоидных органах, печени и селезенке, затем, посредством явления «секвестрации», его захватывает и разрушает макрофаг. Недавно уточнилось, что в селезенке, секвестрация осуществляется макрофаговыми рецепторами на несущий эритроцитом IgG. Макрофаги печени располагают рецепторами на С, вот почему несущие этот иммуноглобулин эритроциты разрушаются преимущественно в печени (Brown, Гологан и Берчану, Берчану). Этим объясняется положительный результат удаления селезенки лишь при гемолитической анемии с тепловыми антителами типа IgG (Бутояну и Берчану). В последние годы определилось, что в любом гемолитическом процессе, в том числе за счет ауто- или изоиммунных антител, происходит нарушение отношения объема и площади красной юровяной клетки, в связи с чем уменьшаются ее пластичность и элластичность (Weed). В главах, рассматривающих нормальное расплавление крови, говорилось о том, что элластичность гематий способствует их прохождению через поры синусовидиых эндотелиев, диаметром меньше 3 и. При этом эритроциты, располагающие большой степенью эластичности приспосабливают свою форму к размеру пересекаемого отверстия. Исследования в пробирке, при помощи оболочек с порами определенных размеров, уточнили условия прохождения в зависимости от «показателя элластичности», соответствующего показателю «фильтрации» (Jandl, Teitel). При иммуном патологическом гемолизе закрепленные на оболочке антитела или комплемент вызывают ее частичный разрыв и тем самым сокращение площади. Гематии приобретают вид сфероцита, как это отмечается в основном при приступах острого расплавления крови за счет тепловых или холодовых антител. После изменения отношения объем/площадь красные кровяные тельца становятся жесткими, пластичность понижается и прижизненно они более не проходят через поры эндотелия, а в пробирке — через поры циркуляционной мембраны. Итак наблюдается секвестрация гематий, «сенсибилизированных» гуморальными иммунными факторами, обусловливающими этим путем резкое пожирание красных кровяных клеток. Weed предложил схему, объясняющую механизм внутрисосудистого расплавления крови при любом гемолитическом эндоили экзоэритроцитном заболевании. Изменение эластичности, жесткость гематий предшествуют внутриклеточному гемолизу, обусловленному изменением количественного отношения площадь/объем и набуханием гематий в связи с изменением проницаемости или осаждением патологического гемоглобина. – Также рекомендуем “Лечение аутоиммунной гемолитической анемии – схема” Оглавление темы “Гемолитические анемии”:
|

Аутоиммунная анемия – это заболевание, которое характеризуется усиленным разрушением здоровых эритроцитов из-за агрессивного влияния на них антител. Эти антитела вырабатываются самим организмом. Проявляется патология бледностью кожных покровов, увеличением печени и селезенки в размерах, болями в пояснице и животе, одышкой и иными симптомами. Чтобы обнаружить анемию аутоиммунной природы потребуется выполнение лабораторных исследований. Лечение консервативное, хотя иногда требуется проведение операции по удалению селезенки.
Встречается аутоиммунная анемия не очень часто. От данного заболевания страдает один человек из 70-80 тысяч. Чаще диагностируется аутоиммунная анемия у женщин, возраст значения не имеет. Этот вид анемии развивается как у детей, так и у взрослых.
Как правило, диагностика анемии аутоиммунной природы не затруднена. Стандартные анализы крови позволяют выставить правильный диагноз в 90% случаев.
Полноценное выздоровление наблюдается не более чем в 50% случаев. Однако улучшение самочувствия человека на фоне лечения глюкокортикостероидами происходит в 85-90% случаев.
Содержание:
- Причины и патогенез развития аутоиммунной анемии
- Симптомы аутоиммунной анемии
- Диагностика аутоиммунной анемии
- Лечение аутоиммунной анемии
- Профилактика и прогноз заболевания
Причины и патогенез развития аутоиммунной анемии
Аутоиммунная анемия может быть идиопатической (первичной) или симптоматической (вторичной). Если причину разрушения эритроцитов установить удается, то говорят о вторичной анемии. Когда этиологический фактор остается невыясненным, то анемию называют идиопатической.
Причинами развития аутоиммунной анемии (вторичной) выступают:
Лимфобластный лейкоз острого или хронического течения.
Воздействие на организм человека радиации.
Наличие в организме злокачественной опухоли.
Заболевания соединительной ткани, среди которых: системная красная волчанка, ревматическая лихорадка, системная склеродермия и пр.
Перенесенные инфекции, например, микоплазмоз и цитомегаловирусная инфекция.
Аутоиммунные заболевания не связанные с поражение кроветворной системы, например, тиреоидит, болезнь Крона, саркоидоз и пр.
Сахарный диабет первого типа.
Лечение антибиотиками из группы цефалоспоринов или пенициллинов.
Иммунодефицитные состояния.
Чаще остальных встречается тепловая форма аутоиммунной анемии, когда внутренняя среда организма имеет нормальные температурные значения, а на эритроцитах расположены иммуноглобулины класса G, а также компоненты С3 и С4. Разрушение эритроцитов происходит только в селезенке при участии макрофагов.
Холодовая форма аутоиммунной анемии может иметь неустановленную причину, либо развиваться на фоне инфекции (при мононуклеозе или микоплазменной пневмонии), на фоне переохлаждения организма и при лимфопролиферативных заболеваниях. В последнем случае страдают люди старше 60 лет. Патологическая реакция в организме, сопровождающаяся разрушением красных кровяных телец, манифестирует после того, как температура в периферических сосудах снижается до 32 °C и менее. Холодовыми аутоагглютининами выступают иммуноглобулины класса М.
Гемолиз, происходящий в селезенке, часто бывает очень тяжелым. Причем иногда спасти пациента не удается.
Течение анемии, спровоцированной инфекциями, чаще всего острое. Если нарушение было вызвано неустановленной причиной, то оно приобретает хронический характер.
Редкой формой аутоиммунной анемии является пароксизмальная холодовая анемия. При этом гемолиз развивается при воздействии на организм холода. Опасность представляет даже прием холодных напитков и мытье рук в прохладной воде. Иногда такая анемия диагностируется на фоне сифилиса. Тяжесть течения заболевания варьируется от случая к случаю. Иногда может наблюдаться неизлечимая форма патологии, приводящая к летальному исходу.
Симптомы аутоиммунной анемии

Аутоиммунная анемия характеризуется двумя синдромами: анемическим и гемолитическим.
На развитие анемического синдрома указывают следующие признаки:
Бледная кожа и слизистые оболочки.
Приступы головокружения.
Частая тошнота.
Усиление сердцебиения.
Слабость, которая возникает независимо от степени физической или умственной нагрузки на человека.
Повышенная утомляемость.
Гемолитический синдром выражается следующими симптомами:
В зависимости от интенсивности гемолиза, кожа может становиться светло-желтого или темно-желтого цвета.
Селезенка увеличивается в размерах, в левом подреберье начинают беспокоить болезненные ощущения.
Моча окрашивается в коричневый цвет.
Возможно развитие ДВС-синдрома с формированием множественных тромбов и кровотечениями, которые сложно остановить.
Острая анемия чаще всего развивается на фоне инфекционного заражения организма. Поэтому кроме признаков разрушения эритроцитов, у человека появятся симптомы основного заболевания.
Холодовая аутоиммунная анемия характеризуется хроническим течением. При воздействии на организм человека низких температур, у него наблюдается побледнение пальцев рук и ног, ушных раковин, лица, а также тромбофлебиты. Могут образовываться язвы и даже гангрена. Иногда пациенты отмечают у себя развитие холодовой крапивницы. Кожные поражения сохраняются на протяжении длительного отрезка времени.
Тепловая анемия также имеет хроническое течение. Обострение патологического процесса происходит на фоне повышения температуры тела, что часто наблюдается при вирусных и бактериальных инфекциях. Характерным признаком является окрашивание мочи в черный цвет.
Острая аутоиммунная анемия характеризуется повышением температуры тела, ознобом, головными болями и головокружением. Параллельно присоединяется одышка, возникают боли в животе и в области поясницы. Кожа бледнеет, может становиться желтой, на конечностях появляются подкожные кровоизлияния. Кроме селезенки в размерах увеличивается печень.
При хроническом течении патологического процесса человек чувствует себя удовлетворительно. На имеющееся нарушение может указывать увеличение селезенки в размерах и периодически возникающая желтуха. Приступы ремиссии чередуются с приступами обострения.
Диагностика аутоиммунной анемии

Чтобы выставить верный диагноз, внешнего осмотра пациента недостаточно. Помимо сбора анамнеза, потребуется сдача крови. Анализ крови указывает на увеличение показателей СОЭ, также обнаруживается ретикулоцитоз, нормо- или гипохромная анемия, увеличение уровня билирубина в крови. При этом уровень гемоглобина и эритроцитов снижается.
Обязательно нужно сдать на анализ мочу. В ней будет выявлен белок, избыточное количество гемоглобина и уробилина.
Также пациента направляют на прохождение УЗИ внутренних органов с исследованием состояния печени и селезенки.
Если полученных данных недостаточно для того, чтобы выставить верный диагноз, то необходим забор костного мозга, для чего выполняют его пункцию. После исследования полученного материала можно будет обнаружить гиперплазию тканей мозга, которая происходит за счет активизации эритропоэза. Аналогичную цель, что и пункция костного мозга, преследует диагностическая процедура под названием трепанобиопсия. Однако она тяжелее переносится пациентами, поэтому применяют ее редко.
Прямая проба Кумбса при аутоиммунной анемии будет положительной. Однако при получении отрицательных результатов пробы, исключать аутоиммунную анемию нельзя. Это часто наблюдается на фоне лечения гормональными препаратами или при слишком интенсивном гемолизе.
Иммуноферментный анализ позволяет выявить тот класс и тип иммуноглобулинов, которые принимают участие в аутоиммунной реакции.
Лечение аутоиммунной анемии
Лечение анемии аутоиммунной природы чаще всего длительное и не всегда заканчивается полным выздоровлением пациента. Для начала нужно определиться с причинами, которые привели к тому, что организм начала разрушать собственные эритроциты. Если этиологический фактор удается выявить, то следует направить усилия на его устранение.
Если причина остается неустановленной, то есть диагноз звучит как «идиопатическая аутоиммунная анемия», то пациенту назначают препараты из группы глюкокортикостероидов. Препаратом выбора является Преднизолон. Если течение анемии тяжелое и уровень гемоглобина в крови снижается до 50 г/л, то обойтись без переливания эритроцитарной массы невозможно.
Дезинтоксикацию крови выполняют для того, чтобы вывести из нее продукты распада красных кровяных телец и улучшить самочувствие человека. Плазмаферез дает возможность снизить уровень антител, которые циркулируют в кровеносном русле. Обязательно проводится симптоматическое лечение. Для предупреждения развития ДВС синдрома больному назначают непрямые антикоагулянты. Чтобы поддержать систему кроветворения, показано введение витамина В12 и фолиевой кислоты.
Если удалось справиться с болезнью, то на этом терапия завершается. Когда спустя некоторое время аутоиммунная анемия возникает вновь, пациента направляют на операцию по удалению селезенки. Это позволит не допустить развития гемолитических кризов в будущем, так как именно селезенка является «кладбищем» для эритроцитов в человеческом организме. К полному выздоровлению эта процедура приводит довольно часто, примерно в 74-85% случаев.
Иммуносупрессивная терапия – это крайняя мера в лечении аутоиммунной анемии, к которой прибегают лишь в том случае, когда спленэктомия не дает добиться желаемых результатов.
Профилактика и прогноз заболевания

Чтобы не допустить развития анемии, необходимо направить усилия на предотвращение инфицирования человека опасными вирусами, которые могут спровоцировать болезнь. Если анемия уже развилась, то следует минимизировать воздействие на организм тех факторов, которые могут вызвать ее обострение, например, избегать высоких или низких температур.
Предотвратить развитие идиопатической анемии невозможно, так как ее причины являются неустановленными.
Если пациент хотя бы раз перенес эпизод аутоиммунной анемии, то последующие два года он должен сдавать кровь на общий анализ. Делать это нужно с периодичностью в 3 месяца. Любые симптомы, которые могут указывать на развивающуюся вновь анемию, должны быть немедленно оценены врачом.
Что касается прогноза, то идиопатическая анемия труднее поддается лечению. Полного выздоровления после прохождения гормонального курса удается добиться не более чем 10% пациентов. Однако удаление селезенки повышает количество выздоровевших людей до 80%. Иммуносупрессивную терапию пациентам перенести сложно, такое лечение негативно воздействует на иммунитет и вызывает множественные осложнения. Успех лечения во многом зависит от того фактора, который стал причиной развития анемии.
Автор статьи: Шутов Максим Евгеньевич | Гематолог
Образование:
В 2013 году закончен Курский государственный медицинский университет и получен диплом «Лечебное дело». Спустя 2 года окончена ординатура по специальности «Онкология». В 2016 году пройдена аспирантура в Национальном медико-хирургическом центре имени Н. И. Пирогова.
Наши авторы