К какому уровню организации относится гемоглобин
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
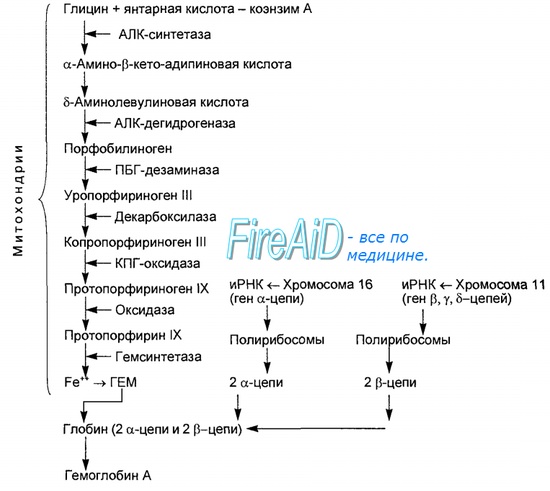
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Источник
Гемоглобин человека
Гемоглобин – сложный железосодержащий белок, относится к классу гемопротеинов. Выполняет две важные функции:
1. перенос кислорода из легких к периферическим тканям;
2. участие в переносе СО 2 и протонов из периферических тканей в легкие.
Молекула гемоглобина взаимодействует с различными лигандами, образуя производные гемоглобина.
1. Дезоксигемоглобин – ННb – не связанный с кислородом и содержащий гем с двухвалетным железом Fe 2+ .
2. Оксигемоглобин – ННbO 2 – полностью оксигенированный гемоглобин, связанный с четырьмя молекулами кислорода.
3. Карбгемоглобин – ННbCO 2 – гемоглобин, связанный с СО 2. Выполняет функцию выведения СО 2 из тканей к легким. Соединение нестойкое, легко диссоциирует в легочных капиллярах. Этим путем выводится до 10–15% СО2.
4. Карбоксигемоглобин – ННbСО – образуется при отравлении оксидом углерода (II). Сродство гемоглобина к СО примерно в 300 раз выше, чем к кислороду, при этом гемоглобин теряет способность связывать кислород и наступает смерть от удушья.
5. Метгемоглобин – MetHb – образуется при действии окислителей (нитрит натрия, нитробензол). Содержит железо в трехвалентной форме Fe 3+ и теряет способность к переносу кислорода. В норме образуется небольшое количество метгемоглобина – примерно 0,5 % в сутки.
Варианты гемоглобина в онтогенезе
Количество и состав фракций гемоглобина изменяется в процессе онтогенеза. Все гемоглобины представляют собой тетрамеры, построенные из разного набора субъединиц (?, ?, ?, ?) и преимущественно образуются на разных этапах развития организма человека – от эмбрионального до взрослого состояния. Различают следующие физиологические типы гемоглобинов: примитивный гемоглобин НbР, фетальный гемоглобин HbF (fetus – плод), гемоглобин взрослых HbA, HbA 2, HbA 3 (adultus – взрослый).
Примитивный гемоглобин – синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Состоит из двух ?- и двух ?-цепей (2?, 2?). Через две недели после формирования печени плода в ней начинает синтезироваться HbF, который к шести месяцам полностью замещает НbР.
Фетальный гемоглобин – синтезируется в печени и костном мозге плода до периода его рождения. Состоит из двух ?- и двух ?-цепей (2?, 2?). Характеризуется более высоким сродством к кислороду и обеспечивает эффективную доставку кислорода к эмбриону из системы кровообращения матери. HbF является главным типом гемоглобина плода. Кровь новорожденного содержит до 80% HbF, но к концу 1-го года жизни он почти целиком заменяется на HbA. В крови взрослого человека присутствует в минимальном количестве – до 1,5% от общего количества гемоглобина.
Гемоглобин А – основной гемоглобин взрослого человека (96 % от общего количества). Начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода. HbA состоит из двух ?- и двух ?-цепей.
Минорные гемоглобины:
1. HbA2 — 2? 2?, в крови взрослого человека примерно 2,6 % HbA2. Обладает большим сродством к кислороду.
2. HbA3 — 2? 2?, однако имеются изменения в строении ?-цепей по сравнению с HbA. Появляется в крови в небольших количествах при старении.
Все структурные аномалии белковой части гемоглобина называют гемоглобинозами.
Гемоглобинопатии – наследственные изменения структуры какой-либо цепи нормального гемоглобина вследствие точечных мутаций генов. Известно около 300 вариантов HbA, имеющих в первичной структуре ?- или ?-цепи незначительные изменения. Некоторые из них практически не влияют на функции белка и здоровье человека, другие – вызывают значительные нарушения функции HbA и развитие заболеваний различной степени тяжести.
В аномальных гемоглобинах изменения могут затрагивать аминокислоты:
1. находящиеся на поверхности белка;
2. участвующие в формировании активного центра;
3. аминокислоты, замена которых нарушает трехмерную конформацию молекулы;
4. аминокислоты, замена которых изменяет четвертичную структуру белка и его регуляторные свойства.
Аномальные гемоглобины отличаются от HbA по первичной структуре, форме, величине заряда. При этом изменяются такие свойства как сродство к кислороду, растворимость, устойчивость к денатурации и др.
1. Серповидноклеточная анемия. Наследственное заболевание, связанное с заменой глутаминовой кислоты в 6-м положении (с N-конца) на валин в ?-цепях молекулы гемоглобина S. Растворимость дезоксигемоглобина S значительно снижена. Его молекулы начинают «слипаться», образуя волокнистый осадок, который деформирует эритроцит, придавая ему форму серпа (полумесяца). Такие эритроциты плохо проходят через капилляры тканей, закупоривают сосуды и создают локальную гипоксию. Они быстро разрушаются и возникает гемолитическая анемия. Дети, гомозиготные по мутантному гену, часто умирают в раннем возрасте. Болезнь распространена в странах Южной Америки, Африки и Юго-Восточной Азии.
2. Гемоглобин М – в результате мутации в гене происходит замена в ?- или ?-цепи гистидина (в 7-м или 8-м положении) на тирозин. В результате этого Fe 2+ окисляется в Fe 3+ и образуется метгемоглобин, не способный связывать кислород. Развивается цианоз и гипоксия тканей.
Талассемии – наследственные заболевания, связанные с нарушением синтеза ?- или ?-цепей.
?-талассемии развиваются в результате снижения синтеза ?-цепей. Проявляется после рождения, при этом в крови наряду с НbА появляется до 15 % НbА2 и 15–60 % HbF. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки и сопровождается гемолитической анемией.
?-талассемии возникают при нарушении синтеза ?-цепей. При полном отсутствии ?-цепей наступает внутриутробная гибель плода, так как не образуется HbF, а тетрамеры ? 4 обладают высоким сродством к кислороду и не способны выполнять транспортную функцию, что ведет к развитию тканевой гипоксии и к смерти вскоре после рождения.
источник
Белок гемоглобин следует отнести к уровню организации
Выберите примеры функций белков, осуществляемых ими на клеточном уровне жизни.
1) обеспечивают транспорт ионов через мембрану
2) входят в состав волос, перьев
3) формируют кожные покровы
4) антитела связывают антигены
5) запасают кислород в мышцах
6) обеспечивают работу веретена деления
1) транспортная (гемоглобин переносит газы в крови, трансферин переносит железо; миоглобин мышечной клетки связывает кислород, аккумулируя его в клетке);
2) каталитическая, или ферментативная (белки-ферменты: амилаза, пепсин, липаза и др.);
3) регуляторная (белки-гормоны регулируют процессы в организме);
4) защитная (защитные белки антитела – иммуноглобулины и интерферон);
5) сократительная (актин и миозин в составе двигательного аппарата клетки);
6) структурная (коллаген, кератин и др., входят в состав различных структур);
7) запасающая (альбумин, козеин);
8) рецепторная, или сигнальная (опсин в составе пигмента родопсина сетчатки глаза, обеспечивает преобразование световой волны в нервный импульс).
9) энергетическая (клейковина и др., при расщеплении 1 г белка выделяется более 17 кДж энергии).
Под цифрами 1, 5 и 6 — это функций белков, осуществляемых ими на клеточном уровне жизни. Под цифрами 2, 3 и 4 — это функций белков, осуществляемых ими на организменном уровне жизни.
В критериях ответов «Тренировочной работы. 12.02.2013 г» заложен был верный ответ: 146. НО:
Защитные белки выполняют функцию защиты организма от вторжения других организмов или предохранения его от повреждений. Эту функцию выполняют иммуноглобулины (или антитела ), образующиеся у позвоночных, обладающие способностью распознавать чужеродные клетки, — проникшие в организм бактерии или вирусы или клетки самого организма, переродившиеся в раковые, — а также чужеродные для организма белки, и прочно связываться с ними.
Запасают кислород в мышцах. Белки служат для запасания (миоглобин) и переноса (гемоглобин, гемоцианин) кислорода. Миоглобин служит депо кислорода, запасая его для последующего потребления. Миоглобин может служить простым накопителем кислорода. Это является причиной увеличения концентрации миоглобина в мышечных тканях таких ныряющих млекопитающих, как киты. Кроме того, миоглобин содействует передвижению кислорода и поддержанию его парциального давления в пределах клетки.
источник
Аттестация по биологии (объединение «Юный биолог»)
Итоговая аттестация по биологии
1 . В отличие от молекул ДНК молекулы белка содержат атомы:
а) серы;
б) водорода;
в) азота;
г) молекулы белка и ДНК содержат одни и те же атомы.
2 . Мутации происходят в результате изменений в:
а) ДНК;
б) клеточных структурах;
в) обмене веществ;
г) белке.
3 . Если взять для синтеза белка рибосомы и ферменты от бактерии, АТФ и АДФ и аминокислоты от гриба, ДНК от ящерицы, то будут синтезироваться белки:
а) гриба;
б) ящерицы;
в) бактерии;
г) всех трех организмов.
4 . Живая система, соответствующая биомолекулярному уровню организации живой материи:
а) хлоропласт растения;
б) яйцеклетка млекопитающего;
в) вирус гриппа;
г) таких живых систем вообще на Земле нет.
5 . Химический элемент, являющийся обязательной составной частью белка гемоглобина у млекопитающих:
а) цинк;
б) медь;
в) хлор;
г) железо.
6 . Для быстрого восстановления работоспособности при усталости в период подготовки к экзамену лучше съесть:
а) яблоко;
б) кусок сахара;
в) бутерброд;
г) кусок мяса.
7 . Растительная клетка, в отличие от животной, содержит:
а) рибосомы;
б) вакуоли, пластиды и целлюлозную оболочку;
в) запасные питательные вещества;
г) больше хромосом в ядре.
8 . Все перечисленные организмы относятся к прокариотам:
а) бактерии, дрожжи, синезеленые водоросли;
б) бактерии, синезеленые водоросли;
в) дрожжи, бактерии;
г) вирусы и бактерии.
9 . Клеточные ядра есть у всех перечисленных организмов:
а) попугай, мухомор, береза;
б) кошка, азотфиксирующие бактерии;
в) кишечная палочка, аскарида;
г) аскарида, вирус СПИДа, осьминог.
10 . Из перечисленных клеток больше митохондрий в:
а) яйцеклетках птиц;
б) эритроцитах млекопитающих;
в) сперматозоидах млекопитающих;
г) зеленых клетках растений.
11 . Химические реакции анаболизма преобладают в клетках:
а) растений;
б) грибов;
в) животных;
г) уровень анаболизма у всех одинаков.
12 . Участие в половом размножении у многоклеточных организмов принимают клетки:
а) споры;
б) яйцеклетки и сперматозоиды;
в) соматические;
г) различные, в зависимости от обстоятельств.
а) совокупность и порядок всех химических реакций в клетке;
б) жизнь клетки от деления до деления;
в) жизнь клетки от деления и до деления плюс время самого деления;
г) время, когда клетка готовится к делению.
14 . Соматическая клетка диплоидного организма перед вступлением в стадию митоза имеет набор хромосом:
а) диплоидный (2 n );
б) гаплоидный ( n );
в) тетраплоидный (4 n );
г) в зависимости об обстоятельств.
15 . Набор хромосом гаплоидный в:
а) яйцеклетке курицы;
б) клетках семени пшеницы;
в) лейкоцитах человека;
г) покровных клетках высших растений.
16 . Способы размножения, характерные только для растений:
а) семенами, усами, спорами;
б) луковицей, усами, отводками;
в) семенами, отводками, спорами;
г) делением клетки, луковицей, усами.
17 . Преимущества полового размножения по сравнению с бесполым:
а) в простоте процесса;
б) в сложности процесса;
в) в большем генетическом разнообразии особей следующего поколения;
г) в ускорении роста численности вида.
18 . Этап мейоза и причина, по которой в половой клетке могут возникнуть мутации:
а) в результате кроссинговера в профазе I;
б) в результате неправильного расхождения хромосом в телофазе I или II;
в) в результате радиоактивного облучения организма во время образования половых клеток;
г) по любой из перечисленных причин.
19 . Группа живых систем, представляющая организменный уровень организации:
а) яблоня, яблоко, гусеница яблочной плодожорки;
б) яблоня, дождевой червь, цветок яблони;
в) яблоня, дождевой червь, гусеница;
г) яблоко, гусеница, дождевой червь.
20 . Правильная последовательность начальных этапов онтогенеза:
а) зигота, гаструла, бластула;
б) оплодотворение, гаструла, бластула;
в) гаметогенез, оплодотворение, бластула, гаструла;
г) не верен ни один из ответов.
21 . Оплодотворение в женском организме у человека в норме происходит:
а) в матке;
б) в верхнем отделе маточных труб;
в) во влагалище;
г) в яичниках.
22 . Для зачатия двух однояйцевых близнецов необходимо оплодотворение:
а) одной яйцеклетки двумя сперматозоидами;
б) двух яйцеклеток одним сперматозоидом;
в) двух яйцеклеток двумя сперматозоидами;
г) одной яйцеклетки одним сперматозоидом.
23 . Больше гетерозиготных особей получится от скрещивания:
24 . Набор половых хромосом в норме у петуха:
25 . Если у родителей I и IV группы крови, то у детей могут быть группы крови:
а) только I;
б) только IV;
в) только II или III;
г) только I или IV.
26 . Впервые открыл и описал фундаментальные законы распределения генов в потомстве при скрещивании гибридов:
а) Ж.-Б. Ламарк;
б) Г.Мендель;
в) Ч.Дарвин;
г) Н.И. Вавилов.
27 . Единицей эволюции является:
а) особь;
б) вид;
в) популяция;
г) экосистема.
28 . Примером ненаследственной изменчивости может служить:
а) появление альбиноса в потомстве львиного прайда;
б) увеличение процента жирности молока у коров при изменении состава и режима кормления;
в) увеличение процента жирности молока у коров высокопродуктивной породы;
г) потеря зрения у крота в результате эволюции.
29 . Фактором, определяющим направление эволюции, является:
а) изоляция;
б) мутация;
в) естественный отбор;
г) колебания численности популяций.
30 . Примером ароморфоза является:
а) появление легочного дыхания у земноводных;
б) плоская форма тела у придонных рыб;
в) отсутствие цвета у пещерных животных;
г) наличие шипов и колючек у плодов растений.
31 . Наличие микробов в окружающей организм среде – это:
а) абиотический экологический фактор;
б) биотический экологический фактор;
в) антропогенный фактор;
г) ограничивающий фактор.
32. Примером биогеоценоза может служить:
а) пруд со всеми обитателями;
б) аквариум;
в) все живые обитатели пруда;
г) все представители флоры пруда.
33. Бурый медведь в природной экосистеме выступает в роли консумента третьего порядка, когда ест:
а) ягоды;
б) щуку;
в) кабана;
г) луковицы травянистых растений.
34 . Сигналом для начала миграций у перелетных птиц является:
а) наступление холодов;
б) возраст птенцов;
в) изменение долготы дня;
г) отсутствие корма.
35 . Неотъемлемым компонентом всех природных экосистем являются:
а) грибы и бактерии;
б) травоядные животные;
в) плотоядные животные;
г) насекомые.
36 . В пищевой цепи трава – кузнечики – ящерицы – совы для существования пары сов с общим весом в 5 кг необходимо травы:
а) 50 т;
б) 5 т;
в) 500 кг;
г) 2,5 т.
37 . Укажите, между какими видами могут возникать конкурентные взаимоотношения:
а) человек и тараканы;
б) ястреб и волк;
в) лось и мышь;
г) мустанг и бизон.
38 . Взаимоотношения человека и кишечной палочки – это пример:
а) паразитизма;
б) конкуренции;
в) нахлебничества;
г) симбиоза.
39. Газовую функцию живого вещества на Земле осуществляют:
а) только растения;
б) растения и некоторые бактерии;
в) растения, бактерии и животные;
г) все живые существа.
40. «На земной поверхности нет химической силы, более постоянно действующей, а потому и более могущественной по своим конечным последствиям, чем живые организмы, взятые в целом». Эти слова принадлежат:
а) Н.И. Вавилову;
б) В.И. Вернадскому;
в) Д.И. Менделееву;
г) К.Э. Циолковскому.
источник
Виды гемоглобина и его соединения, их физиологическое значение
Гемоглобин относится к числу важнейших дыхательных белков, принимающих участие в переносе кислорода от легких к тканям. Он является основным компонентом эритроцитов крови, в каждом из них содержится примерно 280 млн молекул гемоглобина.
Гемоглобин является сложным белком, который относится к классу хромопротеинов и состоит из двух компонентов:
1. железосодержащего гема – 4 %;
Гем является комплексным соединением порфирина с железом. Это соединение довольно неустойчивое и легко превращается либо в гематин, либо в гемин. Строение гема идентично для гемоглобина всех видов животных. Отличия связаны со свойствами белкового компонента, который представлен двумя парами полипептидных цепей. Различают HbA, HbF, HbP формы гемоглобина.
В крови взрослого человека содержится до 95–98 % гемоглобина HbA. Его молекула включает в себя 2 α– и 2 β-полипептидные цепи. Фетальный гемоглобин в норме встречается только у новорожденных. Кроме нормальных типов гемоглобина, существуют и аномальные, которые вырабатываются под влиянием генных мутаций на уровне структурных и регуляторных генов.
Внутри эритроцита молекулы гемоглобина распространяются по-разному. Вблизи мембраны они лежат к ней перпендикулярно, что улучшает взаимодействие гемоглобина с кислородом. В центре клетки они лежат более хаотично. У мужчин в норме содержание гемоглобина примерно 130–160 г/л, а у женщин – 120–140 г/л.
Выделяют четыре формы гемоглобина:
1. Оксигемоглобин — содержит двухвалентное железо и способен связывать кислород. Он переносит газ к тканям и органам.
2. Метгемоглобин — содержит трехвалентное железо, не вступает в обратимую реакцию с кислородом и обеспечивает его транспорт.
3. Карбоксигемоглобин — образует соединение с угарным газом. Он обладает высоким сродством с окисью углерода, поэтому комплекс распадается медленно. Это обусловливает высокую ядовитость угарного газа.
4. Миоглобин — по структуре близок к гемоглобину и находится в мышцах, особенно в сердечной. Он связывает кислород, образуя депо, которое используется организмом при снижении кислородной емкости крови. За счет миоглобина происходит обеспечение кислородом работающих мышц.
Гемоглобин выполняет дыхательную и буферную функции. 1 моль гемоглобина способен связать 4 моля кислорода, а 1 г – 1,345 мл газа. Кислородная емкость крови – максимальное количество кислорода, которое может находиться в 100 мл крови. При выполнении дыхательной функции молекула гемоглобина изменяется в размерах. Соотношение между гемоглобином и оксигемоглобином зависит от степени парциального давления в крови. Буферная функция связана с регуляцией pH крови.
Не нашли то, что искали? Воспользуйтесь поиском:
источник
Источник
