Как будут лечить серповидно клеточную анемию в будущем

Серповидно-клеточная анемия. Причины, симптомы, диагностика и лечение серповидно-клеточной анемии.
- простуда
- головокружение
- тошнота
1. Что такое серповидно-клеточная анемия и ее причины
Серповидно-клеточная анемия – это наследственное заболевание крови. Попробуем разобраться, в чем же оно заключается. Эритроциты крови содержат гемоглобин – белок, который переносит кислород в крови. В норме эритроциты имеют круглую форму и они гибкие, что позволяет им двигаться через мелкие кровеносные сосуды, чтобы доставить кислород ко всем частям тела.
Серповидно-клеточная анемия заставляет клетки крови принимать форму полумесяца, или серпа. В такой форме клеток крови эритроциты очень легко распадаются, что вызывает анемию. Серповидные красные клетки живут всего 10-20 дней вместо 120 дней, как бывает в норме у здоровых клеток. Кроме того, поврежденные эритроциты слипаются и прилипают к стенкам кровеносных сосудов, блокируя поток крови. Это может стать причиной сильных болей и постоянного повреждения мозга, сердца, легких, почек, печени, костей и селезенки.
Причины серповидно-клеточной анемии
Серповидно-клеточная анемия человека вызывается генетической аномалией в гене гемоглобина. Эта аномалия приводит к появлению серповидного гемоглобина. Когда кислород высвобождается от серповидного гемоглобина, он склеивается и образует длинные стержни, которые повреждают эритроцит и изменяют его форму. Серповидные эритроциты и вызывают симптомы серповидно-клеточной анемии.
Серповидно-клеточная анемия человека не заразна. Это генетическое заболевание, с которым рождается человек. Заболевание развивается, когда ребенок наследует два аномальных гена гемоглобина, по одному от каждого из родителей. Люди, которые унаследовали только один аномальный ген гемоглобина, являются его носителями, но у них не будет анемии и симптомов этого заболевания.
2. Симптомы заболевания
Симптомами серповидно-клеточной анемии могут быть:
- Сильные боли;
- Анемия;
- Боль в груди и затрудненное дыхание;
- Боль в суставах, артрит;
- Закупорка кровотока в селезенке или печени;
- Тяжелые инфекции.
У больных серповидно-клеточной анемией развивается тяжелая боль в груди, спине, руках, ногах и животе. Кроме того, боль может возникать в любой части тела. Серповидные красные кровяные клетки в легких могут вызвать серьезные заболевания с такими симптомами, как боль в груди, лихорадка и затрудненное дыхание. Серповидно-клеточная анемия может привести и к необратимым повреждениям мозга, сердца, почек, печени, селезенки и костей. Ососбенность этого заболевания в том, что тяжесть и симптомы болезни могут сильно отличаться у разных людей, даже если они являются кровными родственниками.
3. Диагностика серповидно-клеточной анемии
Серповидные эритроциты можно увидеть, когда образец крови исследуется под микроскопом. Но для диагностики серповидно-клеточной анемии человека используется специальный анализ крови – гемоглобин-электрофорез, который позволяет измерить количество аномального гемоглобина. В зависимости от установленного количества серповидного гемоглобина можно определить, является ли человек носителем гена или имеет заболевание серповидно-клеточную анемию.
Есть и быстрые скрининг-тесты, которые помогают выявить серповидные эритроциты или сгустки аномального гемоглобина, когда кислород выходит из крови. Но эти тесты применяются редко, потому что они не позволяют отличить заболевание и простое наличие гена болезни.
Перинатальная диагностика серповидно-клеточной анемии проводится путем изучения ДНК клеток плода, полученных при биопсии хориона или амниоцентеза.
4. Лечение болезни
Для лечения серповидно-клеточной анемии человека применяются:
- Опиоидные обезболивающие (например, морфин);
- Противовоспалительные препараты (например, ибупрофен);
- Антибиотики для лечения инфекций;
- Кислород;
- Внутривенное или пероральное введение специальных жидкостей.
Переливание эритроцитов может понадобиться в случае тяжелой анемии, для профилактики приступов стенокардии или перед операцией. Иногда обменное переливание осуществляется с помощью специального аппарата, который удаляет серповидные красные кровяные клетки и заменяет их на здоровые.
Для лечения серповидно-клеточной анемии может назначаться специальный препарат – гидроксимочевина. Он помогает предотвратить приступы боли. Исследования показали, что при регулярном приеме гидроксимочевины у больных серповидно-клеточной анемией уменьшается частота и тяжесть приступов боли, а также сокращается количество необходимых переливаний крови и госпитализаций.
Единственным способом действительно вылечить серповидно-клеточную анемию человека является пересадка стволовых клеток. Это достаточно новый метод лечения. Он сопряжен с серьезными рисками (около 5-10% риск смертельного исхода), но те пациенты, трансплантация стволовых клеток у которых прошла успешно, полностью вылечились от серповидно-клеточной анемии.
Пересадка стволовых клеток обычно делается молодым пациентам с тяжелой серповидно- клеточной анемией, для которых удается подобрать подходящего донора. Иногда для трансплантации стволовых клеток используется пуповинная кровь от донора-родственника.
Важно и то, что ученые постоянно изучают возможность лечения серповидно-клеточной анемии человека с помощью новых препаратов, которые предотвращают выработку серповидно- клеточных эритроцитов красных кровяных клеток и улучшают кровоток и доставку кислорода к органам и тканям. И эти новые методы лечения уже довольно успешно проходят тестовые испытания.
Вообще люди с серповидно-клеточной анемией, как правило, имеют меньшую продолжительность жизни. Но современная медицина показывает неплохие результаты. Современные методики лечения позволяют существенно продлить жизнь таким пациентам.В 1973 году средняя продолжительность жизни людей с серповидно-клеточной анемией была 14 лет, а сегодня цифра 40-50 лет является вполне реальной. Бывает, что пациенты живут 60 лет и дольше. Постоянное лечение гидроксимочевиной может продлить жизнь.

Серповидные эритроциты
Public Health Image Library
Французские и американские ученые сообщили о первом случае
излечения человека от серповидноклеточной анемии с помощью генной терапии. Пациентом
стал подросток из Франции. Описание случая приводится в New
England Journal of Medicine.
Серповидноклеточная анемия — это наследственное
заболевание, обусловленное одиночной мутацией в гене бета-субъединицы
гемоглобина (белковая часть гемоглобина состоит из двух альфа- и двух
бета-субъединиц). Дефектный гемоглобин (HbS), отдавая тканям кислород,
полимеризуется с образованием волокон, которые деформируют эритроциты,
придавая им серповидную форму. Такие эритроциты хуже проходят через мелкие
сосуды, что приводит к образованию тромбов, а также быстрее
разрушаются, из-за чего возникает анемия.
Для лечения серповидноклеточной анемии в настоящее время
одобрено только одно лекарство — гидроксимочевина. Она способствует синтезу
младенческой (фетальной) формы гемоглобина, которая снижает концентрацию HbS и
замедляет его полимеризацию. Однако препарат действует не на все клетки и
обладает множеством побочных эффектов. Небольшому числу пациентов (примерно 18
процентам) можно помочь пересадкой донорского костного мозга. Подобные виды
лечения не могут покрыть потребности всех больных, и ученые на протяжении
десятков лет занимались разработкой генной терапии заболевания. После успешных
ее испытаний на животных в 2014 году начались клинические
испытания этого метода лечения.
Одним из участников испытаний, которые продолжаются до сих
пор на базе Детской больнице Неккер в Париже, стал мальчик, болевший
серповидноклеточной анемией с рождения и наблюдавшийся в этом медучреждении. В
возрасте от двух до девяти лет пациент получал гидроксимочевину без выраженного
эффекта: у него наблюдались повторные тромбозы мелких сосудов (в том числе
дважды — легочных) и двусторонний очаговый некроз бедренных костей. С 2010 года
ему проводили профилактические переливания эритроцитарной массы.
В октябре 2014 года, когда мальчику было 13 лет, ему провели
генную терапию в соответствии с протоколом, разработанным французскими учеными
и американской компанией Bluebird Bio. На первом этапе лечения у пациента
дважды забрали ткань костного мозга (для проведения терапии и создания
резервного запаса) и выделили из нее мультипотентные кроветворные клетки (CD34+).
В эти клетки с помощью обезвреженного лентивируса ввели ген здорового варианта
бета-глобина βA-T87Q. Средняя доза геннотерапевтического препарата LentiGlobin BB305 составила
1,0 и 1,2 копии вирусного вектора на клетку.
После этого мальчику провели миелоабляцию (уничтожение
кроветворных клеток) бусульфаном. Через два дня ему ввели модифицированные клетки.
На всем протяжении лечения пациенту переливали кровь, пока уровень βA-T87Q
не достиг от 25 до 30 процентов от всего гемоглобина на 88 день терапии.
На шестой месяц уровень общего гемоглобина в крови мальчика
стабилизировался на показателях от 106 до 120 граммов на литр (около
нижней границы нормы). К девятому месяцу после введения модифицированных клеток
βA-T87Q составлял 46 процентов, а к 15 месяцу — 48 процентов от
всего гемоглобина.
В течении более чем 15 месяцев наблюдения у пациента не
наблюдалось никаких клинических событий, связанных с серповидноклеточной
анемией, показатели анализа крови нормализовались. По итогам наблюдения всю
медикаментозную терапию отменили за ненадобностью. Основные побочные эффекты
были связаны с миелоабляцией и устранены в процессе лечения.
Помимо описываемого пациента к настоящему времени терапию
препаратом LentiGlobin
BB305 получили еще несколько десятков французских и американских участников
испытаний с серповидноклеточной анемией и другим наследственным дефектом
бета-глобина — бета-талассемией. Предварительные результаты лечения признаны
обнадеживающими, однако окончательные выводы делать пока рано, пишут авторы
работы.
Недавно были разработаны несколько других экспериментальных
подходов к терапии серповидноклеточной анемии и других гемоглобинопатий. В
частности, ученые успешно испытали на мышах и клетках человека редактирование
дефектного гена с помощью системы CRISPR/Cas9,
убедились, что вещества, увеличивающие объем эритроцитов, препятствуют их
деформации, и разработали метод
генетической коррекции мутаций гемоглобина, основанный на пептидонуклеиновых
кислотах.
Олег Лищук
1.Что такое серповидно-клеточная анемия и ее причины
Серповидно-клеточная анемия – это наследственное заболевание крови. Попробуем разобраться, в чем же оно заключается. Эритроциты крови содержат гемоглобин – белок, который переносит кислород в крови. В норме эритроциты имеют круглую форму и они гибкие, что позволяет им двигаться через мелкие кровеносные сосуды, чтобы доставить кислород ко всем частям тела.
Серповидно-клеточная анемия заставляет клетки крови принимать форму полумесяца, или серпа. В такой форме клеток крови эритроциты очень легко распадаются, что вызывает анемию. Серповидные красные клетки живут всего 10-20 дней вместо 120 дней, как бывает в норме у здоровых клеток. Кроме того, поврежденные эритроциты слипаются и прилипают к стенкам кровеносных сосудов, блокируя поток крови. Это может стать причиной сильных болей и постоянного повреждения мозга, сердца, легких, почек, печени, костей и селезенки.
Причины серповидно-клеточной анемии
Серповидно-клеточная анемия человека вызывается генетической аномалией в гене гемоглобина. Эта аномалия приводит к появлению серповидного гемоглобина. Когда кислород высвобождается от серповидного гемоглобина, он склеивается и образует длинные стержни, которые повреждают эритроцит и изменяют его форму. Серповидные эритроциты и вызывают симптомы серповидно-клеточной анемии.
Серповидно-клеточная анемия человека не заразна. Это генетическое заболевание, с которым рождается человек. Заболевание развивается, когда ребенок наследует два аномальных гена гемоглобина, по одному от каждого из родителей. Люди, которые унаследовали только один аномальный ген гемоглобина, являются его носителями, но у них не будет анемии и симптомов этого заболевания.
2.Симптомы заболевания
Симптомами серповидно-клеточной анемии могут быть:
- Сильные боли;
- Анемия;
- Боль в груди и затрудненное дыхание;
- Боль в суставах, артрит;
- Закупорка кровотока в селезенке или печени;
- Тяжелые инфекции.
У больных серповидно-клеточной анемией развивается тяжелая боль в груди, спине, руках, ногах и животе. Кроме того, боль может возникать в любой части тела. Серповидные красные кровяные клетки в легких могут вызвать серьезные заболевания с такими симптомами, как боль в груди, лихорадка и затрудненное дыхание. Серповидно-клеточная анемия может привести и к необратимым повреждениям мозга, сердца, почек, печени, селезенки и костей. Ососбенность этого заболевания в том, что тяжесть и симптомы болезни могут сильно отличаться у разных людей, даже если они являются кровными родственниками.
3.Диагностика серповидно-клеточной анемии
Серповидные эритроциты можно увидеть, когда образец крови исследуется под микроскопом. Но для диагностики серповидно-клеточной анемии человека используется специальный анализ крови – гемоглобин-электрофорез, который позволяет измерить количество аномального гемоглобина. В зависимости от установленного количества серповидного гемоглобина можно определить, является ли человек носителем гена или имеет заболевание серповидно-клеточную анемию.
Есть и быстрые скрининг-тесты, которые помогают выявить серповидные эритроциты или сгустки аномального гемоглобина, когда кислород выходит из крови. Но эти тесты применяются редко, потому что они не позволяют отличить заболевание и простое наличие гена болезни.
Перинатальная диагностика серповидно-клеточной анемии проводится путем изучения ДНК клеток плода, полученных при биопсии хориона или амниоцентеза.
4.Лечение болезни
Для лечения серповидно-клеточной анемии человека применяются:
- Опиоидные обезболивающие (например, морфин);
- Противовоспалительные препараты (например, ибупрофен);
- Антибиотики для лечения инфекций;
- Кислород;
- Внутривенное или пероральное введение специальных жидкостей.
Переливание эритроцитов может понадобиться в случае тяжелой анемии, для профилактики приступов стенокардии или перед операцией. Иногда обменное переливание осуществляется с помощью специального аппарата, который удаляет серповидные красные кровяные клетки и заменяет их на здоровые.
Для лечения серповидно-клеточной анемии может назначаться специальный препарат – гидроксимочевина. Он помогает предотвратить приступы боли. Исследования показали, что при регулярном приеме гидроксимочевины у больных серповидно-клеточной анемией уменьшается частота и тяжесть приступов боли, а также сокращается количество необходимых переливаний крови и госпитализаций.
Единственным способом действительно вылечить серповидно-клеточную анемию человека является пересадка стволовых клеток. Это достаточно новый метод лечения. Он сопряжен с серьезными рисками (около 5-10% риск смертельного исхода), но те пациенты, трансплантация стволовых клеток у которых прошла успешно, полностью вылечились от серповидно-клеточной анемии.
Пересадка стволовых клеток обычно делается молодым пациентам с тяжелой серповидно- клеточной анемией, для которых удается подобрать подходящего донора. Иногда для трансплантации стволовых клеток используется пуповинная кровь от донора-родственника.
Важно и то, что ученые постоянно изучают возможность лечения серповидно-клеточной анемии человека с помощью новых препаратов, которые предотвращают выработку серповидно- клеточных эритроцитов красных кровяных клеток и улучшают кровоток и доставку кислорода к органам и тканям. И эти новые методы лечения уже довольно успешно проходят тестовые испытания.
Вообще люди с серповидно-клеточной анемией, как правило, имеют меньшую продолжительность жизни. Но современная медицина показывает неплохие результаты. Современные методики лечения позволяют существенно продлить жизнь таким пациентам.В 1973 году средняя продолжительность жизни людей с серповидно-клеточной анемией была 14 лет, а сегодня цифра 40-50 лет является вполне реальной. Бывает, что пациенты живут 60 лет и дольше. Постоянное лечение гидроксимочевиной может продлить жизнь.
С помощью CRISPR-Cas9 можно эффективно лечить серповидноклеточную анемию, редактируя участок, несущий мутацию, или повреждая мутантный ген. Во втором случае активируется и компенсирует симптомы заболевания другой ген — ген фетального гемоглобина.
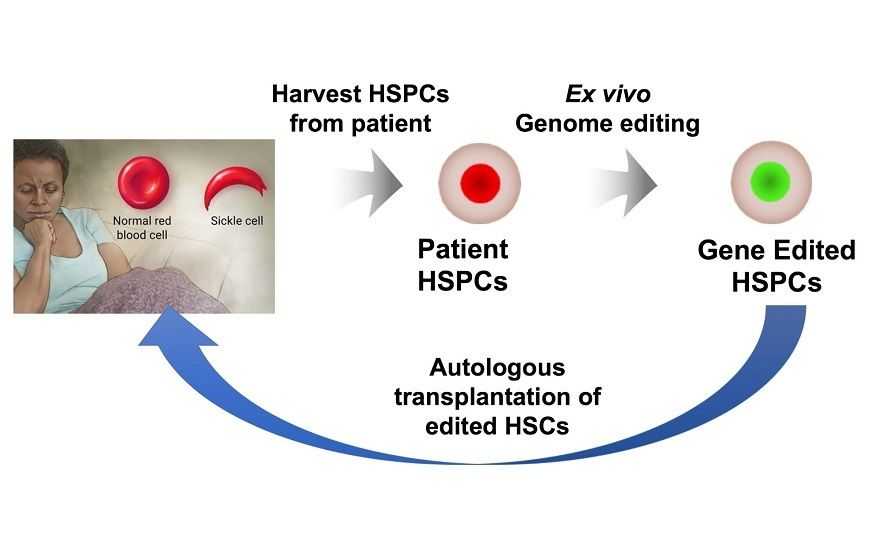
Серповидноклеточная анемия, от которой страдает около миллиона людей по всей планете, — наследственное заболевание, вызывающее сильные боли, повреждения органов и раннюю смерть. Из-за единичной мутация в бета-субъединице гемоглобина (бета-глобине) нормальные эритроциты принимают характерную форму серпа. Такие клетки повреждают стенки сосудов и забивают мелкие кровеносные сосуды, препятствуя поступлению крови к тканям.
Сейчас пациентов с этим заболеванием лечат стволовыми клетками от подходящих доноров, обычно родственников, но их удается найти менее чем для 15% больных. Однако если бы можно было модифицировать собственные стволовые клетки крови (СКК) пациента, которые дают начало всем клеткам крови, лечение стало бы доступно и другим больным.
Предполагается, что клетки будут брать из костного мозга пациента, редактировать геном, тестировать на предмет точности редактирования, а затем трансплантировать обратно. Перед этим пациенту назначат химиотерапию, чтобы снизить количество его собственных СКК и освободить место для новых, отредактированных, которые будут впоследствии производить здоровые клетки крови.
В новом исследовании Ган Бао и его команда из университета Райса в сотрудничестве с группами из Стэнфордского университета, Бэйлорского медицинского колледжа и Техасской детской больницы впервые тестировали эту процедуру на животных. СКК, полученные в лаборатории Вивьен Шиан (Бэйлорский колледж) из периферической крови или костного мозга пациентов с серповидноклеточной анемией, редактировали и пересаживали мышам с врожденно подавленной продукцией клеток иммунной системы. Оказалось, что отредактированные клетки способны жить и функционировать в организме животного не менее 4 месяцев.
Шиан и ее сотрудники изучили гемоглобин, который производили отредактированные клетки. Выяснилось, что они могут производить гемоглобин в достаточном количестве, чтобы предотвратить образование серповидных клеток, даже в условиях суровой гипоксии, которая этому способствует.
Ранние тесты с использованием Cas9-белка дикого типа, полученного от Streptococcus pyogenes, приводили к образованию стволовых клеток с большим количеством нецелевых изменений ДНК, включая крупные делеции хромосом и инверсии, которые также могут стать причиной серьезных заболеваний. Использование более точной версии Cas9, разработанной Integrated DNA Technologies, значительно уменьшило число незапланированных изменений.
Удалось исправить не все стволовые клетки, взятые у пациента с мутацией серповидноклеточной анемии, — в лучшем случае не более 40%. (Хотя и это достаточно неплохой результат.) Еще в 50% клеток, в которых ДНК, разрезанная Cas9, была восстановлена не по механизму гомологичной репарации (HDR), а по механизму негомологичного воссоединения концов (NHEJ) — то есть мутантный аллель повреждался — существенно увеличился синтез фетального гемоглобина, который кодируется другим геном, не имеющим мутации. Ген фетального гемоглобина экспрессируется только у плода и, как правило, выключается через несколько месяцев после рождения. Этот белок, как и обычный гемоглобин, подавляет эффекты серповидноклеточной анемии. Бао полагает, что если в отредактированных клетках сохранится экспрессия фетального гемоглобина, в 90% стволовых клеток пациента мутантный гемоглобин будет или починен, или заменен фетальным. «Мы надеемся, что этого будет достаточно, чтобы вылечить заболевание», — сказал Бао.
По его словам, те 10%, что продолжат производить серповидные клетки, не представляют опасности. Нормальные эритроциты живут примерно в девять раз дольше, чем серповидные, поэтому со временем большинство эритроцитов станут нормальными. В целом метод представляется более безопасным по сравнению с генной терапией на основе лентивирусных векторов, несущих ген бета-глобина дикого типа.
Однако исследователи пока не знают, надолго ли сохранится эффект от повреждения гена бета-глобина, повышающий уровень фетального гемоглобина, и не увеличит ли это риск бета-талассемии (заболевание крови, при котором снижается продукция гемоглобина). Также пока неясно, какой процент СКК надо отредактировать, чтобы эффективно вылечить серповидноклеточную анемию: оценки ученых расходятся от нескольких процентов до 5–10%. Для ответа на этот вопрос понадобятся клинические испытания, но прежде, чем можно будет начать их, необходимо обобщить данные и сделать дополнительные эксперименты, чтобы решить проблемы с безопасностью.
Источники
So Hyun Park, et al. // Highly efficient editing of the β-globin gene in patient-derived hematopoietic stem and progenitor cells to treat sickle cell disease. // Nucleic Acids Research, 2019; DOI: 10.1093/nar/gkz475
Цитаты по пресс-релизу
