Как кислород связывается гемоглобином

Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в нашей статье в связи с дыханием, поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железаПоскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. – Также рекомендуем “Всасывание железа в кишечнике. Длительность жизни эритроцитов” Оглавление темы “Эритропоэз. Белые клетки крови”: |
Источник
Гемоглобин — железосодержащий дыхательный пигмент крови позвоночных и многих беспозвоночных животных, осуществляющий перенос кислорода от органов дыхания к тканям организма. В крови позвоночных и некоторых беспозвоночных гемоглобин содержится внутри эритроцитов в растворенном состоянии.
Молекула гемоглобина позвоночных животных состоит из белка — глобина и железосодержащей группы — гема. В состав гема входят четыре протопорфириновых кольца, каждое из которых содержит атом двухвалентного железа. Молекулярный вес гемоглобина — 66 000– 68 000. Физиологическая функция гемоглобина как переносчика кислорода основана на его способности обратимо связывать кислород в зависимости от концентрации последнего в крови. В присутствии кислорода железо гема связывает одну молекулу кислорода, при этом гемоглобин превращается в оксигемоглобин. При взаимодействии гемоглобина с окисью углерода (например, при отравлении этим газом) образуется более стабильный комплекс — карбоксигемоглобин.
Продуктами распада гемоглобина являются многочисленные железопорфириновые комплексы. При этом происходит полное отделение гема от белка (хромопротеида); это отделение протекает с превращением железа в трехвалентную форму. Получаемый железопротопорфирин называется гемином, а его соединения — геминодериватами.

Рисунок 2 – Структура гема гемоглобина
Молекула гемоглобина состоит из четырех субъединиц: двух б и двух в – и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая б-цепочка содержит 141, а в-цепочка – 146 аминокислотных остатков. Таким образом, вся молекула гемоглобина включает 574 аминокислоты. Хотя аминокислотные последовательности б- и в-цепочек различны, они имеют практически одинаковые третичные пространственные структуры. Собственно говоря, приведенные выше детали структуры относятся не к гемоглобину, а к его белковой компоненте – глобину. Каждая субъединица гемоглобина содержит одну небелковую (так называемую простетическую) группу – гем. Гем представляет собой комплекс Fe(II) с протопорфирином. Структура гемма представлена на рисунке 2.
Группировка гема представляет собой сложную копланарную циклическую систему, состоящую из центрального атома, который образует координационные связи с четырьмя остатками пиррола, соединенными метановыми мостиками (= СН -). В гемоглобине железо обычно находится в состоянии окисления (2+).
Четыре субъединицы – две б и две в – соединяются в единую структуру таким образом, что б -субъединицы контактируют только с в -субъединицами и наоборот, как показано на рисунке 3.

Рисунок 3 – Схематичное изображение четвертичной структуры гемоглобина: Fe – гем гемоглобина
Как видно из рисунка 3, одна молекула гемоглобина способна переносить 4 молекулы кислорода. И связывание, и освобождение кислорода сопровождается конформационными изменениями структуры б – ив -субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи – перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна. Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток – дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гемма [Fe(II) > Fe(III); гем > гемин]. В дезоксигемоглобине глобин предохраняет железо от окисления.
Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина.
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. В этом проявляется так называемый аллостерический эффект [15].
Стоит заметить, что лазерное излучение оказывает влияние на процесс оксигенации гемоглобина. Авторы работы [16] измеряли величину насыщения артериальной крови кислородом первой фаланги пальца с помощью высокочувствительного быстродействующего пульсоксиметра. Третью фалангу пальца подвергали облучению He-Ne лазера (20 мВт).
На рисунке 4 представлено изменение величины насыщения артериальной крови кислородом при воздействии лазерного излучением.

Рисунок 4 – Влияние лазерного излучения на насыщение артериальной крови кислородом
На кривой насыщения регистрируются изменения от дыхательных циклов: 40 секунд – начало воздействия, 170 секунд – окончание. Снижение насыщения гемоглобина синхронное с воздействием, демонстрирует дополнительное освобождение кислорода в результате фотодиссоциации гемоглобина. Это не может быть связано с улучшением микроциркуляции. Все происходит слишком быстро и синхронно. Таким образом, это значит, что низкоинтенсивное лазерное облучение высвобождает кислород в месте облучения. Авторы говорят о лазерно-индуцированной оксигенации тканей. Речь идет о селективном повышении локальной концентрации кислорода в тканях. Авторы объясняют этот эффект сдвигом кривой диссоциации оксигемоглобина. И обосновывают это совпадением спектра поглощения гемоглобина и оксигемоглобина с длиной волны He-Ne лазера. То есть, по мнению авторов, оксигемоглобин является акцептором фотона.
Большой интерес для исследователей представляют особенности поведения молекул газов (лигандов) в гемовом кармане гемоглобина и миоглобина. В работе [16] рассмотрены механизмы диффузии лигандов в миоглобине, строение которого очень сходно со строением в-субъединицы молекулы гемоглобина.
Результат расчетов Д. Кейза и М. Карплюса в 1979 году оказался по тем временам несколько неожиданным. Выяснилось, что скорость диффузии лиганда в белке чрезвычайно чувствительна к виду межатомных потенциалов взаимодействия, определяющих конформационную подвижность. Конформационная подвижность обусловлена возможностью вращения молекулярных групп вокруг одинарных С-С-связей [17]. В вакууме при повороте на полный угол преодолеваются обычно три потенциальных барьера высотой ~ 2-4 ккал/моль. В плотноупакованной белковой глобуле эти вращения сильно заторможены из-за стерических препятствий, и, казалось бы, ими можно пренебречь и рассматривать только небольшие колебания атомов около локальных положений равновесия. Расчет динамики связывания лиганда с миоглобином показал, что в этом случае энергия активации диффузии составляет ~ 100т ккал/моль, что примерно в 10 раз больше экспериментальной величины, и процесс при комнатных температурах практически заморожен. Этот результат полностью опроверг представление о белковой глобуле как об апериодическом микрокристаллике. Оказалось, что включение в расчет конформационных степеней свободы совершенно принципиально для белков и снижает энергию активации диффузии лиганда до приемлемого значения ~ 10 ккал/моль. Более того, оказалось, что в структуре миоглобина можно выделить два канала для проникновения лиганда из раствора в гемовый карман. Эти каналы работают с вероятностью около 60 и 40% соответственно и по своей структуре представляют систему флуктуационно открывающихся щелей (дверей), образованных аминокислотными остатками. На рисунке 5 схематически показан путь миграции СО в молекуле гемоглобина из гемового кармана параллельно гемовой плоскости через участок альфа-спирали Е по наиболее эффективному каналу. Молекула СО сначала преодолевает участок между гистидином HisE7 и валином ValEll, а затем между HisE7 и треонином ThrElo с дальнейшим выходом в растворитель.

Рисунок 5 – Схематическое изображение одного из каналов для диффузии лиганда в миоглобине
На рисунке 5 шариком указано место расположения связанного СО в гемовом кармане. Пунктир показывает путь выхода лиганда в растворитель. Плоскость рисунка параллельна гемовой плоскости и находится над ней на расстоянии 3,2 ?. Обозначены положения аминокислотных остатков с указанием спирального участка и номера остатка в спирали (HisE7, ValE11, ThrE10); положение первого аминокислотного остатка в неспирализованном участке, соединяющем спирали С и D (CD1Phe); участок одной из пропионатных боковых цепей, присоединенных к молекуле гемма (3 prop).

Рисунок 6 – Модель диффузии в структурированной среде (белке)
При раскрытии флуктуационной щели на величину х>x0 субстрат 1 может диффундировать сквозь щель. Диффузия субстрата 2 сильно затруднена, так как требуется большая деформация щели (большая энергия активации).
Рисунок 6 иллюстрирует общую схему процесса диффузии через флуктуирующую щель, образованную элементами структуры белковой глобулы. Суть состоит в том, что для акта диффузии необходимо, чтобы просвет во флуктуирующей щели был не меньше, чем ванн-дер-ваальсов размер лиганда. Энергия активации диффузии при этом будет определяться соответствующей энергией раскрытия щели. В жидкостях на форму флуктуационной полости или дырки практически не накладывается существенных ограничений. В белковой глобуле это не так. Здесь имеется относительно жесткий упругий каркас, образованный спиральными элементами структуры. Подвижные боковые группы обеспечивают формирование дырки для диффузионного проникновения лиганда. Но форма этой дырки или щели диктуется локальной геометрией белковой структуры. В твердых телах геометрические ограничения еще более жесткие, но в этом случае в отличие от белка нет подвижных боковых групп, обеспечивающих раскрытие щелей с приемлемой энергией активации. Таким образом, белковая глобула представляет собой структурированную среду, в которой подвижная часть похожа на вязкую жидкость, но возможные формы флуктуационных полостей и щелей ограничены упругим каркасом [19]. Проникновение внутрь белковой глобулы молекул (лигандов), геометрия которых не соответствует этим формам, будет сильно затруднено, так как потребует более широкого раскрытия щелей и соответственно значительно большей энергии активации. На этом этапе с точки зрения физики и закладываются основы стереоспецифичности биохимических процессов.
Источник
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
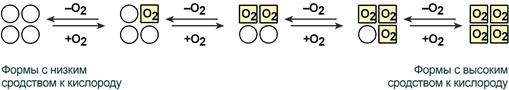
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
