Какая молекулярная масса гемоглобина
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
Источник
Гемоглобин – сложный железосодержащий белок, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. Главная функция гемоглобина состоит в переносе дыхательных газов. У человека в капиллярах лёгких в условиях избытка кислорода последний соединяется с гемоглобином. Током крови эритроциты, содержащие молекулы гемоглобина со связанным кислородом, доставляются к органам и тканям, где кислорода мало; здесь необходимый для протекания окислительных процессов кислород освобождается из связи с гемоглобином. Кроме того, гемоглобин способен связывать в тканях небольшое количество диоксида углерода (CO2) и освобождать его в лёгких. Монооксид углерода (CO) связывается с гемоглобином крови прочнее, чем кислород, образуя карбоксигемоглобин (HbCO). Некоторые процессы приводят к окислению иона железа в геме до степени окисления +3. В результате образуется форма гемоглобина, известная как метгемоглобин (HbOH) (metHb, от мета… и гемоглобин, иначе гемиглобин или ферригемоглобин). В обоих случаях блокируются процессы транспортировки кислорода. Впрочем, монооксид углерода может быть частично вытеснен из гема при повышении парциального давления кислорода в легких.
Нормальным содержанием гемоглобина в крови человека считается: у мужчин 130-170 г/л (нижний предел -120, верхний предел -180 г/л), у женщин 120-150 г/л; у детей нормальный уровень гемоглобина зависит от возраста и подвержен значительным колебаниям. Так, у детей через 1-3 дня после рождения нормальный уровень гемоглобина максимальный и составляет 145-225 г/л, а к 3-6 месяцам снижается до минимального уровня 95-135 г/л, затем с 1 года до 18 лет отмечается постепенное увеличение нормального уровня гемоглобина в крови.
Строение гемоглобина
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает особая пигментная группа, содержащая химический элемент железо – гем. Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков, обозначаемых буквами A-H (От N-конца к C-концу). Гем представляет собой комплекс протопорфирина IX, относящегося к классу порфириновых соединений, с атомом железа (II). Эта простетическая группа нековалентно связана с гидрофобной впадиной молекул гемоглобина и миоглобина.
Железо (II) характеризуется октаэдрической координацией, то есть связывается с шестью лигандами. Четыре из них представлены атомами азота порфиринового кольца, лежащими в одной плоскости. Две других координационных позиции лежат на оси, перпендикулярной плоскости порфирина. Одна из них занята азотом остатка гистидина в 93 положении полипептидной цепи (участок F). Связываемая гемоглобином молекула кислорода координируется к железу с обратной стороны и оказывается заключённой между атомом железа и азотом ещё одного остатка гистидина, располагающегося в 64 положении цепи (участок E). Всего в гемоглобине человека четыре участка связывания кислорода (по одному гему на каждую субъединицу), то есть одновременно может связываться четыре молекулы.
Гемоглобин в легких при высоком парциальном давлении кислорода соединяется с ним, образуя оксигемоглобин. При этом кислород соединяется с гемом, присоединяясь к железу гема на 6-ю координационную связь. На эту же связь присоединяется и моноксид углерода, вступая с кислородом в «конкурентную борьбу» за связь с гемоглобином, образуя карбоксигемоглобин. Связь моноксида углерода с гемоглобином более прочная, чем с кислородом. Поэтому часть гемоглобина, образующая комплекс с моноксидом углерода, не участвует в транспорте кислорода. В норме у человека образуется 1,2 % карбоксигемоглобина. Повышение его уровня характерно для гемолитических процессов, в связи с этим уровень карбоксигемоглобина является показателем гемолиза.
Физиология гемоглобина
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии – возбудители малярии, и в эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина, затрудняющие малярийным плазмодиям питание этим белком и проникновение в эритроцит. В частности, к таким имеющим эволюционно-приспособительное значение аномалия гемоглобина, приводящая к серповидно-клеточной анемии. Однако, к несчастью, эти аномалии, как и аномалии строения гемоглобина, не имеющие явно приспособительного значения, сопровождаются нарушением кислород-транспортирующей функции гемоглобина, снижением устойчивости эритроцитов к разрушению, анемией и другими негативными последствиями. Аномалии строения гемоглобина называются гемоглобинопатиями. Гемоглобин высоко токсичен при попадании значительного его количества из эритроцитов в плазму крови (что происходит при массивном внутрисосудистом гемолизе, геморрагическом шоке, гемолитических анемиях, переливании несовместимой крови и других патологических состояниях).
Токсичность гемоглобина, находящегося вне эритроцитов, в свободном состоянии в плазме крови, проявляется тканевой гипоксией – ухудшением кислородного снабжения тканей, перегрузкой организма продуктами разрушения гемоглобина – железом, билирубином, порфиринами с развитием желтухи или острой порфирии, закупоркой почечных канальцев крупными молекулами гемоглобина с развитием некроза почечных канальцев и острой почечной недостаточности. Ввиду высокой токсичности свободного гемоглобина в организме существуют специальные системы для его связывания и обезвреживания. В частности, одним из компонентов системы обезвреживания гемоглобина является особый плазменный белок гаптоглобин, специфически связывающий свободный глобин и глобин в составе гемоглобина.
Комплекс гаптоглобина и глобина (или гемоглобина) затем захватывается селезенкой и макрофагами тканевой ретикуло-эндотелиальной системы и обезвреживается. Другой частью гемоглобинообезвреживающей системы является белок гемопексин, специфически связывающий свободный гем и гем в составе гемоглобина. Комплекс гема (или гемоглобина) и гемопексина затем захватывается печенью, гем отщепляется и используется для синтеза билирубина и других желчных пигментов, или выпускается в рециркуляцию в комплексе с трансферрином для повторного использования костным мозгом в процессе эритропоэза.
Источник
274-275
Òêàíè è îðãàíû. Êðîâü
Ãåìîãëîáèí
 Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
Ãëàâíàÿ ôóíêöèÿ ýðèòðîöèòîâ
(ñì. ñ. 268)
òðàíñïîðò êèñëîðîäà îò ëåãêèõ â òêàíè è ÑÎ2 îò òêàíåé
îáðàòíî â ëåãêèå. Âûñøèå îðãàíèçìû íóæäàþòñÿ äëÿ ýòîãî â ñïåöèàëüíîé
òðàíñïîðòíîé ñèñòåìå, òàê êàê ìîëåêóëÿðíûé êèñëîðîä ïëîõî ðàñòâîðèì â âîäå:
â 1 ë ïëàçìû êðîâè ðàñòâîðèìî òîëüêî îêîëî 3,2 ìë Î2.
Ñîäåðæàùèéñÿ â ýðèòðîöèòàõ áåëîê ãåìîãëîáèí (Hb) ñïîñîáåí ñâÿçàòü
â 70 ðàç áîëüøå 220 ìë Î2/ë. Ñîäåðæàíèå Hb â êðîâè ñîñòàâëÿåò
140-180 ã/ë ó ìóæ÷èí è 120-160 ã/ë ó æåíùèí, ò. å. âäâîå âûøå ïî ñðàâíåíèþ ñ
áåëêàìè ïëàçìû (50-80 ã/ë). Ïîýòîìó Hb âíîñèò íàèáîëüøèé âêëàä â îáðàçîâàíèå
ðÍ-áóôåðíîé åìêîñòè êðîâè (ñì. ñ. 280).
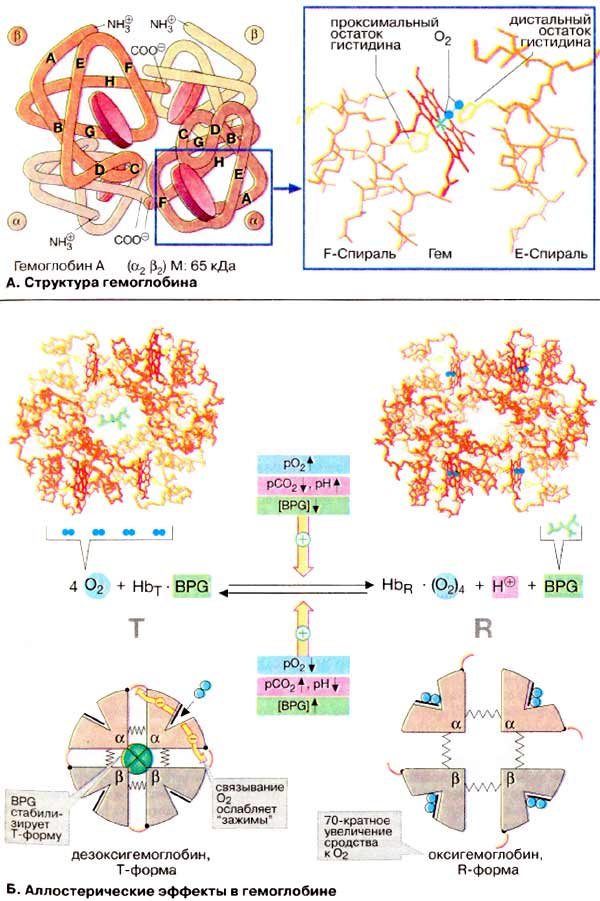
À. Ñòðóêòóðà
ãåìîãëîáèíà
Ãåìîãëîáèí âçðîñëîãî îðãàíèçìà
(HbA, ñì. íèæå) ÿâëÿåòñÿ òåòðàìåðîì, ñîñòîÿùèì èç äâóõ α- è äâóõ
β-ñóáüåäèíèö ñ ìîëåêóëÿðíûìè ìàññàìè ïðèìåðíî 16 êÄà. α- è β-öåïè îòëè÷àþòñÿ
àìèíîêèñëîòíîé ïîñëåäîâàòåëüíîñòüþ, íî èìåþò ñõîäíóþ êîíôîðìàöèþ. Ïðèìåðíî 80%
àìèíîêèñëîòíûõ îñòàòêîâ ãëîáèíà îáðàçóþò α-ñïèðàëè, îáîçíà÷åííûå áóêâàìè
À-Í (ñì. ñõåìó). Êàæäàÿ ñóáúåäèíèöà íåñåò ãðóïïó ãåìà (ôîðìóëó ñì. íà ðèñ.
197) ñ èîíîì äâóõâàëåíòíîãî æåëåçà â öåíòðå. Ïðè ñâÿçûâàíèè
O2ñ àòîìîì æåëåçà â ãåìå (îêñèãåíàöèÿ Hb) è îòùåïëåíèè
O2 (äåçîêñèãåíàöèÿ) ñòåïåíü îêèñëåíèÿ àòîìà æåëåçà íå
ìåíÿåòñÿ. Îêèñëåíèå Fe2+ äî Fe3+ â ãåìå íîñèò ñëó÷àéíûé
õàðàêòåð. Îêèñëåííàÿ ôîðìà ãåìîãëîáèíà, ìåòãåìîãëîáèí, íå ñïîñîáíà
ïåðåíîñèòü O2. Äîëÿ ìåòãåìîãëîáèíà ïîääåðæèâàåòñÿ ôåðìåíòàìè íà
íèçêîì óðîâíå è ñîñòàâëÿåò ïîýòîìó îáû÷íî òîëüêî 1-2%.
×åòûðå èç øåñòè êîîðäèíàöèîííûõ ñâÿçåé
àòîìà æåëåçà â ãåìîãëîáèíå çàíÿòû àòîìàìè àçîòà ïèððîëüíûõ êîëåö, ïÿòàÿ
îñòàòêîì ãèñòèäèíà ãëîáèíà (ïðîêñèìàëüíûé îñòàòîê ãèñòèäèíà), à øåñòàÿ
ìîëåêóëîé êèñëîðîäà â îêñèãåìîãëîáèíå è, ñîîòâåòñòâåííî, Í2Î â
äåçîêñèãåìîãëîáèíå.
Á. Àëëîñòåðè÷åñêèå ýôôåêòû â
ãåìîãëîáèíå
Àíàëîãè÷íî àñïàðòàò-êàðáàìîèëòðàíñôåðàçå
(ñì. ñ. 118) Hb ìîæåò íàõîäèòüñÿ â äâóõ ñîñòîÿíèÿõ (êîíôîðìàöèÿõ):
îáîçíà÷àåìûõ êàê Ò- è R-ôîðìû ñîîòâåòñòâåííî. Ò-Ôîðìà (íàïðÿæåííàÿ îò
àíãë. tense) îáëàäàåò ñóùåñòâåííî áîëåå íèçêèì ñðîäñòâîì ê O2
ïî ñðàâíåíèþ ñ R-ôîðìîé (íà ñõåìå ñïðàâà). Ñâÿçûâàíèå O2 ñ îäíîé èç
ñóáúåäèíèö Ò-ôîðìû ïðèâîäèò ê ëîêàëüíûì êîíôîðìàöèîííûì èçìåíåíèÿì, êîòîðûå
îñëàáëÿþò ñâÿçü ìåæäó ñóáúåäèíèöàìè. Ñ âîçðàñòàíèåì ïàðöèàëüíîãî äàâëåíèÿ
O2 óâåëè÷èâàåòñÿ äîëÿ ìîëåêóë Hb â âûñîêîàôôèííîé R-ôîðìå (îò àíãë.
relaxed). Áëàãîäàðÿ êîîïåðàòèâíûì âçàèìîäåéñòâèÿì ìåæäó ñóáúåäèíèöàìè ñ
ðîñòîì êîíöåíòðàöèè êèñëîðîäà ïîâûøàåòñÿ ñðîäñòâî Hb ê O2, â
ðåçóëüòàòå ÷åãî êðèâàÿ íàñûùåíèÿ èìååò ñèãìîèäàëüíûé âèä (ñì. ñ
276).
Íà ðàâíîâåñèå ìåæäó Ò- è R-ôîðìàìè
âëèÿþò ðàçëè÷íûå àëëîñòåðè÷åñêèå ýôôåêòîðû, ðåãóëèðóþùèå ñâÿçûâàíèå
O2 ãåìîãëîáèíîì (æåëòûå ñòðåëêè). Ê íàèáîëåå âàæíûì ýôôåêòîðàì
îòíîñÿòñÿ CO2, Í+ è 2,3-äèôîñôîãëèöåðàò [ÄÔÃ (BPG)]
(ñì. ñ. 276).
Äîïîëíèòåëüíàÿ
èíôîðìàöèÿ
Hb âçðîñëîãî îðãàíèçìà ñîñòîèò, êàê
óïîìÿíóòî âûøå, èç äâóõ α- è äâóõ β-öåïåé (α2β2). Íàðÿäó ñ
ýòîé îñíîâíîé ôîðìîé (HbA1) â êðîâè ïðèñóòñòâóþò
íåçíà÷èòåëüíûå êîëè÷åñòâà âòîðîé ôîðìû ñ áîëåå âûñîêèì ñðîäñòâîì ê
O2, ó âòîðîé β-öåïè çàìåíåíû δ-öåïÿ-ìè (HbA2,
α2δ2). Äâå äðóãèå ôîðìû Hb âñòðå÷àþòñÿ òîëüêî â
ýìáðèîíàëüíîì ïåðèîäå ðàçâèòèÿ. Â ïåðâûå òðè ìåñÿöà îáðàçóþòñÿ ýìáðèîíàëüíûå
ãåìîãëîáèíû ñîñòàâà ξ2ε2 è α2γ2.
Çàòåì âïëîòü äî ðîæäåíèÿ äîìèíèðóåò ôåòàëüíûé ãåìîãëîáèí (HbF,
α2δ2), êîòîðûé ïîñòåïåííî çàìåíÿåòñÿ íà ïåðâîì ìåñÿöå
æèçíè íà HbÀ. Ýìáðèîíàëüíûé è ôåòàëüíûé ãåìîãëîáèíû îáëàäàþò áîëåå âûñîêèì
ñðîäñòâîì ê Î2 ïî ñðàâíåíèþ ñ HbÀ, òàê êàê îíè äîëæíû ïåðåíîñèòü
êèñëîðîä èç ñèñòåìû ìàòåðèíñêîãî êðîâîîáðàùåíèÿ.
Источник
ГЕМОГЛОБИ́НЫ (от гемо… и лат. globus – шарик), железосодержащие красные пигменты крови и гемолимфы, обеспечивающие перенос молекулярного кислорода (O2) от органов дыхания к тканям и частично диоксида углерода (CO2) от тканей к органам дыхания; участвуют в поддержании pH крови. Содержатся в эритроцитах крови всех позвоночных (за исключением некоторых антарктич. рыб) и отд. беспозвоночных или растворены в гемолимфе мн. беспозвоночных животных.

Схематическое изображение пространственной структуры гемоглобина: голубым цветом обозначены β-цепи, синим – α-цепи, молекулы гема – красные диски.
Г. – сложные белки (гемопротеины). Их молекулы состоят из белкового компонента – глобина и простетич. железопорфириновой группы – гема, который способен без изменения степени окисления входящего в его состав иона Fe2+ легко присоединять и отдавать O2. Связанный с O2 Г. называется оксигемоглобином. Видовая специфичность Г. обусловлена белковым компонентом, который определяет его растворимость, сродство к O2 и молекулярную массу (у позвоночных она колеблется от 61000 до 72000, у беспозвоночных достигает 3000000). Присоединение O2 в органах дыхания (оксигенация) зависит от парциального давления (напряжения) O2 и косвенно регулируется CO2 (как правило, он облегчает отдачу O2 тканям, а его выход из крови, наоборот, способствует её насыщению O2). Связывание CO2 Г. (до 15% всего CO2 крови) происходит сразу после высвобождения O2. При взаимодействии с угарным газом (CO), сродство которого к Г. в 300 раз выше, чем у O2, образуется плохо диссоциирующий карбоксигемоглобин, не способный связывать и переносить O2; развивается кислородная недостаточность (именно этим обусловлена токсичность CO).
Молекулы Г. большинства высших позвоночных состоят из нескольких полипептидных цепей, к каждой из которых присоединён гем. Установлены первичная и пространственная структуры мн. глобинов из разл. источников. Наиболее изучен Г. человека. Его молекула образована четырьмя полипептидными цепями, упакованными в форме тетраэдра. На разных стадиях развития организма человека обнаруживаются Г., различающиеся составляющими их субъединицами. У взрослых людей до 97% приходится на долю гемоглобина A (от англ. adult – взрослый, HbA), глобин которого содержит по 2 идентичные α- и β-цепи (α2β2). Ок. 2% составляет HbA2, у которого вместо β-цепей присутствуют сходные с ними по структуре S-цепи (α2S2). Кроме того, у взрослых людей сохраняется небольшое количество (ок. 1%) Г. плода (т. н. фетальный Г., HbF), характерного для внутриутробного периода. Кроме двух α-цепей он содержит две γ-цепи (α2γ2) и обладает более высоким сродством к O2, чем HbA и HbA2. На ранних этапах эмбрионального развития присутствуют и др. Г.: типа ζ2ε2, α2ε2 и ζ2γ2. Они обеспечивают снабжение эмбриона кислородом в условиях внутриутробной жизни. HbA начинает преобладать через 2–3 мес после рождения.
У всех этих Г. α-глобиновые цепи состоят из 141 аминокислотного остатка и образуют группу α-подобных глобинов. Остальные глобиновые цепи (состоят из 146 аминокислотных остатков) по ряду свойств отличаются от α-цепей, но сходны между собой и обычно объединяются в группу β-подобных Г. Соответственно этим группам глобинов в геноме человека имеются две группы глобиновых генов, организованных в два кластера. Гены, кодирующие α-подобные цепи Г., сцеплены и расположены на хромосоме 16, а кодирующие β-подобные цепи – на хромосоме 11. Мутации в генах, кодирующих структуру полипептидных цепей Г., сопровождаются изменениями в их первичной структуре, связанными с заменами отд. аминокислотных остатков (у человека известно ок. 300 форм Г.). Б. ч. подобных замен не влияет на проявление функциональных свойств Г., но есть и такие аномальные Г., которые служат причиной заболеваний – гемоглобинопатий. Напр., замена в β-глобиновой цепи остатка глутаминовой кислоты в положении 6 на остаток валина сопровождается развитием серповидно-клеточной анемии. Разл. дефекты структуры глобиновых генов могут уменьшить продукцию Г., привести к разбалансировке синтеза α- и β-цепей и к др. заболеванию – талассемии.
Биосинтез Г. (в костном мозге, в предшественниках эритроцитов – эритробластах, нормобластах, ретикулоцитах) и формирование четвертичной структуры HbA завершается к моменту выхода зрелых эритроцитов в кровяное русло. Г. синтезируется непрерывно, что обеспечивает его постоянное обновление в организме. В 100 мл крови человека содержится 12–16 г Г. (у женщин меньше, чем у мужчин); снижение этих показателей наряду с уменьшением числа эритроцитов свидетельствует об анемии. Гем Г. после разрушения эритроцитов служит источником образования жёлчных пигментов. У позвоночных образование Г. регулируется гормоном эритропоэтином. В мышцах присутствует структурно родственный Г. белок – миоглобин, который обеспечивает клетки кислородом в условиях его дефицита. У некоторых растений обнаружены аналоги Г. (напр., легоглобин, регулирующий кислородный режим азотфиксирующих клубеньковых бактерий).
Изучение Г. внесло большой вклад в представление о структуре, функции и эволюции белков. Работы по структуре глобиновых генов человека и их экспрессии положили начало молекулярной генетике высших организмов и позволили выявить некоторые общие принципы организации и функционирования геномов эукариот. Сравнит. анализ аминокислотной последовательности глобиновых цепей у разных видов животных используется для определения степени их эволюц. родства. Открытие аномальных Г. позволило Л. Полингу привлечь внимание к изучению наследственных «молекулярных болезней».
Источник

