Какие соединения гемоглобина существуют
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |
- Биология
- Физиология человека
- Физиология человека: Учебник/В двух томах. Т. I
Основные функции эритроцитов обусловлены наличием в их составе особого белка хромопротеида — гемоглобина. Молекулярная масса гемоглобина человека равна 68 800. Гемоглобин состоит из белковой (глобин) и железосодержащей (гем) частей. На 1 молекулу глобина приходится 4 молекулы гема.
В крови здорового человека содержание гемоглобина составляет 120—165 г/л (120—150 г/л для женщин и 130—160 г/л для мужчин). У беременных содержание гемоглобина может понижаться до 110 г/л, что не является патологией.
Основное назначение гемоглобина — транспорт 02 и СОг. Кроме того, гемоглобин обладает буферными свойствами, а также способностью связывать некоторые токсичные вещества.
Гемоглобин человека и различных животных имеет разное строение. Это касается белковой части — глобина, так как гем у всех представителей животного мира имеет одну и ту же структуру. Гем состоит из молекулы порфирина, в центре которой расположен ион Fe2*, способный присоединять Ог. Структура белковой части гемоглобина человека неоднородна, благодаря чему белковая часть разделяется на ряд фракций. Большая часть гемоглобина взрослого человека (95—98%) состоит из фракции А (от лат. adultus — взрослый); от 2 до 3% всего гемоглобина приходится на фракцию А2; наконец, в эритроцитах взрослого человека находится так называемый фетальный гемоглобин (от лат. fetus — плод), или ге-х моглобин F, содержание которого в норме подвержено значительным колебаниям, хотя редко превышает 1—2%. Гемоглобины А и А2 обнаруживаются практически во всех эритроцитах, тогда как гемоглобин F присутствует в них не всегда.
Гемоглобин F содержится преимущественно у плода. К моменту рождения ребенка на его долю приходится 70—90%. Гемоглобин F имеет большее сродство к 02, чем гемоглобин А, что позволяет тканям плода не испытывать гипоксии, несмотря на относительно низкое напряжение 02 в его крови. Эта приспособительная реакция объясняется тем, что гемоглобин F труднее вступает в связь с 2,3-дифосфоглицернновой кислотой, которая уменьшает способность
гемоглобина переходить в оксигемоглобин, а следовательно, и обеспечивать легкую отдачу Ог тканям.
Гемоглобин обладает способностью образовывать соединения с Ог, СОг и СО. Гемоглобин, присоединивший Ог, носит наименование оксигемоглобина (ННЬ02); гемоглобин, отдавший Ог, называется восстановленным, или редуцированным (ННЬ). В артериальной крови преобладает содержание оксигемоглобина, от чего ее цвет приобретает алую окраску. В венозной крови до 35% всего гемоглобина приходится на ННЬ. Кроме того, часть гемоглобина через аминную группу связывается с СОг, образуя карбогемоглобин (ННЬСОг), благодаря чему переносится от 10 до 20% всего транспортируемого кровью СО2.
Гемоглобин способен образовывать довольно прочную связь с СО. Это соединение называется карбоксигемоглобином (ННЬСО). Сродство гемоглобина к СО значительно выше, чем к 02, поэтому гемоглобин, присоединивший СО, неспособен связываться с 02. Однако при вдыхании чистого О2 резко возрастает скорость распада карбоксигемоглобина, чем пользуются на практике для лечения отравлений СО.
Сильные окислители (ферроцианид, бертолетова соль, пероксид, или перекись, водорода и др.) изменяют заряд от Fe2+ до Fe3+, в результате чего возникает окисленный гемоглобин — прочное соединение гемоглобина с 02, носящее наименование метгемоглобина. При этом нарушается транспорт Ог, что приводит к тяжелейшим последствиям для человека и даже смерти.
Источник: Под ред. В. М. Покровского, Г. Ф. Коротько., «Физиология человека: Учебник/В двух томах. Т. I» 1997
А так же в разделе «Гемоглобин и его соединения »
- Эритроциты
- Цветовой показатель
- Функции эритроцитов
- Эритрон. Регуляция эритропоэза
- Лейкоциты
- Физиологические лейкоцитозы. Лейкопении
- Лейкоцитарная формула
- Характеристика отдельных видов лейкоцитов
- Регуляция лейкопоэза
- 6.2.2.S. Неспецифическая резистентность и иммунитет
- Тромбоциты
Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Otvety_FIZIOLOGIYa.docx
Скачиваний:
3300
Добавлен:
28.02.2016
Размер:
576.27 Кб
Скачать
Гемоглобин
относится к числу важнейших дыхательных
белков, принимающих участие в переносе
кислорода от легких к тканям. Он является
основным компонентом эритроцитов
крови, в каждом из них содержится
примерно 280 млн молекул гемоглобина.Гемоглобин
является сложным белком, который
относится к классу хромопротеинов и
состоит из двух компонентов:
железосодержащего
гема – 4 %;белка
глобина – 96 %.
Гем
является комплексным соединением
порфирина с железом. Это соединение
довольно неустойчивое и легко
превращается либо в гематин, либо в
гемин. Строение гема идентично для
гемоглобина всех видов животных.
Отличия связаны со свойствами белкового
компонента, который представлен двумя
парами полипептидных цепей. Различают
HbA, HbF, HbP формы гемоглобина.В
крови взрослого человека содержится
до 95–98 % гемоглобина HbA. Его молекула
включает в себя 2 α– и 2 β-полипептидные
цепи. Фетальный гемоглобин в норме
встречается только у новорожденных.
Кроме нормальных типов гемоглобина,
существуют и аномальные, которые
вырабатываются под влиянием генных
мутаций на уровне структурных и
регуляторных генов.Внутри
эритроцита молекулы гемоглобина
распространяются по-разному. Вблизи
мембраны они лежат к ней перпендикулярно,
что улучшает взаимодействие гемоглобина
с кислородом. В центре клетки они лежат
более хаотично. У мужчин в норме
содержание гемоглобина примерно
130–160 г/л, а у женщин – 120–140 г/л.Выделяют
четыре формы
гемоглобина:
Оксигемоглобин
– содержит двухвалентное железо и
способен связывать кислород. Он
переносит газ к тканям и органам.Метгемоглобин
– содержит трехвалентное железо, не
вступает в обратимую реакцию с кислородом
и обеспечивает его транспорт.Карбоксигемоглобин
– образует соединение с угарным газом.
Он обладает высоким сродством с окисью
углерода, поэтому комплекс распадается
медленно. Это обусловливает высокую
ядовитость угарного газа.Миоглобин
– по структуре близок к гемоглобину и
находится в мышцах, особенно в сердечной.
Он связывает кислород, образуя депо,
которое используется организмом при
снижении кислородной емкости крови.
За счет миоглобина происходит обеспечение
кислородом работающих мышц.
Гемоглобин
выполняет дыхательную и буферную
функции.
1 моль гемоглобина способен связать 4
моля кислорода, а 1 г – 1,345 мл газа.
Кислородная емкость крови – максимальное
количество кислорода, которое может
находиться в 100 мл крови. При выполнении
дыхательной функции молекула гемоглобина
изменяется в размерах. Соотношение
между гемоглобином и оксигемоглобином
зависит от степени парциального
давления в крови. Буферная функция
связана с регуляцией pH крови.
48. Гуморальная и нервная регуляция эритро- и лейкопоэза.
У
взрослых процесс образования эритроцитов
– эритропоэз, происходит в красном
костном мозге плоских костей. Они
образуются из ядерных стволовых клеток,
проходя стадии проэритробласта,
эритробласта, нормобласта, ретикулоцитов
II, III, IV. Этот процесс происходит в
эритробластических островках, содержащих
эритроидные клетки и макрофаги костного
мозга. Макрофаги выполняют следующие
функции:
Фагоцитируют
вышедшие из нормобластов ядра.Обеспечивают
эритробласты ферритином, содержащим
железо.Выделяют
эритропоэтины.Создают
благоприятные условия для развития
эритробластов.
Созревание
эритроцитов занимает около 5 дней. Из
костного мозга в кровь поступают
ретикулоциты, дозревающие до эритроцитов
в течение суток. По их количеству в
крови судят об интенсивности эритропоэза.
В сутки образуется 60-80 тысяч эритроцитов
на каждый микролитр крови. Т.е. ежесуточно
обновляется около 1,5% эритроцитов.Основным
гуморальным регулятором эритропоэза
является гормон эритропоэтин.
В
основном он образуется в почках.
Небольшое его количество синтезируется
макрофагами. Интенсивность синтеза
эритропоэтина зависит от содержания
кислорода в тканях почек. При их
достаточной оксигенации ген, регулирующий
синтез эритропоэтина, блокируется.
При недостатке кислорода, он активируется
ферментами. Начинается усиленный
синтез эритропоэтина. Стимулируют его
синтез в почках адреналин, норадреналин,
глюкокортикоиды, андрогены. Поэтому
количество эритроцитов в крови
возрастает в горах, при кровопотерях,
стрессе и т.д. Торможение эритропоэза
осуществляется его ингибиторами. Они
образуются при увеличении количества
эритроцитов выше нормы, повышенном
содержании кислорода в крови. Эстрогены
также тормозят эритропоэз. Поэтому в
крови женщин эритроцитов меньше, чем
у мужчин. Важное значение для эритропоэза
имеют витамины В6, В12 и фолиевая кислота.
Витамин В12 называют внешним фактором
кроветворения. Однако для его всасывания
в кишечнике необходим внутренний
фактор Кастла, вырабатываемый слизистой
желудка. При его отсутствии развивается
злокачественная анемия.Гранулоциты
и моноциты образуются из миелобластов
через стадии промиелоцита, эозинофильных,
нейтрофильных, базофильных миелоцитов
или монобластов. Из монобластов сразу
образуется моноциты, а из миелоцитовмелоцитов
метамиелоциты, затем палочкоядерные
гранулоциты и, наконец, сегментоядерные
клетки. Гранулоцитопоэз стимулируют
гранулоцитарные колониестимуцлирующие
факторы (КСФ-Г), а моноцитопоэз –
моноцитарный колониестимулирующий
фактор (КСФ-М). Угнетают гранулоцитопоэз
кейлоны, выделяющиеся зрелыми
нейтрофилами. Кейлоны тормозят синтез
ДНК в стволовых клетках белого ростка
костного мозга. Задерживают созревание
гранулоцитов и моноцитов простагландины
Е, интерфероны.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Гемоглобин – это необходимый белок для жизнедеятельности человека, он выполняет ряд функций, основной из которых является транспортировка кислорода к клеткам и тканям. Существует несколько форм гемоглобина, каждая из которых обладает своими характеристиками.
Виды по белковому содержанию
В зависимости от белкового содержания формы гемоглобина человека бывают двух видов. Это физиологические и аномальные.
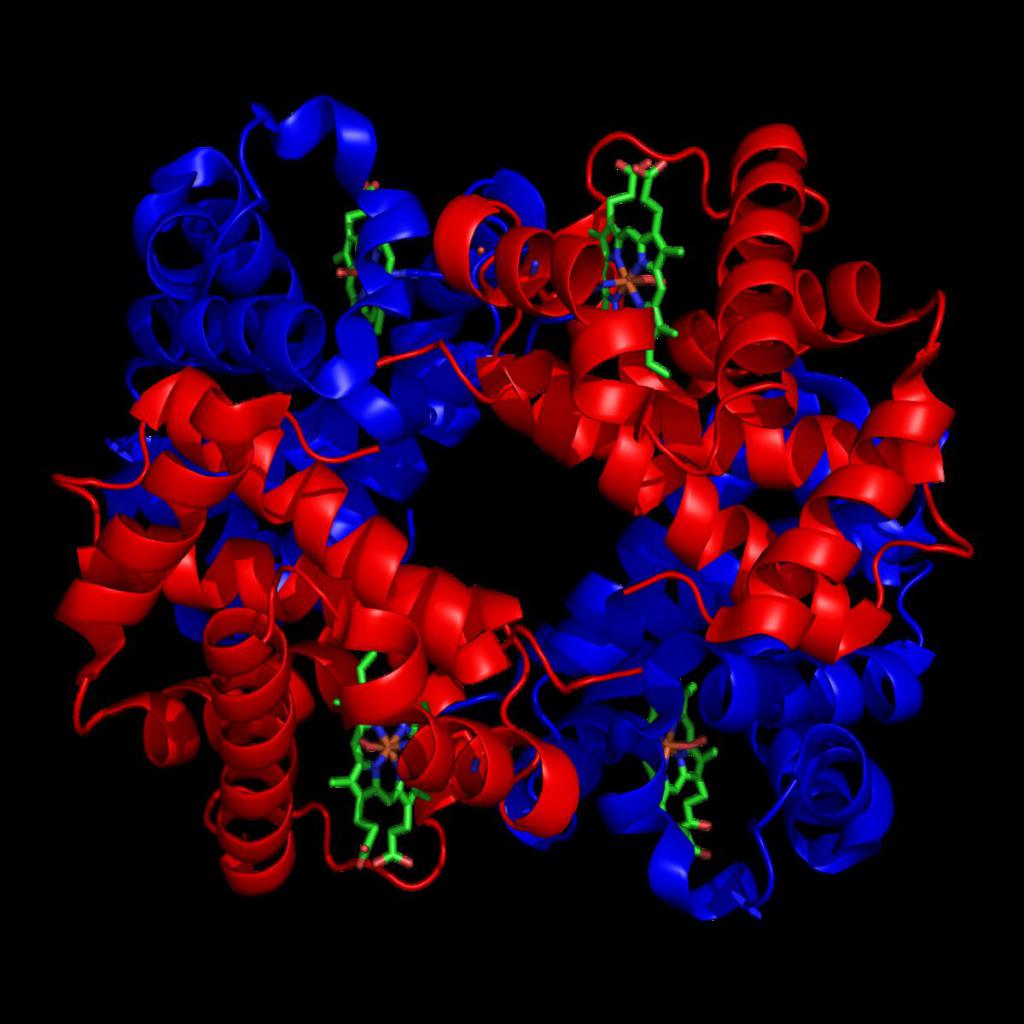
Формы гемоглобина физиологического типа возникают на определенных этапах жизнедеятельности человека. А вот патологические формируются в случае неправильной последовательности размещения ряда аминокислот в глобине.
Основные виды гемоглобина по формам
В человеческом организме могут присутствовать:
- Оксигемоглобин. Это вещество взаимодействует с молекулами кислорода. Присутствует в крови артерий, поэтому она и обладает насыщенно алым цветом.
- Карбоксигемоглобин. Эта разновидность белков взаимодействует с молекулами углекислого газа. Представленные молекулы проникают в ткани легких, где происходит выведение углекислого газа и насыщение кислорода гемоглобином. Эта разновидность белка присутствует в венозной крови, за счет чего она обладает более темным окрасом и большей густотой.
- Метгемоглобин. Это вещество, взаимодействующее с разнообразными химическими агентами. Патологическая форма гемоглобина, а увеличение количества этого вещества может указывать на отравление организма, происходит нарушение насыщаемости тканей кислородом.
- Миоглобин. Выступает в качестве полноценного аналога красных кровяных телец. Основное различие заключается только в том, что местом расположения этого белка являются сердечные мышцы. При повреждении мышц происходит попадание миоглобина в русло крови, после чего он выводится из организма благодаря функционированию почек. Но присутствует вероятность закупорки канальца почек, что может спровоцировать отмирание его тканей. В таких ситуациях не исключается возникновение почечной недостаточности и дефицита кислорода в тканях.
Другие виды гемоглобина
В различных информационных источниках выделяют еще и такие формы гемоглобина:
- Гликированный гемоглобин. Эта форма представляет собой неразделимое соединение глюкозы и белка. Такая разновидность глюкозы может перемещаться по крови на протяжении длительного времени, поэтому его применяют для выявления уровня сахара.
- Фетальный. Форма гемоглобина присутствует в крови эмбриона или новорожденного малыша в первые несколько дней жизнедеятельности. Причислен к активным видам в плане переноса кислорода, под воздействием окружающей среды подвергается быстрому разрушению.
- Сульфгемоглобин. Представленная разновидность белка возникает в крови при употреблении большого количества медикаментозных средств. Как правило, содержание этого белка не превышает 10 %.
- Дисгемоглобин. Формируется при таких связях, которые полностью лишают белок способности осуществлять его функции. Это указывает на то, что этот вид гемоглобина будет транспортироваться по крови в форме дополнительного вещества. По истечении времени он будет переработан селезенкой. При нормальном состоянии здоровья это вещество обнаруживается в организме каждого человека, но если случаи такого рода связок участятся, то органам, занимающимся транспортировкой крови по организму, придется функционировать с повышенной интенсивностью, в результате чего они быстрее истощатся и износятся.

Патологические формы гемоглобина
Выделяется отдельная группа:
- D-Пенджаб;
- S;
- C;
- H.
Свое название форма гемоглобина D-Пенджаб получила благодаря широкому распространению на территории Пенджаба, в Индии и Пакистане. Возникновение белка произошло из-за распространения малярии в различных частях Азии. Согласно статистическим данным, этот белок обнаруживается в 55 % случаев от общего числа патологических форм гемоглобина.
Гемоглобин S сформировался на территории Западной Африки в результате пяти отдельных мутаций.
Белок C входит в число наиболее распространенных структурных разновидностей гемоглобина. Люди, у которых присутствует этот белок, могут страдать от такого заболевания, как гемолитическая анемия.
Гемоглобин H провоцирует развитие такого серьезного заболевания, как альфа-талассемия.
Главные функции
Независимо от форм и производных гемоглобина, это вещество обладает следующими функциями:
- Транспортировка кислорода. Во время вдыхания человеком воздушных масс происходит проникновение молекул кислорода в ткани легких, а оттуда они перемещаются к другим тканям и клеткам. Гемоглобин соединяет молекулы кислорода и осуществляет их транспортировку. При нарушении этой функции возникает дефицит кислорода, что очень опасно для функционирования мозга.
- Транспортировка углекислого газа. В этой ситуации гемоглобин связывает уже молекулы углекислого газа, а затем осуществляет их транспортировку.
- Поддержание уровня кислотности. При скоплении углекислого газа в крови наблюдается ее закисление. Этого категорически нельзя допускать, поскольку обязано происходить постоянное выведение молекул углекислого газа.
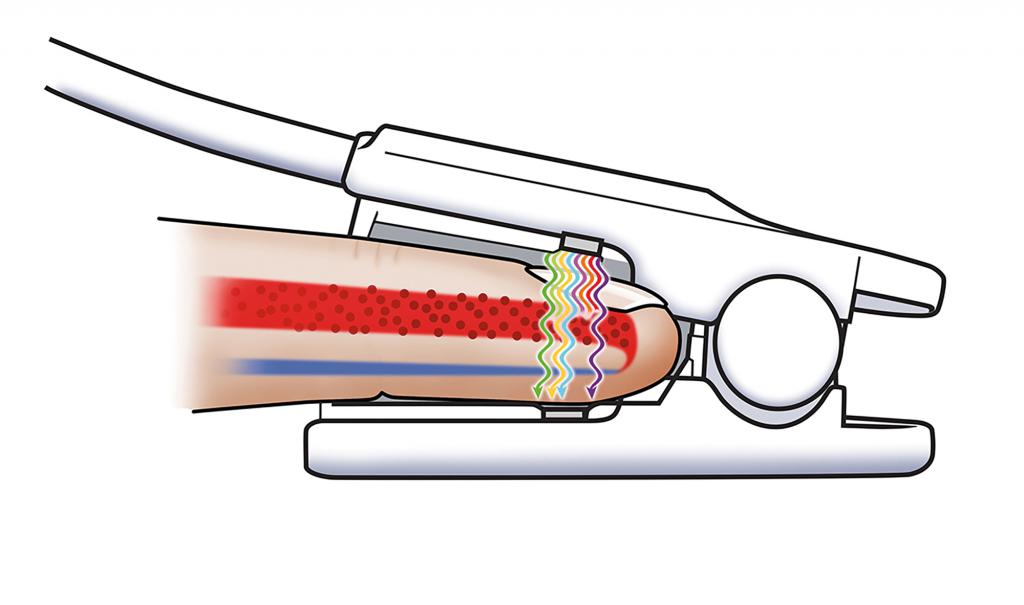
Нормальные показатели
Для того чтобы врачи могли определить нормальные формы гемоглобина в организме у человека, осуществляется сдача анализов.
Отмечают, что норма свободного гемоглобина в крови людей различных возрастов может иметь такие показатели:
- мужчины в возрасте от 18 лет – от 120 до 150 г/л;
- женщины в возрасте от 18 лет – от 110 до 130 г/л;
- новорожденные и дети в возрасте до 18 лет – 200 г/л.
Увеличение или снижение количества свободного гемоглобина в крови может спровоцировать переход белка в другую форму – патологическую.
Отмечают ряд методов стабилизации его количества, поэтому если результаты анализов указывают на превышенный или сниженный показатель, нужно незамедлительно обращаться к доктору. В связи с наличием большой численности различных форм гемоглобина, определить присутствующую в организме в состоянии только профессиональный врач в лабораторных условиях. Обнаружение ее становится возможным при биохимическом анализе крови.

