Какое количество кислорода присоединяет 1 гр гемоглобина
Гемоглобин (НЬ)– сложный олигомерный белок, состоящий из 4 протомеров двух типов (2α и 2β), включающих 574 аминокислотных остатка. Содержится в эритроцитах, на его долю приходится до 90% массы белков клетки. Гемоглобин обеспечивает перенос кислорода из легких в ткани и удаление диоксида углерода из тканей.
В мышцах внутриклеточный транспорт и кратковременное депонирование кислорода осуществляет другой белок – миоглобин (Mb). Он не является олигомером, так как состоит только из одной полипептидной цепи, конформация которой очень похожа на пространственную структуру β-цепи гемоглобина (рис. 1.20). Большую часть молекулы
Рис. 1.20. Структура миоглобина иβ-цепи гемоглобина
А– миоглобин; Б– β-цепь гемоглобина
Mb и протомеров Hb составляют 8 α-спиральных участков, образующих глобулу с гидрофобным углублением, в котором находится центр связывания с кислородом (активный центр).При этом полипептидные цепи миоглобина и протомеров гемоглобина идентичны всего на 20%.
Оба белка являются холопротеинами, простетическая группа – гем, который находится в активном центре и участвует во взаимодействии с кислородом (рис. 1.21). Гем(ферропротопорфирин) представляет собой органическое соединение с плоской молекулой, включающей 4 пиррольных цикла и ион железа Fe2+. Он является окрашенным соединением и придает красный цвет гемоглобину, эритроцитам (красные кровяные тельца) и крови.
Гем присоединяется к неполярным радикалам активного центра своими пиррольными циклами, а также к радикалу гистидина с помощью атома Fe. Пиррольные кольца гема расположены в одной плоскости, а ион Fe2+ в неоксигенированом состоянии Hb выступает над плоскостью на 0,6 А. При присоединении кислорода ион железа погружается в плоскость колец гема (рис. 1.22). В результате сдвигается и участок полипептидной цепи, нарушаются слабые связи в молекуле Hb и изменяется конформация всей глобулы. Таким образом, присоединение кислорода вызывает изменение пространственной структуры молекулы миоглобина или протомеров гемоглобина.
Рис. 1.21. Строение гемоглобина и гема
А– гемоглобин– сложный белок, олигомер, состоит из 2 α- и 2 β-субъединиц глобина, каждая имеет центр связывания, где располагается небелковая часть молекулы – гем. Он участвует в присоединении молекулы кислорода. Между протомерами образуется аллостерический центр для присоединения регуляторного лиганда гемоглобина 2,3-бисфосфоглицерата;
Б– гем– простетическая группа гемоглобина, миоглобина и других гемопротеинов. Связывается с глобином гидрофобными связями между пиррольными циклами и гидрофобными радикалами аминокислот. В центре молеку-
2+
лы расположен ион железа (Fe ), который образует 6 координационных связей: 4 – с атомами азота пиррольных колец гема, 1 – с азотом радикала гистидина цепей глобина, 1 – с молекулой кислорода. В присоединении О2к гему участвует еще один радикал гистидина цепи глобина
Рис. 1.22. Взаимодействие кислорода с гемом в миоглобине и гемоглобине
Молекула миоглобина может присоединять только 1 молекулу кислорода в свой активный центр:
Гемоглобин является олигомерным белком и имеет ряд особенностей функционирования, характерных для всех олигомерных белков. Молекула гемоглобина состоит из 4 протомеров и имеет 4 центра связывания О2 (активные центры). Гемоглобин может существовать как в свободной (дезоксигемоглобин), так и в оксигенированной форме, присоединяя до 4 молекул кислорода. Взаимодействие с кислородом 1-го протомера вызывает изменение его конформации, а также кооперативные конформационные изменения остальных протомеров (рис. 1.23, А). Сродство к кислороду возрастает, и присоединение О2 к активному центру 2-го протомера происходит легче, вызывая дальнейшую конформационную перестройку всей молекулы. В результате еще сильнее изменяется структура оставшихся протомеров и их активных центров, взаимодействие с О2 еще больше облегчается. В итоге 4-я молекула кислорода присоединяется к Hb примерно в 300 раз легче, чем 1-я (рис. 1.23, Б). Так происходит в легких при высоком парциальном давлении кислорода. В тканях, где содержание кислорода
ниже, наоборот, отщепление каждой молекулы О2 облегчает освобождение последующих.
Таким образом, взаимодействие олигомерного белка гемоглобина с лигандом (О2) в одном центре связывания приводит к изменению конформации всей молекулы и других, пространственно удаленных центров, расположенных на других субъединицах (принцип «домино»). Подобные взаимосвязанные изменения структуры белка называют кооперативными конформационными изменениями.Они характерны для всех олигомерных белков и используются для регуляции их активности.
Взаимодействие обоих белков (Mb и Hb) с кислородом зависит от его парциального давления в тканях. Эта зависимость имеет разный характер, что связано с их особенностями структуры и функционирования (рис. 1.24).
Гемоглобин имеет S-образную кривую насыщения, которая показывает, что субъединицы белка работают кооперативно, и чем больше кислорода они отдают, тем легче идет освобождение остальных молекул О2. Этот процесс зависит от изменения парциального давления кислорода в тканях.
График насыщения миоглобина кислородом имеет характер простой гиперболы, т.е. насыщение Mb кислородом происходит быстро и отражает его функцию – обратимое связывание с
Рис. 1.23. Кооперативные изменения конформации молекулы гемоглобина при взаимодействии с кислородом
А– при взаимодействии молекулы дезоксигемоглобина НЬ с О2 происходят кооперативные конформационные изменения, которые сопровождают присоединение каждой последующей молекулы кислорода; Б– в результате изменения конформации активного центра возрастает сродство НЬ к кислороду, 4-я молекула кислорода присоединяется к оксигенированному гемоглобину [НЬ(О2)3] в 300 раз легче, чем 1-я
Рис. 1.24. Кривые насыщения миоглобина и гемоглобина кислородом
кислородом, высвобождаемым гемоглобином, и освобождение в случае интенсивной физической нагрузки.
Изменение сродства гемоглобина к О2 обеспечивает быстрое насыщение крови кислородом в легких, а также освобождение и передачу его в ткани. Миоглобин обладает более высоким сродством к О2, поэтому связывает и передает в митохондрии клеток кислород, транспортируемый НЬ в мышцы.
Гемоглобин доставляет в сутки до 600 л (850 г) О2 в ткани и способствует удалению из них ~ 500 л (1000 г) СО2. Движущей силой этих потоков является градиент концентраций О2 между альвеолярным воздухом и межклеточной жидкостью. Парциальное давление О2 в альвеолярном воздухе составляет 100 мм рт.ст. Парциальное давление О2
в тканях намного ниже (~ 40 мм рт.ст.), что обусловлено поступлением и использованием кислорода митохондриями клеток, где он превращается в Н2О. Таким образом О2 поглощается клетками.
Обмен О2 и СО2 происходит в капиллярах: в легких О2 переходит из альвеолярного воздуха в эритроциты, а СО2 – в обратном направлении; в капиллярах тканей О2 из эритроцитов перемещается в клетки тканей, а СО2 – в обратном направлении (рис. 1.25).
Изменение функциональной активности белка при взаимодействии с другими лигандами вследствие конформационных изменений называется аллостерической регуляцией,а соединения-регуляторы –аллостерическими лигандами.Способность к аллостерической регуляции характерна, как правило, для олигомерных белков, т.е. для проявления аллостерического эффекта необходимо взаимодействие протомеров. При воздействии аллостерических лигандов белки меняют свою конформацию (в том числе и активного центра) и функцию.
Молекула гемоглобина способна связываться с несколькими лигандами: О2, Н+, СО2, 2,3-бис- фосфоглицератом (БФГ). Н+, СО2 и БФГ являются аллостерическими регуляторами активности гемоглобина и присоединяются к участкам (аллостерическим центрам), пространственно удаленным от активного центра.
Концентрация аллостерических лигандов снижает сродство гемоглобина к кислороду, а миоглобин и отдельные субъединицы гемоглобина нечувствительны к изменениям концентрации Н+, СО2 и БФГ, т.е. аллостерические свойства гемоглобина возникают только в результате взаимодействия субъединиц.
Рис. 1.25. Перенос кислорода и диоксида углерода гемоглобином. Эффект Бора
БФГ образуется из глюкозы в эритроцитах и является одним из регуляторов работы гемоглобина. Его молярная концентрация в крови близка к молярной концентрации НЬ. В центре молекулы гемоглобина полипептидные цепи 4 протомеров образуют полость (аллостерический центр), причем величина ее увеличивается в дезоксигемоглобине и уменьшается в оксигемоглобине. БФГ поступает в полость дезоксигемоглобина, связываясь с положительно заряженными группами на β-протомере (рис. 1.26). При этом его сродство к О2 снижается в 26 раз. В результате происходит высвобождение кислорода в капиллярах ткани при низком парциальном давлении О2.
Рис. 1.26. Связывание БФГ с дезоксигемоглобином
Центр связывания БФГ находится в положительно заряженной полости между 4 протомерами гемоглобина. Взаимодействие БФГ с центром связывания изменяет конформацию α- и β-протомеров НЬ и их активных центров. Сродство НЬ к молекулам О2 снижается и кислород высвобождается в ткани. В легких при высоком парциальном давлении О2 активные центры гемоглобина насыщаются за счет изменения конформации и БФГ вытесняется из аллостерического центра
В легких высокое парциальное давление О2, наоборот, приводит к оксигенированию НЬ и освобождению БФГ.
Содержание БФГ в крови человека соответствует содержанию гемоглобина и повышается при понижении содержания кислорода в воздухе (гипоксии) или затруднении дыхания при заболеваниях легких. Понижение его концентрации ухудшает снабжение тканей кислородом.
Это важно учитывать при переливании крови и сохранять необходимую концентрацию БФГ при консервации. Переливание донорской крови с пониженным содержанием БФГ может привести к гипоксии и гибели больных.
В регуляции работы гемоглобина основная роль принадлежит протонам Н+. • В тканиНЬ поступает преимущественно в виде НЬ(О2)4. Но при низком парциальном давлении О2 происходит отщепление части кислорода. Увеличение содержания не полностью оксигенированных форм НЬ облегчает высвобождение О2.
В мышцах образуется много СО2, который под действием карбоангидразы превращается в угольную кислоту Н2СО3, диссоциирующую на Н+ и бикарбонат-ион:
СО2 + Н2О → Н2СО3 → Н+ + НСО3-
Повышение концентрации Н+ вызывает протонирование ионогенных групп НЬ, что приводит к снижению его сродства к О2:
Н+ + НЬ О2 → Н+ НЬ + О2
Далее с дезоксигемоглобином взаимодействует
БФГ:
В легкиепоступает кровь с высоким содержанием дезоксигемоглобина, протонированного, связанного с БФГ или СО2. В такой форме гемоглобин имеет пониженное сродство к О2.
Из капилляров диффундирует СО2, освобождающийся в результате реакции:
Н+ + НСО-3 → Н2СО3 → СО2 + Н2О
Это стимулирует депротонирование гемоглобина:
Н+ НЬ → Н+ + НЬ
Высокое парциальное давление О2 приводит к оксигенированию НЬ, при этом вытесняется БФГ:
НЬ БФГ → НЬ + БФГ
Частичное оксигенирование гемоглобина повышает его сродство к кислороду, все реакции, приведенные выше, происходят в обратном порядке.
Зависимость сродства гемоглобина к кислороду от концентрации ионов водорода (Н+) получила названиеэффекта Борапо имени датского физиолога, изучавшего функционирование гемоглобина (см. рис. 1.25).
Таким образом, количество транспортируемого гемоглобином в ткани кислорода регулируется и повышается при увеличении содержания СО2 и Н+ в крови (например, при интенсивной физической работе); при сдвиге рН крови в щелочную сторону (алкалозе) доставка кислорода в ткани понижается.
Источник
Основная функция гемоглобина – транспорт кислорода, которую онвыполняет очень эффективно. Гемоглобин артериальной крови насыщен кислородом приблизительно на 96%, гемоглобин венозной крови – на 64% (White А. et al, 1981).
Уменьшение степени насыщения на 32 % соответствует количеству О2, потребляемому тканями. Принимая, что 100 мл крови содержат 15,0 г гемоглобина и что каждый грамм гемоглобина может связать 1,34 мл О2 (число Хюфнера) находим, что:
0,96 х 1,34 х 15 = 19,2 мл О2 –
транспортируется 100 мл артериальной крови (19,2 объемных %);
0,64 х 1,34 х 15 = 12,8 мл О2 –
транспортируется 100 мл венозной крови (12,8 объемных %);
19,2 – 12,8 = 6,4 мл О2 (6,4% объемных %)
или
0,32 х 1,34 х 15 = 6,4 мл О2 (6,4 % объемных %)
отдается тканям каждыми 100 мл артериальной крови, протекающими через капилляры.
Поскольку минутный объем крови (МОК) равен 5 литрам, в сутках 1440 минут, определяем, что в течение суток общий объем перекачиваемой сердцем крови составит:
5 х 1440 = 7200 литров
А так как один литр артериальной крови способен транспортировать 19,2 объемных % кислорода, из которых 6,4 объемных процента потребляются тканями, находим:
7200 х 19,2
———————– = 1382 литра – количество кислорода, транспортируемое
100 за сутки артериальной кровью
7200 х 6,4
———————– = 461 литр – количество кислорода, потребляемое тканями
100 за сутки из артериальной крови
В целом, за сутки кровь переносит от легких к тканям около 1400 л кислорода, из которых 450-600 л потребляются тканями. Причем, практически весь перенос кислорода обеспечивается гемоглобином, т.к. кислород плохо растворим в водных растворах. Ограниченная растворимость кислорода позволяет транспортировать его в растворенном состоянии в количестве, составляющем всего 0,3 мл О2 / 100 мл крови (White А. еt al, 1981) при РаО2 равном 12,7 кПа (95 мм рт ст). Это соотношение вытекает из закона Генри-Дальтона, в соответствии с которым «количество растворенного в жидкости газа пропорционально его напряжению». Важно отметить, что несмотря на малое количество растворенного кислорода, именно эта его фракция обусловливает РаО2.
Гемоглобин растворен в водном цитозоле эритроцитов в очень высокой концентрации, порядка 34%. Его синтез осуществляется в процессе созревания ретикулоцитов и перехода их в эритроциты. Гемоглобин состоит из белка – глобина и простетической группы – гема. Гем представляет собой соединение, в молекулу которого входят атом двухвалентного железа и 4 замещенных пиррольных кольца, связанных между собой метиновыми группами ( – СН = ). Скелетом молекулы гема служит порфирин. Fe2+ имеет в геме координационное число, равное 6, т.е. 6 пар электронов. Четыре из этих пар связаны с атомами азота, одна пара с белком (глобином) через гистидин. Оставшаяся пара электронов используется для образования донорско-акцепторной координационной связи (ковалентной химической связи) с кислородом (рис. 12).
Функциональные свойства гемоглобина, обусловленные его уникальной структурой, специфически соответствуют задачам обеспечения дыхательной функции. Каждая из четырех полипептидных цепей глобина содержит по одной молекуле гема. А поскольку атом железа в геме может обратимо связывать одну молекулу О2 понятно, что одна молекула полностью оксигенированного гемоглобина (НbО2) содержит четыре молекулы кислорода.Гемоглобин, отдавший кислород тканям, называется свободным (неоксигенированным) гемоглобином.
Рис. 12.Координационные связи железа в молекуле гема
(по A. Ленинджеру, 1985)
В процессе присоединения и отдачи кислорода железо в молекуле гемоглобина свою валентность не меняет, т.е. при присоединении кислорода или при его отдаче железо не окисляется и не восстанавливается. Следовательно, в этих случаях речь идет об оксигенированном (оксигемоглобин) и неоксигенированном (свободном) гемоглобине, но не об окисленном и восстановленном гемоглобине.
Окисленный гемоглобин – это метгемоглобин (MetHb), содержащий Fe3+. Он не способен присоединять кислород, однако Fe3+ в MetHb может взаимодействовать со многими анионами, например, при щелочном рН с ОН- и при кислом рН – с Cl-. В небольшом количестве, составляющем 0, 5% от всего гемоглобина, метгемоглобин образуется ежесуточно в условиях in vivo (White A. et al, 1981).
Кроме кислорода к атому железа в молекуле гемоглобина могут присоединяться и другие вещества (лиганды) : Н2О; СО; СN. Их сродство, проявляемое к атому железа, неодинаково. Оно наиболее выражено у цианидов, затем у окиси углерода, затем у кислорода и наименее выражено у воды.
Степень насыщения гемоглобина кислородом зависит от парциального давления кислорода (РО2). Это давление в легких ( 100 мм рт.столба) достаточно, чтобы практически полностью оксигенировать весь гемоглобин в эритроцитах. Уникальной особенностью связывания гемоглобином О2 является кооперативное взаимодействие между гемсвязывающими участками, получившее название гем-гем – взаимодействие. И хотя прямых физических контактов между четырьмя группами гема нет, кооперативность связывания О2 проявляется в том, что по мере протекания оксигенирования гемоглобина облегчается связывание последующих молекул кислорода. При физиологических условиях сродство к О2 у гемоглобина и у полностью оксигенированного гемоглобина отличается в 500 раз (A. White et al, 1981); это показывает, что после присоединения первых молекул О2 сродство частично насыщенного гемоглобина к кислороду увеличивается.Данное положение характеризуетсясигмовидной формой кривой диссоциации HbO2 (рис. 5).Такая формауказывает на то, что связывание О2 одной из гемовых групп гемоглобина влияет на константы диссоциации других гемовых групп этой же молекулы. Сигмовидный характер кривой диссоциации НbО2 имеет большое физиологическое значение. Как видно из рис. 5 парциальное давление О2 существенно влияет на насыщение гемоглобина в пределах от 20 до 60 мм рт. ст., когда показатель насыщения кислородом характеризуется наиболее крутым подъемом отрезка кривой. При больших значениях РО2 кривая насыщения приобретает пологий характер, увеличиваясь в диапазоне 60-90 мм рт. ст. всего на 7%.
Связывание гемоглобином кислорода зависит не только от РО2. Этот процесс тонко регулируется рядом соединений, подобно тому как это имеет место при действии на аллостерический фермент.Таким регуляторным действием обладают 2,3 – дифосфоглицерат, диоксид углерода (СО2) и ионы Н+.
Главной фракцией фосфатов в эритроцитах является 2,3 – дифосфоглицерат (ДФГ); его внутриклеточная концентрация составляет приблизительно 4-5 – ммоль, т.е. сопоставима с концентрацией гемоглобина. Дифосфоглицерат (ДФГ) связывается с тетрамерным гемоглобином при нейтральном рН, образуя комплекс с соотношением компонентов 1 : 1. Связывание с гемоглобином ДФГ обусловлено наличием в молекуле последнего отрицательно заряженных групп (рис. 13):
-О О
С
Н С О Р О-
Н С Н
О
О Р О
О-
Рис. 13. Структура молекулы ДФГ(по А. Ленинджеру, 1985).
Жирным выделены группы, взаимодействующие с β-цепями
Местом связывания служит центральная полость или канал в молекуле гемоглобина, выстланный многочисленными положительно заряженными R-группами β-цепей. В итоге образуется поперечная связь между двумя β-субъединицами. При связывании гемоглобина кислородом ДФГ вытесняется из этого канала.
Главным результатом образования комплекса ДФГ-гемоглобин является снижение сродства гемоглобина к кислороду:
НbO2 + ДФГ Нb • ДФГ + О2
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. Чем ниже это давление (при подъеме на высоту), тем выше концентрация ДФГ в эритроцитах, тем легче будет освобождаться кислород от связи с гемоглобином в тканях.
Таким образом, при фиксированной концентрации оксигенированного гемоглобина, увеличение концентрации ДФГ повышает диссоциацию НbO2. При увеличении же РО2 и росте концентрации НbО2 будет усиливаться диссоциация комплекса Нb ДФГ.
Повышенное сродство крови плода к кислороду не является следствием различий сродства фетального (НbF) и постнатального (НbA) гемоглобинов к О2, поскольку кривые диссоциации изолированных НbАО2 и НbFO2 существенно не отличаются. Этот феномен повышенного сродства к кислороду крови плода является результатом менее эффективного связывания ДФГ фетальным гемоглобином, поскольку на ДФГ – связывающем участке НbF незаряженный Sery γ 143 заменяет His β 143.
В крови, консервированной в некоторых средах (цитрат-декстрозной) концентрация ДФГ снижается (в течение 10 дней с 4,5 до 0,5 мМ). Гемоглобин такой крови приобретает очень высокое сродство к кислороду, в связи с чем увеличивается риск развития гипоксии, обусловленной снижением отдачи им кислорода. Тем более, что восстановление содержания ДФГ самими эритроцитами происходит медленно (за 24 часа – до половины нормальной концентрации). Исправление ситуации путем добавления экзогенного ДФГ не эффективно, поскольку высокий отрицательный заряд его молекулы не позволяет ей проникать через мембрану эритроцитов. В связи с этим используются вещества, добавление которых к консервированной крови обеспечивает поддержание нормальной концентрации ДФГ (Волкова Н.П., 2005).
Способность гемоглобина взаимодействовать с СО2 и ионами Н+ определяется не наличием атома Fe2+ в гемах, а другими участками его молекулы, с которыми происходит связывание этих соединений. В частности, ионы водорода присоединяются к R – группам остатков гистидина в α и β – цепях глобина :
R CH COOH (общая формула аминокислоты)
NH2
R – группа, с которой связывается
ион водорода.
Что касается диоксида углерода, то он присоединяется к концевой α-аминогруппе каждой из четырех полипептидных цепей с образованием карбаминогемоглобина:
O O
R CH C + CO2 R CH C
OH OH
NH2 NHCOO- + H+
карбаминоконцевой остаток
( карбаминогемоглобин )
Важно подчеркнуть, что процессы связывания с гемоглобином О2, Н+ – ионов и СО2 (как и ДФГ) взаимозависимы. Эту взаимозависимость иногда называют кооперативным эффектом гемоглобина, который заключается в том, что изменение концентрации одного из этих веществ влияет на связывание гемоглобина с другими. В частности,связывание с гемоглобином СО2 и ионов водорода снижает его способность связывать кислороди наоборот:связывание с гемоглобином кислорода снижает его способность связывать СО2 и ионы Н+.Поэтому в периферических тканях с относительно низким значением рН и высокой концентрацией СО2 сродство Нb к кислороду падает по мере связывания СО2 и ионов водорода. И наоборот, в легочных капиллярах выделение СО2 и сопутствующее ему повышение рН крови приводят к увеличению сродства гемоглобина к кислороду. Это влияние величины рН и концентрации СО2 на связывание и освобождение кислорода гемоглобином называется эффектом Бора(в честь датского физиолога Христиана Бора, впервые открывшего его).
В основе данного эффекта лежит изменение четвертичной структуры (т.е. упаковки субьединиц молекулы белка) гемоглобина при его оксигенации. В результате молекула оксигенированного гемоглобина приобретает несколько более компактную структуру по сравнению с неоксигенированным. Вследствие этого аминокислотные остатки в α и β – цепях, связывающие ионы водорода, перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщепление ионов водорода от протонированных групп. Иначе говоря, протонированные группы при оксигенации гемоглобина приобретают свойства более сильных кислот (как донаторов ионов водорода). Т.е. НbО2 более сильная кислота (в 70 раз – Войнов В.А., 1992), чем ННb. Можно сказать и так, что оксигенированный гемоглобин (НbO2) плохо присоединяет протоны, но зато легко их отдает. А неоксигенированный гемоглобин наоборот – плохо отдает протоны, но зато легко их присоединяет (ННb).
В легочной ткани вследствие уменьшения РСО2 и превращения гемоглобина в НbО2 освобождается также СО2, находящийся в виде карбаминогемоглобина..
Повышение или снижение сродства Hb к кислороду проявляется изменением кривой диссоциации оксигемоглобина (рис. 14).
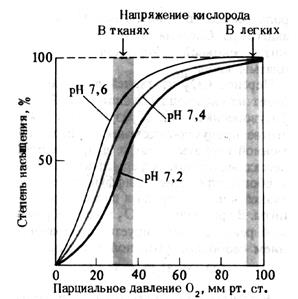
Рис. 14.Кривая диссоциации оксигемоглобина. Влияние рН(по A. Ленинджеру, 1985)
Эти изменения обозначаются понятием «сдвиг вправо» и «сдвиг влево». При сдвиге вправо, как это следует из рисунка, при снижении рН (рН = 7,2), 50% насыщение Hb кислородом, которое в норме происходит при значениях РаО2 ≈ 26,6 мм рт. ст, будет осуществляться уже при больших значениях РаО2, приближающихся к 40 мм рт. ст. Это означает, что сродство Hb к кислороду понизилось. Соответственно, при сдвиге влево (рН = 7,6) 50% насыщение Hb кислородом происходит при меньших, чем при нормальном рН значениях РаО2. Это означает, что сродство Hb к кислороду оказалось повышенным. Помимо кислотно-основного состояния на характер кривой диссоциации оксигемоглобина влияют и другие факторы (табл. 3).
Таблица 3.
Источник
