Какую структуру имеет молекула гемоглобина первичную вторичную
Строение гемоглобина влияет на его способность присоединять кислород, он содержит красный пигмент гем с железом и белок глобин. Они соединяются в субъединицы, а потом четыре из них скрепляются в один комплекс. Каждый гем с глобином могут переносить кислород и забирать из тканей углекислый газ.
Биологическая роль гемоглобина состоит в обеспечении тканевого дыхания, он также регулирует кислотность крови, связывает токсины. Нормальными формами считается оксигемоглобин (соединение с кислородом), дезоксигемоглобин (углекислота вместо кислорода). В норме в крови есть и немного окисленной формы (метгемоглобин), но при повышении ее уровня нарушается способность гемоглобина обеспечивать ткани кислородом.
Строение гемоглобина и его структура
Гемоглобин имеет в структуре две части – белок глобин и небелковый гем, строение молекулы позволяет ему присоединять и отдавать кислород, воду и углекислый газ. Гем относится к пигментам, то есть красящим веществам. Он придает крови алый цвет. Внутри гема есть железо. Гемоглобин содержит 4 гема, каждый со всех сторон обвит цепочкой аминокислот белка глобина. Эти 4 субъединицы позволяют связывать 4 молекулы кислорода из воздуха в легких.
Эритроциты, состоящие на 95% из гемоглобина, захватывают кислородные молекулы и переносят его к клеткам организма. Гемоглобин отдает кислород, а взамен забирает воду и углекислый газ, которые выделяются также через легкие. Соединение гемоглобина с кислородом называется оксигемоглобин, а с углекислотой – дезоксигемоглобин. Все они в норме есть в эритроцитах.
Если гемоглобин соединяется с угарным газом, то блокируются все 4 части молекулы, в результате она теряет способность соединяться с кислородом. Если есть отравление азотом или цианидами, то железо становится из двухвалентного (нормального) трехвалентным. Это тоже нарушает перенос кислородных молекул, образуется метгемоглобин. Подобная реакция бывает и при отравлении некоторыми медикаментами, наследственных болезнях.
Виды
Все виды гемоглобина делятся на нормальные (физиологические) и с нарушенной структурой (патологические). Для их обозначения используют латинские буквы и сокращение Hb (haemoglobinum).
Нормальные формы
В норме можно найти в крови:
- зрелый гемоглобин HbA, его у взрослого 95-98%, а у новорожденного 80%;
- фетальный гемоглобин HbF (фетус означает плод) образуется со 2 месяца беременности у плода, циркулирует до рождения, разрушается в первую неделю жизни, отличается большей способностью захватывать кислород;
- эмбриональный HbE образуется у плода до 2 месяца внутриутробного развития.
В зависимости от того, что присоединил гемоглобин, выделены формы:
- HbО2 – соединение с кислородом (оксигемоглобин);
- HbСО2 – гемоглобин с углекислым газом, он называется дезоксигемоглобин;
- HbMet – метгемоглобин с окисленным железом, его количество в норме допускается до 3%.
Патологические
Патологических гемоглобинов известно более 300 форм. Наиболее часто находят:
- HbS – гемоглобин при серповидно-клеточной анемии;
- HbCO – карбоксигемоглобин, образующийся при отравлении угарным газом;
- HbA1С – гликозилированный гемоглобин, его уровень возрастает при сахарном диабете.
Железо входит в состав гемоглобина крови?
Ионы металла железа входят в состав гемоглобина и находятся в центре каждой из 4 субъединиц. У них есть 4 связи постоянные и две свободные валентности, одна из них соединена с белком, а ко второй может прикрепиться кислород или вода, азот, углекислота.
Небелковая часть гемоглобина
Гем – это небелковая часть гемоглобина, составляющая 4% от его массы. По химическим свойствам он является пигментом красного цвета. Молекула гемоглобина содержит ионы железа двухвалентного, при окислении оно переходит в трехвалентное, а гем – в гематин, гемоглобин – в метгемоглобин. Перенос кислорода при этом нарушается.
Провоцируют потерю способности к транспортировке молекул свободные радикалы. Они образуются при обменных нарушениях, сахарном диабете, применении некоторых медикаментов (Парацетамол, сульфаниламиды), попадании нитратов из воды и продуктов. Препятствуют окислению гема витамины С, А, Е и микроэлемент селен. Они относятся к системе антиоксидантной защиты организма. Больше всего их содержится в таких продуктах:
- болгарском перце, черной смородине, цитрусовых, зеленом горошке (витамин С);
- говяжьей печени, молоке, твороге, моркови, шпинате (витамин А и провитамин каротин);
- растительном масле, зародышах пшеницы, орехах (витамин Е);
- яйцах, кукурузе, чечевице, миндале, бразильских орехах (селен).
Биологическая роль гемоглобина
Основная биологическая роль гемоглобина – это обеспечение тканевого дыхания, переноса кислорода для образования энергии и удаления углекислого газа. При этом первая его функция основная для организма, так как без гемоглобина кислородное обеспечение невозможно. Для выведения углекислоты есть и другие пути – 80% ее просто растворяется в крови и только 20% переносит гемоглобин.
Нарушение этих процессов происходит при снижении абсолютного числа гемоглобина или потери его активности. Чтобы проверить достаточность питания клеток кислородом, назначается общий анализ крови, а последствия нехватки показывает биохимия:
- напряжение кислорода;
- кислородная емкость;
- артерио-венозная разница по кислороду;
- насыщение гемоглобина кислородом.
Какое число гемов в составе молекулы гемоглобина
Каждая молекула гемоглобина содержит 4 единицы гема. Они образуются из аминокислоты глицина и органической янтарной кислоты. Первый компонент (глицин) содержатся в мясных и рыбных продуктах (говядина, курица, тунец, окунь, щука, скумбрия). Источником янтарной кислоты может стать:
- кефир, простокваша, йогурт, творог;
- крыжовник, вишня, яблоки;
- семена и масло подсолнечника;
- ржаной хлеб.
Физиологическая роль гемоглобина
Физиологическая роль гемоглобина не ограничивается только процессом тканевого дыхания, он также:
- поддерживает равновесие между кислотами и щелочами;
- выводит из клеток кислоту, предупреждая их закисление, снижающее иммунную реакцию;
- тормозит защелачивание крови в легких;
- связывает токсические соединения (нитраты, углекислый газ, сероводород, цианиды), но при их высокой концентрации возникает кислородное голодание или даже смерть.
Гемоглобин: клиническое значение
При снижении нормальных форм гемоглобина в крови ставят диагноз анемии, клиническое значение имеют показатели ниже 100 г/л при норме 120-140 г/л для женщин и 135-160 г/л для мужчин. Для детей результат рассматривают в зависимости от возраста – нижняя граница может быть от 90 единиц для грудничков и 105-115 для ребенка в 7-12 лет.
Симптоматика сниженного гемоглобина в крови включает признаки дефицита кислорода: общая и мышечная слабость, одышка, частый пульс, быстрая утомляемость, головная боль, головокружение, обморочные состояния. Анализ крови на эритроциты и гемоглобин покажет их нехватку, но не дает возможности определить причину. Поэтому требуется обследование: тесты на ферритин, трансферрин, железо и способность к его связыванию.
Реже обнаруживают гемоглобин выше нормы, это состояние называется полиглобулией и бывает при опухолевом процессе, длительной дыхательной и сердечной недостаточности. Для высоких показателей типично покраснение кожи, синева в носогубном треугольнике, головные боли, снижение зрения, тяжесть в правом подреберье.
Миоглобин и гемоглобин – отличия
Миоглобин и гемоглобин похожи, но первый находится в мышечной ткани, в отличие от гемоглобина, циркулирующего в крови. Он способен присоединять и временно удерживать кислород, перемещать его внутри клеток. При недостаточном поступлении кислорода миоглобин временно устраняет его дефицит.
Молекула гемоглобина имеет сложную структуру, состоит из нескольких белковых цепей, а миоглобин имеет только одну цепочку. В норме миоглобина в крови нет, он появляется только при разрушении мышечной ткани. Этим признаком пользуются при постановке диагноза инфаркта миокарда, так как в сердечной мышце содержится особый вид этого белкового комплекса.
Частые вопросы по структуре гемоглобина
Какая валентность железа в гемоглобине? В норме железо двухвалентное, при окислении переходит в трехвалентное, что ухудшает перенос кислорода.
В чем особенность химического строения гемоглобина? Гемоглобин имеет четвертичную структуру, то есть белковые цепи и пигмент вначале соединены в комплексы (первичная структура), а потом эти четыре субъединицы скрепляются между собой.
Что такое нативный гемоглобин и какую он имеет структуру? Нативный гемоглобин – это нормальный, не поврежденный, в его структуре есть гем и глобин, соединенные в 4 комплекса.
Сколько атомов железа в молекуле гемоглобина? В составе гемоглобина 4 гема с железом, поэтому в одной молекуле содержится 4 атома этого микроэлемента.
Строение гемоглобина позволяет ему присоединить кислород, переносить его к клеткам, забирать углекислый газ. При снижении возникает анемия с симптомами кислородного голодания.
ТЕМА БЕЛКИ
Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
Строение аминокислоты:
В левой части молекулы расположены группаH2N–, которая обладает свойствами основания; справа – группа –COOH– кислотная, характерная для всех органических кислот. Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае – пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация. Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура). Это вторичная структура белка. Но и ее часто недостаточно для приобретения характерной биологической активности.
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу. Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка. Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин. Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты. Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы:
А – первичная;
Б – вторичная;
В – третичная;
Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
1. Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
2. Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
3. Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
Опубликовано 1 год назад по предмету
Биология
от dhdbgrtkfdf
Не тот ответ, который вам нужен?
Найди нужный
Самые новые вопросы
![]()
Математика – 6 месяцев назад
Сколько здесь прямоугольников
![]()
История – 1 год назад
Какое управление было в древнейшем риме? как звали первого и последнего из царей рима?
![]()
Литература – 1 год назад
Уроки французского ответе на вопрос : расскажите о герое по следующему примерному плану: 1.почему мальчик оказался в райцентре ? 2.как он чувствовал себя на новом месте? 3.почему он не убежал в деревню? 4.какие отношения сложились у него с товарищами? 5.почему он ввязался в игру за деньги? 6.как характеризуют его отношения с учительницей ? ответе на эти вопросы пожалуйста ! сочините сочинение пожалуйста
![]()
Русский язык – 1 год назад
Помогите решить тест по русскому языку тест по русскому языку «местоимение. разряды местоимений» для 6 класса
1. укажите личное местоимение:
1) некто
2) вас
3) ни с кем
4) собой
2. укажите относительное местоимение:
1) кто-либо
2) некоторый
3) кто
4) нам
3. укажите вопросительное местоимение:
1) кем-нибудь
2) кем
3) себе
4) никакой
4. укажите определительное местоимение:
1) наш
2) который
3) некий
4) каждый
5. укажите возвратное местоимение:
1) свой
2) чей
3) сам
4) себя
6. найдите указательное местоимение:
1) твой
2) какой
3) тот
4) их
7. найдите притяжательное местоимение:
1) самый
2) моего
3) иной
4) ничей
8. укажите неопределённое местоимение:
1) весь
2) какой-нибудь
3) любой
4) этот
9. укажите вопросительное местоимение:
1) сколько
2) кое-что
3) она
4) нами
10. в каком варианте ответа выделенное слово является притяжательным местоимением?
1) увидел их
2) её нет дома
3) её тетрадь
4) их не спросили
![]()
Русский язык – 1 год назад
Переделай союзное предложение в предложение с бессоюзной связью.
1. океан с гулом ходил за стеной чёрными горами, и вьюга крепко свистала в отяжелевших снастях, а пароход весь дрожал.
2. множество темноватых тучек, с неясно обрисованными краями, расползались по бледно-голубому небу, а довольно крепкий ветер мчался сухой непрерывной струёй, не разгоняя зноя
3. поезд ушёл быстро, и его огни скоро исчезли, а через минуту уже не было слышно шума
![]()
Русский язык – 1 год назад
помогите прошу!перепиши предложения, расставляя недостающие знаки препинания. объясни, что соединяет союз и. если в предложении один союз и, то во втором выпадающем списке отметь «прочерк».пример:«я шёл пешком и,/поражённый прелестью природы/, часто останавливался».союз и соединяет однородные члены.ночь уже ложилась на горы (1) и туман сырой (2) и холодный начал бродить по ущельям.союз и соединяет:1) части сложного предложенияоднородные члены,2) однородные членычасти сложного предложения—.поэт — трубач зовущий войско в битву (1) и прежде всех идущий в битву сам (ю. янонис).союз и соединяет:1) части сложного предложенияоднородные члены,2)
![]()
Физика – 1 год назад
Вокруг прямого проводника с током (смотри рисунок) существует магнитное поле. определи направление линий этого магнитного поля в точках a и b.обрати внимание, что точки a и b находятся с разных сторон от проводника (точка a — снизу, а точка b — сверху). рисунок ниже выбери и отметь правильный ответ среди предложенных.1. в точке a — «от нас», в точке b — «к нам» 2. в точке a — «к нам», в точке b — «от нас» 3. в обеих точках «от нас»4. в обеих точках «к нам»контрольная работа по физике.прошу,не наугад важно
Информация
Посетители, находящиеся в группе Гости, не могут оставлять комментарии к данной публикации.
Гемоглобин входит в состав группы белков гемопротеины, которые сами являются подвидом хромопротеинов и подразделяются на неферментативные белки (гемоглобин, миоглобин) и ферменты (цитохромы, каталаза, пероксидаза). Небелковой частью их является гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
Строение гемоглобина
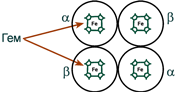
Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями, при этом они взаимодействуют не произвольно, а определенным участком – контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. – альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы “в кармане” своей цепи и формируется гемсодержащий протомер.
Нормальные формы гемоглобина
Существует несколько нормальных вариантов гемоглобина:
- HbР (primitive) – примитивный гемоглобин, содержит 2ξ- и 2ε-цепи, встречается в эмбрионе между 7-12 неделями жизни,
- HbF (foetal) – фетальный гемоглобин, содержит 2α- и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3 месяцев,
- HbA (adult) – гемоглобин взрослых, доля составляет 98%, содержит 2α- и 2β-цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80% всего гемоглобина,
- HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α- и 2δ-цепи,
- HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
- HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, при взаимодействии молекулы O2 и гемового Fe2+, но обычно ферментативных мощностей клетки хватает на его восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскорбиновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления Fe3+ в Fe2+ в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
Угарный газ является активным ингибитором гем-содержащих ферментов, в частности, цитохромоксидазы, 4-го комплекса дыхательной цепи.
Карбоксигемоглобин присутствует и в норме в количестве 0,5-1,5%, в сельской местности меньше, чем в городе. У курильщиков концентрация Hb-CO возрастает, в зависимости от количества сигарет в день, до 8-9%.
HbA1С – гликозилированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени (время жизни эритроцита, 3-4 месяца).

Ответ
Ответ дан
Мхохо
молекула гемоглобина состоит из нескольких глобул (из четырех) связанных между собой, такая структура называется четвертичной