Количество гемоглобина у крыс
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Ажикова А.К.
1
Журавлева Г.Ф.
2
1 ГБОУ ВПО «Астраханский Государственный медицинский университет»
2 ФГОУ ВПО «Астраханский государственный университет»
Впервые изучено влияние лекарственных форм различной консистенции на количественные изменения периферической крови крыс в условиях искусственной ожоговой травмы. Любой патологический процесс может отразиться на количественных и качественных особенностях состава циркулирующей крови. Этим и определяется огромное значение необходимости изучения крови в условиях гипертермии и выявления закономерностей изменений различных показателей. Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения. Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов. Полученные данные расширяют и углубляют представления о характере интоксикации организма в условиях стрессового воздействия различных факторов.
показатели периферической крови
кроветворные органы
ожоговые поражения кожи
термическое воздействие
гипертермия
1. Ажикова А. К. Использование пуповинной крови для восстановления кожи после термической травмы / А. К. Ажикова, М. В. Лазько // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2008. – №.4. – С. 53-57.
2. Грушко М. П. Состояние периферической крови у карповых рыб в нерестовый период / М. П. Грушко, Н. Н. Федорова // Актуальные проблемы современной науки. – Технические науки: Труды 2-го Международного форума. – Самара, 2006. – С.23-25.
3. Земков Г. В. Характер и степень патологических изменений в крови и внутренних органах судака / Г. В. Земков, Г. Ф. Журавлева // Материалы VIII конф. по экологической физиологии и биохимии рыб. – Петрозаводск, 1992. – С. 40.
4. Лазько А. Е. Состояние мембран эритроцитов при воздействии серосодержащего газа / А. Е. Лазько, Р. И. Асфандияров, А. А. Резаев // Актуальные вопросы медицинской фармакологии. – 1993. – С.41-47.
5. Мамонтова Е. В. Влияние ALPHA-токоферола на степень перекисного гемолиза белых мышей в норме и при иммобилизационном стрессе / Е. В. Мамонтова // Современные проблемы науки и образования. – 2006. – № 3. – С. 27-28.
6. Островский В. К. Показатели крови и лейкоцитарного индекса интоксикации в оценке тяжести и определении прогноза при воспалительных, гнойных и гнойно-деструктивных заболеваниях / В. К. Островский, А. В. Мащенко, Д. В. Янголенко, С. В. Макаров // Клин. лаб. диагностика. – 2006. – № 6. – С. 50-53.
7. Покровский А. А. Методика определения перекисного гемолиза эритроцитов / А. А. Покровский, А. А. Абразцов // Вопросы питания. – М.: Наука, 1964. – № 6. – С.44.
8. Рожкова И. С. Влияние хронической интоксикации на свободнорадикальные процессы плазмы крови крыс / И. С. Рожкова, Д. Л. Теплый, Б. В. Фельдман // Научный руководитель. – 2015. – № 3(10). – С. 1-7.
9. Теплый Д. Л. Особенности морфологической картины сыворотки крови мышей разных возрастных групп при экспериментальном стрессе / Д. Л. Теплый, Н. А. Аюпова // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2005. – №.10. – С. 47-50.
10. Ясенявская А. Л. Влияние антиоксидантов на уровень перекисного гемолиза эритроцитов старых крыс в норме и при иммобилизационном стрессе / А. Л. Ясенявская, Н. В. Кобзева // Современные наукоемкие технологии. – 2006. – № 2. – С. 69-70.
В медицинской биотехнологии постановка экспериментов при помощи моделирования патологических состояний, например ожогового повреждения кожи, имеет огромное значение для глубокого исследования крови и кроветворных органов [3]. Исходя из этого, необходимо тщательное и всестороннее изучение всех изменений, которые происходят в организме при этих воздействиях. Главным образом это относится к системам поддержания гомеостаза [2].
Ожоговые поражения кожи стали в современном мире одним из наиболее социально значимых и распространенных типов травматических повреждений у человека. Изучению вопроса реакции клеток крови на ожоги посвящен ряд исследований [1, 8].
Любое заболевание, патологический процесс, а также ряд физиологических сдвигов могут в той или иной степени отразиться на количественных и качественных особенностях состава циркулирующей крови [5]. Этим и определяется огромное значение необходимости изучения крови. Белые клетки крови, имея высокую реактивность, быстро включаются в адаптационные реакции. Они способны к неспецифическому реагированию в ответ на альтерирующие воздействия.
Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения [1].
Свой вклад в общее состояние системы организма вносят компоненты крови. Наиболее уязвимым объектом для действия продуктов свободнорадикального окисления липидов является стенка кровеносных сосудов, что обусловлено высоким уровнем кислорода в крови и низким уровнем его утилизации [9]. В условиях патологического процесса происходит поражение неклеточного компонента сосудистой стенки.
Цель исследования – изучение показателей периферической крови половозрелых крыс в норме и в условиях термического воздействия.
Материалы и методы. Объектом исследования явились 50 беспородных крыс-самцов 4-месячного возраста. Во время эксперимента регистрировали общее состояние и поведение животных. Самцы крыс были разделены на пять групп по типу воздействия:
I группа – животные, не подвергшиеся ожоговому воздействию (контрольная, 10 шт.);
II группа – животные, получившие ожоговое воздействие и не подвергшиеся терапии (10 шт.). Раны регенерировали естественным путем;
III группа – животные, получившие ожоговое воздействие и подвергшиеся терапии спреем «Д-Пантенол» (10 шт.);
IV группа – животные, получившие ожоговое воздействие и подвергшиеся терапии бальзамом мазевой формы «Спасатель» (10 шт.);
V группа – животные, получившие ожоговое воздействие и подвергшиеся терапии аппликациями настойки календулы (10 шт.).
Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов.
Уровень гемоглобина в образцах крови крыс определяли электрофотометрическим способом на гемоглобинометре APEL Hemoglobinmeter HG-202. Мазки фиксировали и окрашивали по Романовскому – Гимзе. Идентификация форменных элементов крови проводилась согласно методике Н. Т. Ивановой [4]. Количество эритроцитов крови подсчитывали по стандартной методике в камере Горяева. Количество лейкоцитов считали по мазкам крови крыс.
Для оценки уровня свободнорадикального окисления и выраженности в связи с этим липолитических процессов в крови проводили измерение перекисной резистентности эритроцитов. Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про– и антиоксидантный баланс организма [6].
Для определения перекисного гемолиза эритроцитов использовали модификацию методов определения степени перекисного гемолиза эритроцитов (ПГЭ) А. А. Покровского и А. А. Абразцова [7], которую предложили А. Е. Лазько, Р. И. Асфандияров и А. А. Резаев [4].
Результаты исследования и их обсуждение. Анализ гематологических исследований экспериментальных животных показал, что наиболее высокий уровень гемоглобина периферической крови наблюдался у крыс, лечившихся бальзамом «Спасатель» и спреем «Д-пантенол», что наглядно отображено в таблице 1. В группе крыс, лечившихся настойкой календулы, данный показатель незначительно отличался от значений у обожженных животных, не получавших лечения.
Таблица 1
Гематологические показатели через 3 суток после ожоговой травмы
Тип воздействия | Эритроциты (шт./мкл.) | Гемоглобин (г/л) |
1 -Контроль | 7,8х106 | 27,7 |
2-Ожог | 6,5 х106* | 25,6* |
3-Ожог+аппликации мазью «Д-пантенол» | 8,2х106 * | 29,2 * |
4-Ожог+аппликации бальзамом «Спасатель» | 8,3х106* | 28,3* |
5-Ожог+аппликации настойкой календулы | 6,8х106* | 25,7* |
Примечание: * – Р<0,05 по сравнению с контролем.
Изменение уровня гемоглобина в результате опыта отмечено в таблице 1. Высокий уровень гемоглобина наблюдался у крыс, лечившихся Д-пантенолом. Средний показатель уровня гемоглобина отмечен у крыс, леченных бальзамом «Спасатель». В экспериментальной группе с настойкой календулы он незначительно и статистически недостоверно отличался от значений у животных 3 группы.
Выявлено, что термический ожог кожи вызвал уменьшение количества эритроцитов периферической крови крыс. Установлено, что при лечении ожогов этот показатель несколько увеличивался, например, при терапии бальзамом «Спасатель» и спреем «Д-пантенол».
Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про- и антиоксидантный баланс организма [10].
По данным табл. 2 показано, что не леченный термический ожог межлопаточной области спины крыс способствует наиболее полному перекисному гемолизу эритроцитов крови крыс (степень гемолиза, в среднем, 7 %, p<0,001). Лечение ожогов кожи бальзамом «Спасатель» вызывает средний гемолиз (степень гемолиза в среднем 3,94 %, р<0,05), при терапии ожоговых травм межлопаточной области спины крыс спреем Д-пантенолом наблюдался частичный гемолиз (степень гемолиза в среднем и 3,62 %, Р<0,05).
Таблица 2
Перекисная резистентность эритроцитов самцов крыс (% гемолизированных эритроцитов)
Группа | Количество животных | М+m |
1 -Контроль | 10 | 3,82+0,121* |
2 -Ожог | 10 | 6,83+0,469 *** ### |
3 -Ожог+аппликации мазью «Д-пантенол» | 10 | 3,62+0,174*** ### |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,94+0,081* |
5-Ожог+аппликации настойкой календулы | 10 | 4,94+0,081* |
Примечание: в сравнении с контрольными животными: *р<0,05; **p<0,01; ***p<0,001; в сравнении с группой 2-Ожог: #р<0,05; ##p<0,01; ###p<0,001.
Анализ данных по определению перекисного гемолиза эритроцитов самцов белых крыс показал, что устойчивость эритроцитов к перекисной провокации значительно повышалась в условиях лечения ожогов кожи крыс аппликациями бальзамом «Спасатель». Воздействие аппликациями мазью «Д-пантенол» привели к повышению устойчивости эритроцитов к перекисной провокации и приблизили показатели перекисного гемолиза эритроцитов к контролю. Термический ожог без лечения резко снизил устойчивость эритроцитов к перекисной провокации. Аппликации настойкой календулы незначительно повысил устойчивость эритроцитов к гемолизу (см. табл. 2).
Установлено, что термические ожоги существенно влияют и на общее число лейкоцитов, что проявлялось выраженной лейкопенией во все сроки наблюдения. В табл. 3 представлена некоторая волнообразность лейкопении. Так, на 3-и сутки количество лейкоцитов составляло 1,8±1,4 × 109, на 7-е – 2,5±1,4 × 109, на 14-е – 0,85±1,4 × 109, на 30-е – 2,4±1,4 × 109. Учитывая, что в контрольной серии уровень лейкоцитов составлял 10,2±1,4 × 109, что соответствует и литературным данным [9], отмечено значительное снижение числа защитных клеток крови.
Таблица 3
Содержание лейкоцитов в периферической крови крыс
Экспериментальные группы | Количество животных, n | Количество лейкоцитов × 109 на 3 сутки эксперимента | Количество лейкоцитов × 109 на 7 сутки эксперимента | Количество лейкоцитов × 109 на 10 сутки эксперимента |
1-Контроль | 10 | 3,4 ± 0,1 | 3,2 ± 0,1 | 3,0 ± 0,1 |
2-Ожог | 10 | 3,8 ± 0,2 * | 3,3 ± 0,3 * | 2,9 ± 0,2 * |
3-Ожог+аппликации мазью «Д-пантенол» | 10 | 3,2 ± 0,3 * | 3,1 ± 0,3 * | 2,9 ± 0,3 * |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,1 ± 0,3* | 3,1 ± 0,3* | 3,2 ± 0,4* |
5-Ожог+аппликации настойкой календулы | 10 | 2,8 ± 0,2 * | 3,1 ± 0,3 * | 2,9 ± 0,2 * |
Примечание: * – p<0,05 – достоверность различий между группами животных по сравнению с контролем.
Наблюдалось изменение общего количества лейкоцитов после термического воздействия между экспериментальными группами и контролем (см. табл. 3). В ходе экспериментов было выявлено, что у животных, получавших терапию Д-пантенолом, происходило незначительное уменьшение общего количества лейкоцитов в сравнении с контролем. У животных, получавших лечение настойкой календулы, количество лейкоцитов достоверно уменьшилось в сравнении с контрольной группой на 22 % (р<0,05).
Изучение лейкоцитарной формулы дало не менее интересные результаты. В табл. 4 отражены результаты исследования влияния ожоговой травмы на показатели лейкоцитарной формулы периферической крови подопытных крыс. В контрольной серии в формуле преобладали лимфоциты до 55–60 %, нейтрофилы составляли 40 %. При исследовании получено, что термический ожог приводил к достоверному и выраженному увеличению процентного числа лимфоцитов и нейтрофилов. Так, на 3-и сутки лимфоциты составляли 67,4 %.
Таблица 4
Изменение показателей лейкоцитарной формулы на 3-и сутки эксперимента
Экспериментальные группы | Нейтрофилы, M±m, % | Лимфоциты, M±m, % | Эозинофилы M±m, % | Моноциты M±m, % |
1-Контроль | 40,1±3,52 | 55,6±3,18 | 2,1±0,71 | 6,2±2,00 |
2-Ожог | 27,1± 2,97* | 67,4±2,61* | 3,1± 0,80* | 2,4± 0,34* |
3-Ожог+аппликации мазью «Д-пантенол» | 37,2± 2,91# | 60,2±2,94# | 2,7± 0,49# | 5,9± 0,61# |
4-Ожог+аппликации бальзамом «Спасатель» | 41,0± 2,99# | 58,6±5,22 # | 2,9± 0,31# | 6,4± 2,32# |
5-Ожог+аппликации настойкой календулы | 41,0± 2,99 # | 64,6±5,22 # | 2,7± 0,31# | 2,9± 2,32# |
Примечание: р<0,05, * – в сравнении с контролем,
# – в сравнении с группой получивших ожог без лечения.
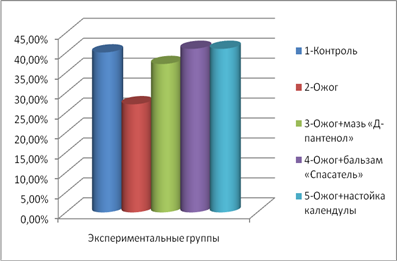
Данные эксперимента моделирования термического ожога межлопаточной области спины белых крыс свидетельствовали о достоверном колебании количества нейтрофилов у животных, получавших лечение аппликациями спрея, в сравнении с контрольной группой и группой, не получавших лечение (рис. 1).

Рис. 1. Количество нейтрофилов (M±m, %) в разных опытных группах
Отмечено, что показатели количества нейтрофилов, по сравнению с контролем, чуть ниже в группе, лечившихся спреем «Д-пантенол», и незначительно выше в группе, лечившихся бальзамом «Спасатель». На рис. 2 видно, что отсутствие терапии ожога у 2 группы крыс отразилось на большем количественном содержании лимфоцитов крови.
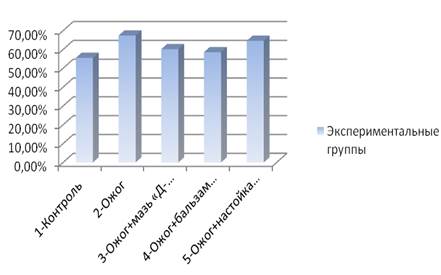
Рис. 2. Количество лимфоцитов (M±m, %) в разных опытных группах
У группы крыс, лечившихся бальзамом «Спасатель», количество лимфоцитов увеличилось. При сравнении крыс, лечившихся спреем «Д-пантенол», с контрольной группой наблюдалось снижение количества лимфоцитов, а у крыс, лечившихся настойкой календулы, количество лимфоцитов практически не отличалось от 2 группы.
При ожоге наблюдалось изменение показателей эозинофилов: увеличение этого показателя в группе 2 (ожог без терапии), в сравнении с группами крыс, получавших лечение (р<0,05). У животных, лечившихся спреем, количество эозинофилов повысилось на 22 %, по сравнению с контролем, при терапии настойкой календулы оно понизилось, что не достоверно (рис. 3).
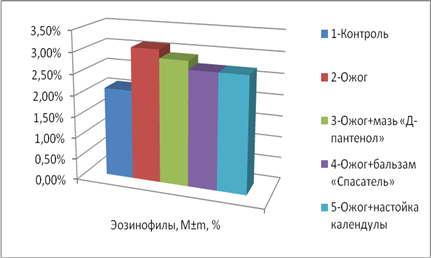
Рис. 3. Количество эозинофилов (M±m, %) в разных опытных группах
Как видно из круговой диаграммы на рис. 4, термическое воздействие без лечения приводило к снижению количества моноцитов, терапия аппликациями бальзамом «Спасатель» и спреем «Д-пантенол» стимулировало незначительное увеличение количества моноцитов в крови, по сравнению с контрольной группой подопытных животных (рис. 4).
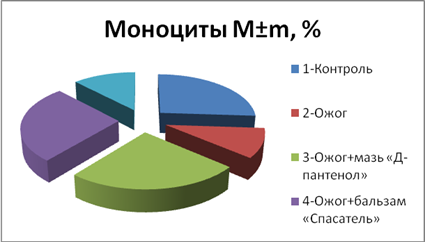
Рис. 4. Количество моноцитов (M±m, %) в разных опытных группах
Заключение
Исследование таких гематологических показателей, как количество эритроцитов, лейкоцитов, уровень гемоглобина и состояние перекисной резистентности эритроцитов, свидетельствует о значительном поражении системы крови под воздействием местного воздействия термического фактора. Наиболее результативными оказались эксперименты терапии ожогов крыс аппликациями спрея «Д-пантенол» и бальзама «Спасатель».
Таким образом, применение в эксперименте лекарственных средств для лечения ожогов (спрей Д-пантенол, бальзам «Спасатель») способствует существенному ингибированию свободнорадикального окисления, к повышению прочности клеточных мембран компонентов крови.
Библиографическая ссылка
Ажикова А.К., Журавлева Г.Ф. ИССЛЕДОВАНИЕ ГЕМАТОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ КРЫС В НОРМЕ И В УСЛОВИЯХ ТЕРМИЧЕСКОГО ВОЗДЕЙСТВИЯ // Современные проблемы науки и образования. – 2016. – № 2.;
URL: https://science-education.ru/ru/article/view?id=24350 (дата обращения: 09.09.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
ИССЛЕДОВАНИЕ ВЛИЯНИЯ АХЛОРИДНОГО ХЛЕБА «ЗАВЕТ» НА МЕДИКО-КЛИНИЧЕСКИЕ ПОКАЗАТЕЛИ КРОВИ КРЫС
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Пономарева Е.И.
1
Лукина С.И.
1
Одинцова А.В.
1
1 ФГБОУ ВПО «Воронежский государственный университет инженерных технологий»
В Воронежском государственном университете инженерных технологий на кафедре технологии хлебопекарного, кондитерского, макаронного и зерноперерабатывающего производств разработан ахлоридный хлеб для лечебного питания «Завет» из смеси муки пшеничной первого сорта и цельносмолотого зерна пшеницы с внесением муки из отрубей гречишных и сывороточного напитка «Актуаль» (ТУ 9290–294–02068108–2015). Для исследования перевариваемости, усвояемости проводили эксперимент на 2 группах половозрелых крыс, одной из которых в течение 30 дней в рацион вводили хлеб ахлоридный «Завет», второй группе (контрольной) – хлеб белый из пшеничной муки первого сорта. В результате полученных анализов дано описание биохимических, клинических показателей крови опытных животных, а также представлен протокол вскрытия животных. Таким образом, выявлено, что употребление ахлоридного хлеба «Завет» экологически безопасно и не принесет вреда здоровью животных и человека.
ахлоридный хлеб
биохимические и клинические показатели крови крыс
холестерин
глюкоза
эритроциты
перевариваемость и усвояемость изделия
1. Калиниченко Л.С. Сравнительный анализ действия про- и противовоспалительных цитокинов на содержание глюкозы в крови крыс с разной прогностической устойчивостью к эмоциональному стрессу / Л.С. Калиниченко, Е.В. Коплик, С.С. Перцов // Здоровье. Медицинская экология. Наука. – 2011. – № 1 (44). – С. 29–32.
2. Каркищенко Н.Н. Эффект пептидов животного происхождения, оцениваемый по чувствительности к гипоксии, некоторым этологическим характеристикам и показателям крови крыс /Н.Н. Каркищенко, В.Н. Каркищенко, Х.Х. Семенов и др. // Биомедицина. – 2013. – № 6. – С. 15.
3. Кондрашевская М.Е. Инфрадианные ритмы колебаний уровня глюкозы в крови у лабораторных грызунов / М.Е. Кондрашевская, М.Е. Диантропов // Фундаментальные исследования – 2013. – № 8.– С. 351–354.
4. Рыбаков Г.В. Холестерин и его влияние на организм – [Электронный ресурс]. – Режим доступа: https://cyberleninka.ru– Загл. с экрана.
5. Тюрюмин Я.Л. Физиология обмена холестерина (обзор) / Я.Л. Тюрюмин, В.А. Шантуров, Е.Э. Тюрюмина // Бюллетень ВСНЦ СО РАМН. – 2012. – № 2 (84) часть 1. – С. 153–158.
6. Guyton A.C., Hall J.E. Textbook of medical physiology (ninthedition). 1999. – 1148 р.
Главным приоритетом концепции развития хлебопекарной отрасли до 2020 г. «Хлеб – это здоровье» является содействие улучшению здоровья и качества жизни населения посредством создания условий увеличения потребления высококачественных безопасных хлебобулочных изделий функционального и специализированного назначения.
В настоящее время неправильное питание стало проблемой человечества. Быстрые перекусы, употребление некачественной пищи, фастфуда, переедание вызывают развитие болезней желудочно-кишечного тракта, способствуют засорению кровеносных сосудов и приводят к дисбалансу минеральных веществ, витаминов, пищевых волокон и других незаменимых нутриентов. В связи с этим основная задача хлебопекарной отрасли – это разработка изделий функционального назначения, в том числе для лиц, страдающих почечной недостаточностью и сердечно-сосудистыми заболеваниями.
В Воронежском государственном университете инженерных технологий на кафедре технологии хлебопекарного, кондитерского, макаронного и зерноперерабатывающего производств разработана рецептура ахлоридного хлеба «Завет» с внесением муки из цельносмолотого зерна пшеницы и отрубей гречишных.
Целью исследований было определение влияния ахлоридного хлеба на организм крыс и описание биохимических, общих клинических показателей крови и патологических изменений в органах животных.
Перевариваемость и усвояемость хлеба определяли методом in vivo на половозрелых крысах. Было сформировано 2 группы по 5 животных, одной из которых (опытной) в течение 30 дней в рацион вводили хлеб из смеси муки из цельносмолотого зерна пшеницы и пшеничной первого сорта с внесением обогатителей: муки из отрубей гречишных и сывороточного напитка «Актуаль», второй группе (контрольной) – хлеб белый из пшеничной муки первого сорта, приготовленный по рецептуре, указанной в сборнике технологических инструкций [2].
В течение всего периода опыта вели наблюдение за грызунами: учитывали поедаемость корма, прием воды, поведенческий и клинический статус, животных взвешивали перед началом эксперимента и после окончания. В период опыта не отмечено изменений поведенческого и клинического статуса.
Результаты исследований биохимических показателей крови представлены в табл. 1.
Таблица 1
Биохимические показатели крови крыс
Показатели | Норма | Значения показателей в группах | |
контроль | опыт | ||
Общий белок, г % | 9,8–10,8 | 10,05 ± 1,2 | 9,2 ± 0,5 |
Глюкоза, ммоль/л | 8,8–16,3 | 16,2 ± 1,42 | 14,8 ± 0,74 |
Мочевина, ммоль/л | 8–14 | 6,3 ± 0,32 | 5,9 ± 0,31 |
АсАТ, ммоль/л | 0,8–2,22 | 1,56 ± 1,33 | 1,52 ± 1,22 |
АлАТ, ммоль/л | 2,5–3,12 | 3,0 ± 0,28 | 2,89 ± 0,77 |
Креатинин, мкмоль/л | 68–104 | 94,2 ± 3,3 | 89,5 ± 1,9 |
Билирубин, мкмоль/л | 0–1,67 | 1,63 ± 0,15 | 1,60 ± 0,24 |
Холестерин, мкмоль/л | 2,2–2,6 | 2,4 ± 0,17 | 2,0 ± 0,06 |
Общий белок крови характеризует обменные процессы в организме и функции печени, так как большинство из них синтезируется именно в этом органе. Снижение общего белка в крови приводит к голоданию, заболеванию почек, кровопотерям, сахарному диабету, заболеваниям печени, отравлением токсическими веществами. Завышение этого показателя может стать причиной обезвоживания организма и других серьезных нарушений. Биохимический анализ крови крыс показал, что общий белок находится в пределах нормы и у животных отсутствуют вышеперечисленные патологии.
Более половины энергии, которую расходует организм, образуется за счет окисления глюкозы, основного показателя углеводного обмена. При физических нагрузках уровень глюкозы в организме несколько повышается для обеспечения мышц необходимой энергией [1].
У опытной группы крыс наблюдается понижение глюкозы на 21,5 %, что указывает на интенсивный обмен веществ за счет большего содержания в хлебе пищевых волокон и лучшего обеспечения организма энергией [3].
Важным признаком изменения деятельности почек служит мочевина крови, в основном выводимая из организма почками. Содержание мочевины в крови – это косвенный показатель функции почек, так как именно это вещество выводится с мочой в качестве конечного продукта обмена белков. Результат показывает отсутствие нарушений работы органа [6]. Согласно полученным данным содержание мочевины у крыс находится в норме, что соответствует правильной работе почек и отсутствию патологий.
Одними из ключевых ферментов азотистого обмена являются аминотрансферазы. Фермент аспартатаминотрансфераза (АсАТ) необходим для нормального функционирования мышечной ткани, а аланинаминотрансфераза (АлАТ) выделяется в крови при поражении печеночной ткани. Если присутствуют заболевания, приводящие к повреждению клеток, которые насыщены АлАТ, происходит выброс в кровь аланинаминотрасферазы, т.е. АлАТ повышен. Повышение этих показателей свидетельствует о патологических изменениях в организме и необходимости медикаментозного лечения. Ферменты АсАТ и АлАТ, содержащиеся в пробах крови животных, соответствуют норме.
Креатинин – вещество, участвующее в системном энергообмене мышечных волокон. Одним из признаков повреждения почек является увеличение количества креатинина. О накоплении в организме токсичных веществ в крови крыс можно судить по показателю мочевины и креатинина [6]. У опытной группы животных наблюдалось снижение показателя в пределах нормы по сравнению с контролем.
Билирубин – показатель, характеризующий функцию печени и степень распада эритроцитов. Это вещество является конечным продуктом распада гемоглобина. Этот процесс происходит в печени, затем с желчью продукты распада выводятся из кишечника. У испытуемых животных показатель билирубина находится в норме, что свидетельствует о правильной работе печени.
Холестерин – жироподобное вещество животного происхождения. Холестерин в крови переносится липопротеидами – сложными белками (протеинами), в состав которых входят жиры (липиды). Липротеиды высокой плотности (ЛВП) переносят около 20 % холестерина. Они состоят главным образом, из лецитина, благодаря действию которого холестерин может легко транспортироваться по крови, не засоряя артерии. Чем выше уровень ЛВП, тем лучше. Липопротеиды низкой плотности (ЛНП) переносят 65 % холестерина и способны забить артерии [4].
Известно, что холестерин является важным источником клеточных биомембран животных и человека. Выполняя структурную и функциональную роль, он влияет на клеточное деление, активность белковых рецепторов плазматических мембран и мембрансвязанных ферментов, стабильность сывороточных липопротеидов и транспортных структур желчи [5]. У опытной группы животных наблюдалось снижение холестерина в пределах нормы, что указывает на нормальную работу сердечно-сосудистой системы и отсутствие засорения артерий липопротеидами низкой плотности.
Кровь, кроме плазмы, включает форменные элементы: эритроциты (осуществляют транспорт кислорода), лейкоциты (формируют иммунную систему) и тромбоциты (обеспечивают свертываемость крови). Показатели лейкоцитов в общем анализе крови позволяют оценить состояние иммунитета и даже определить причину заболевания. Превышение уровня лейкоцитов характеризует острые бактериальные инфекции, гнойные воспаления. При падении лейкоцитов ниже уровня нормы вероятна вирусная инфекция [3]. Показатели лейкоцитов у обеих групп крыс находятся в норме. Это констатирует отсутствие инфекционных заболеваний (табл. 2).
Таблица 2
Результаты общего клинического анализа крови крыс
Показатели | Норма | Показатели в группах | |
контроль | опыт | ||
Лейкоциты (WBC) (тыс./мм3) | 2,1–19,5 | 5,39 ± 1,5 | 5,36 ± 2,0 |
Лимфоциты (LYM) (тыс./мм3) | 2–14,1 | 3,71 ± 0,5 | 3,62 ± 0,5 |
Моноциты (MON) (тыс./мм3) | 0,098 | 0,11 ± 0,02 | 0,11 ± 0,02 |
Нейтрофилы (NEU)(тыс./мм3) | 5,4 | 1,62 ± 0,07 | 1,63 ± 0,06 |
Лимфоциты (LY) (%) | 55–97 | 66,8 ± 7,9 | 67,5 ± 6,9 |
Моноциты (MO) (%) | 1–5 | 2,0 ± 1,53 | 2,1 ± 0,75 |
Нейтрофилы (NE) (%) | 2–31 | 30,1 ± 3,4 | 30,4 ± 3,4 |
Эритроциты (RBC) (млн/ мм3) | 5,3–10 | 5,8 ± 0,22 | 7,26 ± 0,24 |
Гемоглобин (HGB) (гр/ дл) | 14–18 | 11,2 ± 2,6 | 12,8 ± 2,4 |
Гематокрит (HCT) (%) | 35–52 | 48,7 ± 1,6 | 42,68 ± 1,6 |
Ср. объем эритроцитов (MCV) (фл) | 50–62 | 56 ± 1,2 | 59 ± 1,3 |
Ср. сод. гемоглобина в эрит. (MCH) (пг) | 16–23 | 17,5 ± 0,8 | 17,7 ± 0,8 |
Ср. конц. гемоглоб. в эрит. (MCHC) (г/дл) | 31–40 | 30,0 ± 1,4 | 30,1 ± 1,3 |
Тромбоциты (PLT) (тыс./мм3) | 500–1370 | 524 ± 5 | 521 ± 5 |
Лимфоциты формируют общий и местный иммунитет. При вирусных инфекциях их содержание возрастает. Моноциты утилизируют бактерии, отмирающие клетки, другие посторонние вещества. Увеличение их количества отмечается при затяжных инфекциях. В отношении бактерий наиболее активны нейтрофилы, поэтому при воспалениях бактериального характера их процентное содержание в крови возрастает [3]. Количество лимфоцитов, моноцитов и нейтрофилов в крови опытной группы крыс снижено, следовательно, болезнетворных бактерий в крови животных не обнаружено.
Главная функция эритроцитов – основного компонента крови – перенос кислорода. При избыточных нагрузках количество эритроцитов может сокращаться из-за истощения ресурсов организма, поэтому по данному показателю оценивают выносливость. Гемоглобин – железосодержащий пигмент крови, выполняющий функцию переноса кислорода из органов дыхания к тканям, играет важную роль в переносе диоксида углерода от тканей в органы дыхания. Гематологическими исследованиями определено, что количество эритроцитов и гемоглобина в крови опытных животных соответствует нормальным значениям [1]. Однако значение этого показателя у контрольной группы крыс было выше на 1,46 млн/мм3.
Гематокрит – соотношение объемов эритроцитов и плазмы – характеризует степень недостатка или избытка красных кровяных телец в крови. При повышении выносливости организма возрастает объем циркулирующей крови за счет увеличения объема плазмы, что приводит к снижению гематокрита [1]. Анализ полученных результатов показал, что содержание данного показателя находится в пределах нормы. Однако по сравнению с контрольной в опытной группе наблюдалось снижение гематокрита на 6,02 %.
Средний объем эритроцитов позволяет более точно определить размер красных кровяных клеток крови и охарактеризовать анемию. По результатам общего клинического анализа выявлено, что содержание этого показателя в контрольной группе – 56 фл, в опытной – 59 фл. Оба значения соответствуют норме.
Количество белка в одном эритроците нормируется в анализе крови и имеет такую графу «среднее содержание гемоглобина в эритроците». Полученные в ходе эксперимента значения соответствуют стандартным нормам.
Средняя концентрация гемоглобина в эритроците (МСНС) не зависит от объема клетки и является чувствительным показателем нарушений образования гемоглобина. При возникновении заболеваний, которые сопровождаются нарушением синтеза гемоглобина, МСНС понижается в последнюю очередь.
Тромбоциты обеспечивают свертываемость крови. Общий анализ позволяет выявить снижение количества тромбоцитов и предотвратить кровотечение при их резком уменьшении [3]. У опытных групп крыс выявлено незначительное снижение числа тромбоцитов.
По данным протокола вскрытия животных не обнаружено патологических изменений органов и тканей. Результаты приведены в табл. 3.
Таблица 3
Результаты протокола вскрытия крыс
Исследуемые органы и ткани | Описание состояние органа и ткани контрольной и опытной группы животных |
Ротовая полость, глотка, пищевод | Без содержимого, проходимость сохранена, слизистая оболочка без видимых патологоанатомических изменений, бледно-розового цвета |
Желудок, кишечник | Слизистая оболочка серо-белого цвета. Поджелудочная железа светло-розового цвета, не увеличена |
Селезенка | Не увеличена, темно-вишневого цвета, на разрезе мелкозернистая, соскоб умеренный |
Печень | Не увеличена, красно-коричневого цвета, на разрезе структура выражена |
Почки, мочеточники, мочевой пузырь | Не увеличены, серо-коричневого цвета, плотной консистенции, граница между корковым и мозговым слоями выражена, капсула снимается с трудом |
Половые органы | Без видимых патологоанатомических изменений |
Грудная полость | Положение анатомических органов правильное. Костальная плерва бледно-розового цвета, гладкая, блестящая, умеренно влажная |
Легкие | Светло-розового цвета, не спавшиеся, легочная ткань эластичная, умеренно влажная.Легочная плевра бледно-розового цвета, гладкая, блестящая, умеренно влажная |
Кровь | Темно-красного цвета, хорошо сворачивается |
Сердце | Не увеличено, форма не изменена, структ |
