Количество кислорода присоединяемое гемоглобином
Гемоглобин. Роль гемоглобина в транспорте кислородаОбычно из легких в ткани переносятся эритроцитами в химической связи с гемоглобином около 97% кислорода. Оставшиеся 3% кислорода транспортируются в физической растворенной форме плазмой крови. Таким образом, в нормальных условиях почти весь кислород переносится в ткани, будучи связанным с гемоглобином. Химический состав гемоглобина представлен в наших остальных статьях, где говорилось, что молекула кислорода легко и обратимо связывается с гемом гемоглобина. При высоком Ро2, как это бывает в легочных капиллярах, кислород связывается с гемоглобином, а при низком Р02, как в капиллярах тканей, кислород освобождается от связи с гемоглобином. Такой механизм обеспечивает почти весь транспорт кислорода из легких в ткани. Кривая диссоциации оксигемоглобина. На рисунке приведена кривая диссоциации оксигемоглобина, демонстрирующая прогрессивный прирост процентной доли оксигемоглобина (процента насыщения гемоглобина кислородом) при увеличении Ро2 в крови. В крови, покидающей легкие и входящей в системные артерии, напряжение О2 обычно составляет примерно 95 мм рт. ст., и на кривой диссоциации видно, что насыщение системной артериальной крови кислородом составляет 97%. Максимальное количество кислорода, которое может находиться в связи с гемоглобином крови. В 100 мл крови здорового человека содержится около 15 г гемоглобина, и каждый грамм гемоглобина может связать максимально 1,34 мл кислорода (химически чистый гемоглобин может связать 1,39 мл кислорода, но примеси типа метгемоглобина снижают это количество). Итак, 15×1,34 = 20,1, значит, в среднем содержащееся в 100 мл количество гемоглобина при 100% насыщении может связать около 20 мл кислорода. Обычно это обозначают как 20 об% (объемных процентов).
Кривая диссоциации оксигемоглобина может строиться не от процентного насыщения гемоглобина кислородом, а от количества содержания объемных процентов кислорода. В обычных условиях в системной артериальной крови, насыщенной кислородом на 97%, общее количество связанного с гемоглобином кислорода составляет около 19,4 мл на 100 мл крови. При прохождении через капилляры ткани этот объем снижается до 14,4 мл (Р02 — 40 мм рт. ст., насыщение гемоглобина — 75%). Итак, в нормальных условиях каждые 100 мл крови доставляют от легких к тканям около 5 мл кислорода. При тяжелой физической работе мышечные клетки потребляют кислород с повышенной скоростью, что может привести к падению Р02 в интерстициальной жидкости мышцы от нормального уровня 40 мм рт. ст. до 15 мм рт. ст. При таком низком парциальном давлении в каждых 100 мл крови остается только 4,4 мл связанного с гемоглобином кислорода. В этом случае каждые 100 мл протекающей крови отдают тканям 19,4 – 4,4, или 15 мл кислорода, т.е. каждый объем крови отдает тканям в 3 раза больше кислорода, чем в покое. Вспомните, что у хорошо тренированных бегунов-марафонцев сердечный выброс может увеличиться в 6-7 раз, чем при покое. Если умножить это увеличение сердечного выброса (6-7 раз) на увеличение высвобождения кислорода в тканях каждым объемом крови (3 раза), получается, что к тканям было доставлено в 20 раз больше кислорода, чем в покое. Далее в этой главе Вы узнаете о существовании других факторов, улучшающих доставку кислорода в ткани во время физической нагрузки, поэтому даже при очень напряженной физической работе наблюдается только очень небольшое снижение Ро2 в мышечной ткани. – Также рекомендуем “Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях” Оглавление темы “Кислород и его доставка в организме”: |
14.13.1. Транспорт кислорода
Кислород переносят молекулы гемоглобина, содержащиеся в эритроцитах. Гемоглобин представляет собой тетрамерный белок с мол. массой 68000. В его состав в качестве простетических групп входят четыре молекулы гема, которые присоединены к четырем полипептидным цепям глобина и придают крови характерный красный цвет. Каждый гем содержит один атом двухвалентного железа, непрочно связывающего одну молекулу кислорода (рис. 14.62):
Нb + 4O2 ↔ НbO8.

Рис. 14.62. Строение молекулы гема
Присоединение кислорода к гемоглобину с образованием оксигемоглобина происходит при высоком парциальном давлении кислорода-таком, как в капиллярах легочных альвеол. При низком парциальном давлении кислорода (как в капиллярах метаболически активных тканей) связь между кислородом и гемоглобином становится непрочной, кислород освобождается и диффундирует в окружающие клетки.
Количество кислорода, которое может связаться с гемоглобином, зависит от напряжения кислорода в среде. Последнее выражают как парциальное давление кислорода в атмосфере, находящейся в равновесии с данной средой. Парциальное давление до сих пор выражают в миллиметрах ртутного столба. Например, атмосферное давление на уровне моря составляет 760 мм рт. ст. Кислород составляет около 1/5 атмосферного воздуха; следовательно, его парциальное давление на уровне моря равно примерно 1/5⋅760 = 152 мм рт. ст.
Определяя процент насыщения крови кислородом при различном парциальном давлении O2, получают S-образную кривую, называемую кривой диссоциации оксигемоглобина (рис. 14.63).

Рис. 14.63. Этот график поясняет термины, принятые для описания кривых диссоциации пигментов, переносящих кислород. Напряжение насыщения – это то напряжение кислорода, при котором насыщено кислородом 95% пигмента, а напряжение полунасыщения – то, при котором насыщено кислородом 50% пигмента. (Из Florey, An introduction to general and comparative physiology, 1966, W. B. Saunders and Co.)
Анализ этой кривой показывает, что в физиологическом плане гемоглобин можно считать полностью насыщенным кислородом при таком напряжении О2, при котором фактически насыщается 95% гемоглобина. В примере, приведенном на рис. 14.63, такое напряжение составляет около 73 мм рт. ст. При более высоком парциальном давлении О2 может происходить дальнейшее его поглощение, но 100%-ное насыщение гемоглобина достигается редко. При парциальном давлении кислорода около 30 мм рт. ст. только 50% гемоглобина находится в форме оксигемоглобина, а при нулевом парциальном давлении О2 молекулы гемоглобина вообще не связывают кислород. В области крутого наклона кривой уже при небольшом снижении парциального давления О2 процент насыщения гемоглобина значительно уменьшается. Кислород, освобождаемый пигментом, становится доступным для тканей.
Почему же кривая насыщения имеет S-образную форму? Такая форма кривой объясняется аллостерическим характером взаимодействия гемоглобина с кислородом (разд. 6.6). Когда молекула О2 связывается с атомом двухвалентного железа одного из гемов, конфигурация этого гема слегка изменяется. Это изменение отражается на конфигурации всей молекулы гемоглобина, которая определенным образом меняется. По мере присоединения кислорода к второй и третьей группам гема происходит дальнейшее изменение конфигурации гемоглобина, и в результате каждая последующая молекула О2 присоединяется легче, чем предыдущая (явление кооперативности), так что последний гем связывает кислород в несколько сотен раз легче, чем первый.
Обратный процесс происходит тогда, когда оксигемоглобин оказывается в области низкого парциального давления О2, как это бывает в активно дышащих тканях. Первую молекулу кислорода оксигемоглобин отдает тканям очень легко, но вторая, третья и четвертая молекулы отделяются значительно труднее и только при очень сильном снижении парциального давления O2. При повышении парциального давления СО2 кривая диссоциации оксигемоглобина сдвигается вправо, и это явление называют эффектом Бора (рис. 14.64).

Рис. 14.64. Кривые диссоциации оксигемоглобина при различном парциальном давлении СО2, иллюстрирующие эффект Бора. (Из Garth Chapman, The body fluids and their function, Studies in Biology, № 8, 1967, Arnold.)
14.37. Каково физиологическое значение эффекта Бора?
14.38. Рассмотрите рис. 14.65. Кривая диссоциации оксигемоглобина у плода сдвинута влево по сравнению с кривой для матери. Чем объясняется такое смещение?
14.39. Кривая диссоциации оксигемоглобина у южноамериканских лам, живущих в Андах на высоте около 5000 м над уровнем моря, расположена левее, чем у большинства других млекопитающих (рис. 14.66). Чем это можно объяснить?

Рис. 14.65. Кривые диссоциации оксигемоглобина в крови плода и матери у овцы

Рис. 14.66. Сравнение кривых диссоциации оксигемоглобина у ламы и других млекопитающих
Собираетесь получить наибольшее многообразие в сексе? Всегда очаровательные проститутки имеют очень большой спектр услуг интимного характера, которыми вы при влечении можете попользоваться в абсолютно любое время дня и ночи.
Связывание гемоглобина с кислородом. Обмен железаНаиболее важным свойством гемоглобиновой молекулы является ее способность свободно и обратимо связываться с кислородом. Эта способность детально изложена в нашей статье в связи с дыханием, поскольку главной функцией гемоглобина в организме является соединение его с кислородом в легких и затем освобождение этого кислорода в тканевых капиллярах, где парциальное давление кислорода гораздо ниже, чем в легких. Кислород не соединяется с двумя положительными связями железа гемоглобиновой молекулы. Вместо этого он связывается с так называемыми координационными связями атома железа. Это чрезвычайно свободная связь, поэтому соединение легко обратимо. Более того, кислород не переходит в ионную форму и переносится в виде молекулярного кислорода (составленного из двух атомов кислорода) к тканям, где легко освобождается в тканевые жидкости в форме молекулярного кислорода, а не иона кислорода. Обмен железаПоскольку железо необходимо для формирования не только гемоглобина, но и других жизненно важных элементов организма (например, миоглобина, цитохромов, цитохромоксидазы, пероксидазы, катализы), важно понять способы утилизации железа в организме. Общее количество железа в теле человека в среднем составляет 4-5 г, причем около 65% этого количества входит в состав гемоглобина. Примерно 4% железа входит в состав миоглобина, 1% находится в составе различных гем-соединений, способствующих внутриклеточному окислению, 0,1% связан с белком трансферрином в плазме крови и 15-30% накапливаются для последующего использования в основном в ретикулоэндотелиальной системе и клетках паренхимы печени главным образом в форме ферритина. Транспорт, накопление и метаболизм железа в организме схематически представлены на рисунке. После всасывания из тонкого кишечника железо немедленно связывается в плазме крови с бета-глобулином (апотрансферрином), формируя трансферрин, который затем транспортируется в плазме. Железо в трансферрине связано свободно и, следовательно, может высвобождаться в любую тканевую клетку в любой точке тела. Избыток железа в крови откладывается в основном в гепатоцитах и в меньшей степени — в ретикулоэндотелиальных клетках костного мозга. В цитоплазме клеток железо связывается главным образом с белком апоферритином, формируя ферритин. Молекулярная масса апоферритина — около 460000, и с этой большой молекулой может соединяться в кластеры радикалов железа разное количество железа; следовательно, ферритин может содержать как большое, так и небольшое количество железа. Железо, которое накапливается в виде ферритина, называют резервным железом. Меньшая часть этого резерва хранится в совершенно нерастворимой форме, называемой гемосидерином. Он в основном формируется, когда общее количество железа в теле больше, чем может связать апоферритин. Гемосидерин собирается в клетках в виде больших кластеров, которые видны под микроскопом, как большие частицы. Наоборот, частицы ферритина так малы и рассеяны, что их можно обычно увидеть в цитоплазме клеток только с помощью электронного микроскопа. Когда уровень железа в плазме падает до низких значений, некоторое его количество из запаса в форме ферритина легко выделяется в плазму и транспортируется в виде трансферрина к нуждающимся в железе областям. Уникальной особенностью молекулы трансферрина является то, что она прочно связывается с рецепторами клеточной мембраны эритробластов в костном мозге. Затем вместе со связанным железом молекула поглощается эритробластом путем эндоцитоза. Внутри клетки трансферрин освобождает железо прямо в митохондрии, где синтезируется гем. При отсутствии адекватного количества трансферрина в крови людей недостаточность транспорта железа к эритробластам может вызвать тяжелую гипохромную анемию, которая характеризуется наличием красных клеток крови, содержащих гораздо меньше гемоглобина, чем в норме. Когда эритроциты завершают свой жизненный путь и разрушаются, гемоглобин, выделившийся из клеток, поглощается моноцитарно-макрофагальными клетками. Железо при этом освобождается и накапливается преимущественно в виде ферритина, чтобы использовать ся, когда необходимо, для формирования нового гемоглобина. Ежедневная потеря железа. Мужчина выделяет примерно 0,6 мг железа ежедневно, главным образом с фекалиями. Дополнительное количество железа теряется при кровотечении. У женщин дополнительная менструальная потеря крови дает долговременную потерю железа в среднем примерно до 1,3 мг/сут. – Также рекомендуем “Всасывание железа в кишечнике. Длительность жизни эритроцитов” Оглавление темы “Эритропоэз. Белые клетки крови”: |
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”:
1. Вентиляция легких. Вентиляция кровью легких. Физиологическое мертвое пространство. Альвеолярная вентиляция.
2. Перфузия легких кровью. Влияние гравитации на вентиляцию легких. Влияние гравитации на перфузию легких кровью.
3. Коэффициент вентиляционно-перфузионных отношений в легких. Газообмен в легких.
4. Состав альвеолярного воздуха. Газовый состав альвеолярного воздуха.
5. Напряжение газов в крови капилляров легких. Скорость диффузии кислорода и углекислого газа в легких. Уравнение Фика.
6. Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
7. Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.
8. Углекислый газ. Транспорт углекислого газа.
9. Роль эритроцитов в транспорте углекислого газа. Эффект Холдена..
10. Регуляция дыхания. Регуляция вентиляции легких.
Транспорт газов кровью. Транспорт кислорода. Кислородная емкость гемоглобина.
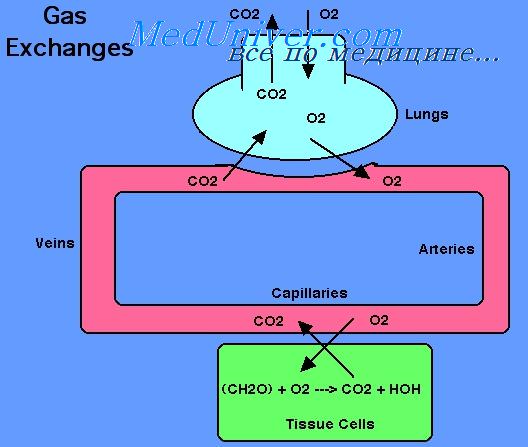
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
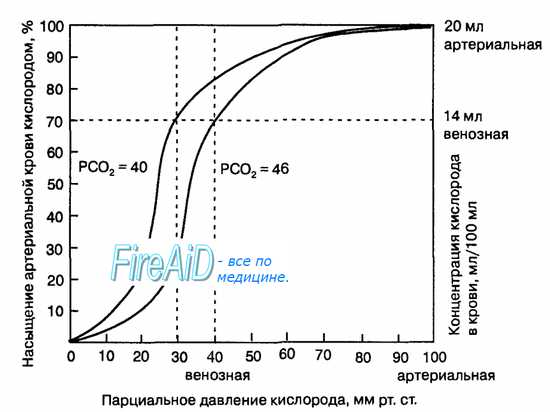
Рис. 10.18. Кривая диссоциации оксигемоглобина. Пределы колебания кривой при РС02 = 40 мм рт. ст. (артериальная кровь) и РС02 = 46 мм рт. ст. (венозная кровь) показывают изменение сродства гемоглобина к кислороду (эффект Ходена).
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
– Также рекомендуем “Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.”