Комплексообразователь в молекуле гемоглобина


Комплексные соединения
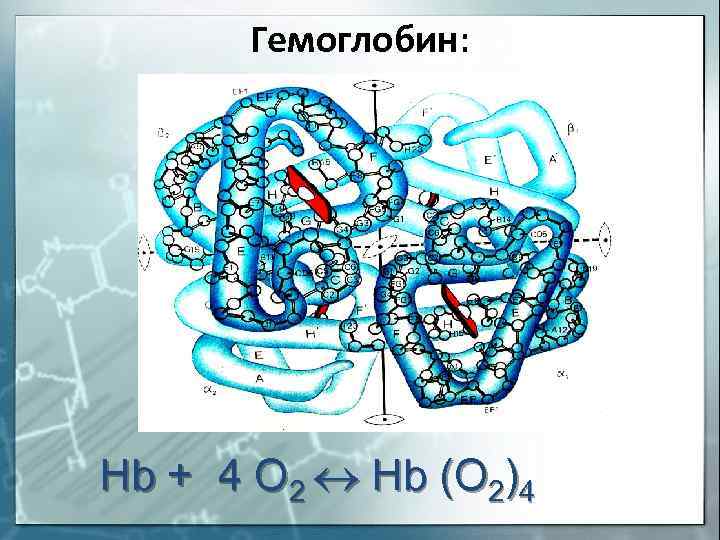
Гемоглобин: Hb + 4 O 2 Hb (O 2)4
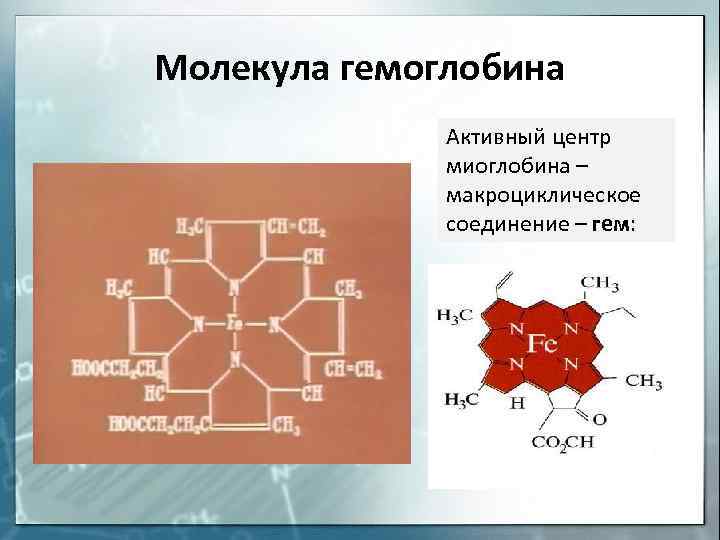
Молекула гемоглобина Активный центр миоглобина – макроциклическое соединение – гем:
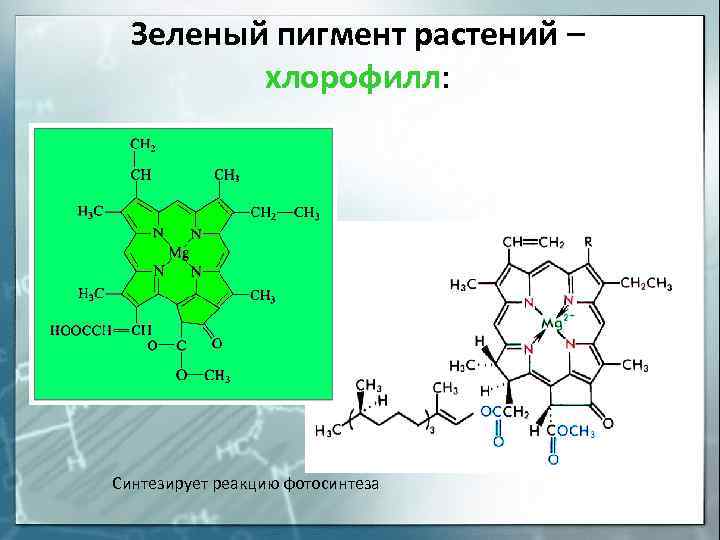
Зеленый пигмент растений – хлорофилл: Синтезирует реакцию фотосинтеза
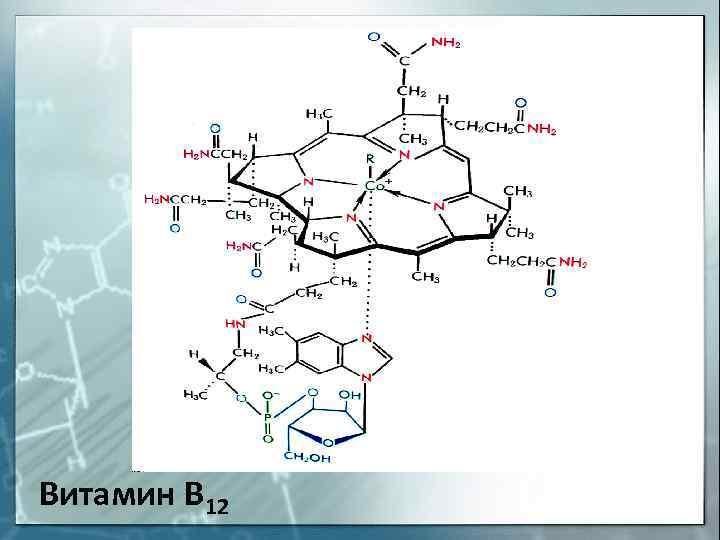
Витамин В 12
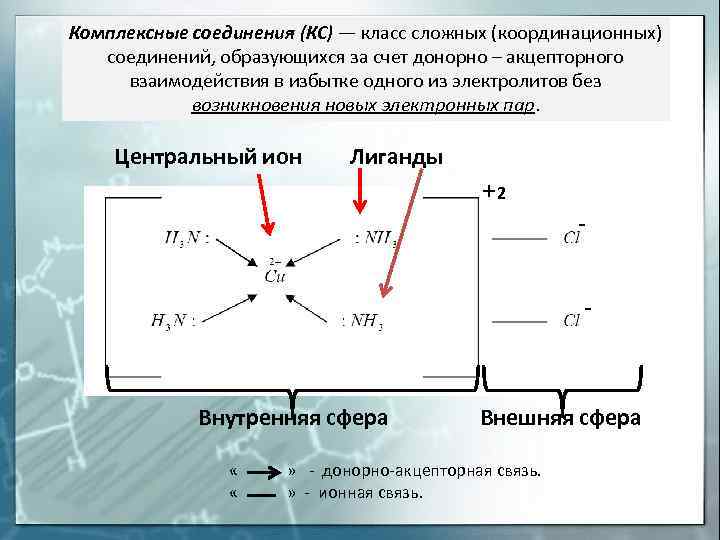
Комплексные соединения (КС) — класс сложных (координационных) соединений, образующихся за счет донорно – акцепторного взаимодействия в избытке одного из электролитов без возникновения новых электронных пар. Центральный ион Лиганды 2 Внутренняя сфера Внешняя сфера « » – донорно-акцепторная связь. « » – ионная связь.
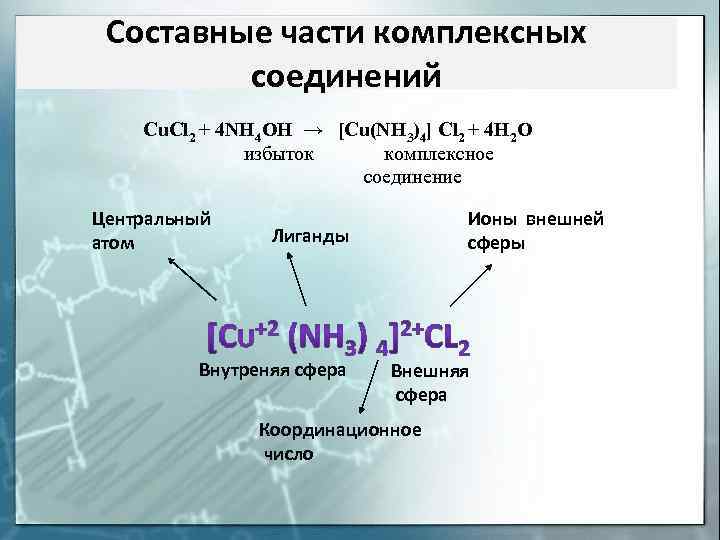
Составные части комплексных соединений Cu. Cl 2 + 4 NH 4 OH → [Cu(NH 3)4] Cl 2 + 4 H 2 O избыток комплексное соединение Центральный атом Ионы внешней сферы Лиганды Внутреняя сфера Внешняя сфера Координационное число

Характеристики комплексов Заряд комплексного иона равен алгебраической сумме зарядов (или степеней окисления) комплексообразователя и лигандов. Z = Zко +∑Zлиг Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с донорными атомами лигандов, т. е. координационное число (КЧ). Прочность комплексного иона характеризуется его константой диссоциации, называемой константой нестойкости (Kн).

Ковалентная (диссоциация по типу слабого электролита) Ионная связь (диссоциация по типу сильного электролита) [Cu(NH 3)4] Cl 2 → [Cu(NH 3)4]2+ + 2 Cl–

Внешняя сфера комплексного соединения – ионы и (или) молекулы, не находящиеся в непосредственной химической связи с комплексообразователем, но нейтрализующие заряд комплексного иона (внутренней сферы) Внутренняя (координационная) сфера комплексного соединения – совокупность комплексообразователя и непосредственно с ним связанных лигандов Лиганды – нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно–акцепторной связью. Центральный атом (комплексообразователь) – выполняет роль акцептора электронных пар и поэтому комплексообразователем могут быть любые частицы, имеющие вакантные орбитали.

комплексообразователи Типичными комплексообразователями являются катионы d- и f- элементов, имеющие вакантные орбитали, например Ag+, Au+, Cu 2+, Zn 2+, Cd 2+, Hg 2+, Fe 3+, Co 2+, Ni 2+, Pt 4+, La 3+, Eu 2+, Th 4+, U 4+ и нейтральные атомы металлов того же типа, например Co, Ni, Fe.
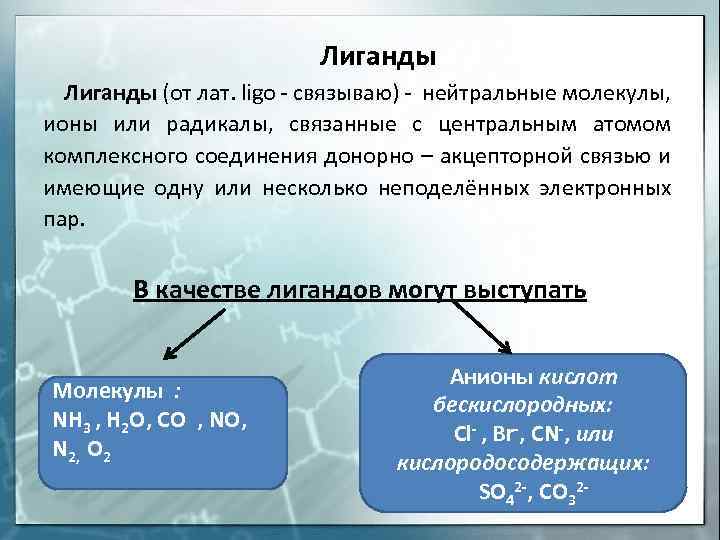
Лиганды (от лат. ligo – связываю) – нейтральные молекулы, ионы или радикалы, связанные с центральным атомом комплексного соединения донорно – акцепторной связью и имеющие одну или несколько неподелённых электронных пар. В качестве лигандов могут выступать Молекулы : NH 3 , H 2 O, CO , NO, N 2, O 2 Анионы кислот бескислородных: Cl- , Br-, CN-, или кислородосодержащих: SO 42 -, CO 32 –
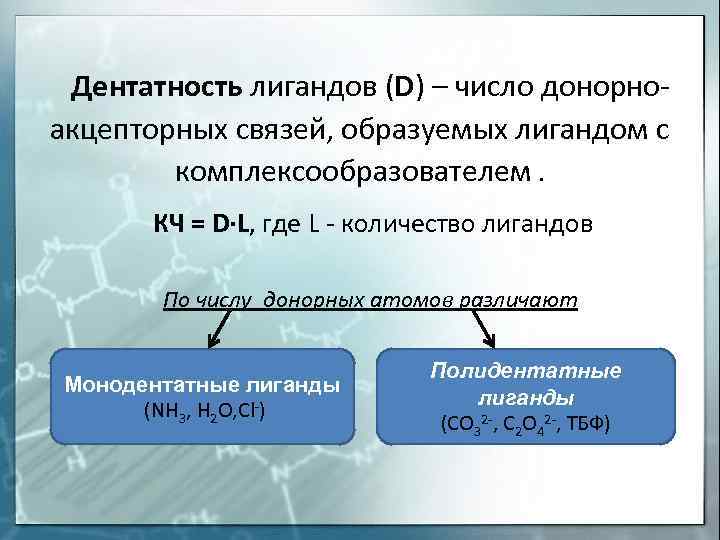
Дентатность лигандов (D) – число донорноакцепторных связей, образуемых лигандом с комплексообразователем. КЧ = D∙L, где L – количество лигандов По числу донорных атомов различают Монодентатные лиганды (NH 3, H 2 O, Cl-) Полидентатные лиганды (CO 32 -, C 2 O 42 -, ТБФ)
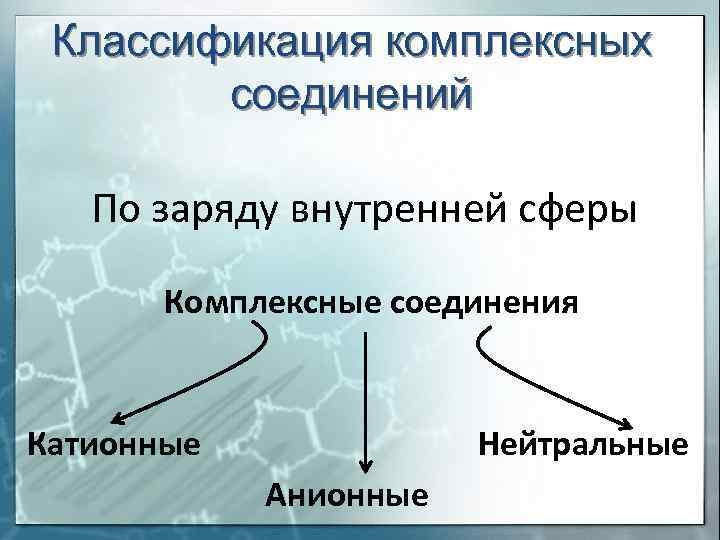
Классификация комплексных соединений По заряду внутренней сферы Комплексные соединения Катионные Нейтральные Анионные
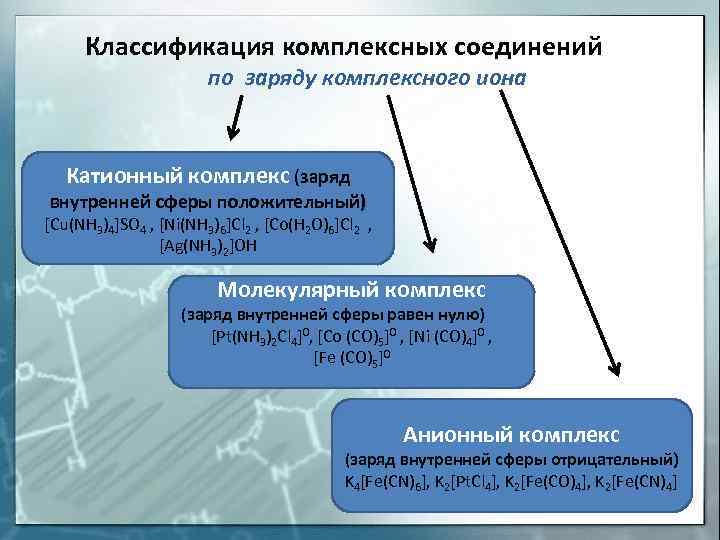
Классификация комплексных соединений по заряду комплексного иона Катионный комплекс (заряд внутренней сферы положительный) [Cu(NH 3)4]SO 4 , [Ni(NH 3)6]Cl 2 , [Co(H 2 O)6]Cl 2 , [Ag(NH 3)2]OH Молекулярный комплекс (заряд внутренней сферы равен нулю) [Pt(NH 3)2 Cl 4]0, [Co (CO)5]0 , [Ni (CO)4]0 , [Fe (CO)5]0 Анионный комплекс (заряд внутренней сферы отрицательный) K 4[Fe(CN)6], K 2[Pt. Cl 4], K 2[Fe(CO)4], K 2[Fe(CN)4]
![2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 2+ 3 - [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4](https://present5.com/presentation/-42515008_134710477/image-16.jpg)
2+ 3 – [Cu(NH 3)4] SO 4 Na 3[Co(NO 2)6] + 0 [Co(NH 3)4 Cl 2] Cl [Pt(NH 3)2 Cl 2] 0 3 – [Fe(CO)5] K 3 [Fe(CN) 6]
![[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 [Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2](https://present5.com/presentation/-42515008_134710477/image-17.jpg)
[Cu(NH 3)4]SO 4 Сульфат тетраамминмеди (II) Na 3[Co(NO 2)6] Гексанитрокобальтат (III) натрия [Pt(NH 3)2 Cl 2] Дихлородиамминплатина [Cr(H 2 O)2(NH 3)3 Cl]Br 2 Бромид хлородиакватриамминхрома (III)

Двойные соли • Двойные соли являются сильными электролитами и в растворах диссоциируют полностью, т. к. связи между катионами металла и анионами кислотного остатка носят ионный характер: • KAl(SO 4)2 → K+ + Al 3+ + 2 SO 42 –

Образование комплексных соединений Реакции комплексообразования: 1. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 2. Ni. Cl 2 + 4 NH 4 OH → [(Ni(NH 3 )4]Cl 2 + 4 H 2 O 3. UO² 2 – катион, который способен образовывать комплексы анионного типа (КЧ=8) Na 2 U 2 O 7↓ + 6 Na 2 CO 3 + 3 H 2 O → 2 Na 4[UO 2(CO 3)3] 2 UO 2 SO 4 + K 4[Fe(CN)6] → (UO 2)2[Fe(CN)6] ↓ + 2 K 2 SO 4 Cu. SO 4 + K 4[Fe(CN)6] → Cu 2[Fe(CN)6]↓ + 2 H 2 SO 4
![Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30](https://present5.com/presentation/-42515008_134710477/image-20.jpg)
Процесс диссоциации внутренней сферы 1 ст. [Cu(NH 3)4]2+ = [Cu(NH 3)3]2+ + NH 30 2 ст. [Cu(NH 3)3]2+ = [Cu(NH 3)2]2+ + NH 30 3 ст. [Cu(NH 3)2]2+ = [Cu(NH 3)]2+ + NH 30 4 ст. [Cu(NH 3)]2+ = Cu 2+ + NH 30 Общий процесс диссоциации комплекса: ∑ [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30
![Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ =](https://present5.com/presentation/-42515008_134710477/image-21.jpg)
Константа нестойкости Кн Произведение ступенчатых констант нестойкости равно общей константе нестойкости: [Cu(NH 3)4]2+ = Cu 2+ + 4 NH 30

Свойства константы нестойкости 1. Константы нестойкости характеризуют относительную устойчивость внутренней координационной сферы комплексов 2. Чем меньше КН , тем прочнее комплекс. 3. По КН, можно рассчитать концентрацию свободных ионов комплексообразователя в растворе комплексного соединения. 4. Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть трудно растворимое соединение или более устойчивый комплекс.
![сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7](https://present5.com/presentation/-42515008_134710477/image-23.jpg)
сравнить прочность однотипных комплексов по константе нестойкости: [Ag(NH 3)2]Cl , Kн = 5, 7 ∙ 10 -8 K[Ag(CN)2] , Kн = 1, 0 ∙ 10 -21 Допустим, что исходная концентрация этих комплексов равна 1 моль/л. Тогда: C(NH 3) = 2 x, C(CN-) = 2 x, C[Ag(NH 3)2]+ = 1 -x, C[Ag(CN)2]- = 1 -x. Так как x

По константе нестойкости и заданной начальной концентрации комплекса можно рассчитать концентрацию комплексообразователя и лигандов. Для корректности расчетов возьмем раствор с избытком лигандов. K 4[Fe(CN)6] → 4 K ++ [Fe(CN)6]4 – ; C = 0, 1 M; Kн = 1, 0 ∙ 10 -37 ; избыток KCN →K+ + CN 0, 1 M 0, 1 M 1 M 1 M Fe [(CN)6]4 – Fe 2+ + 6 CN 0, 1 – x x 6 x+1 исходя из значений константы нестойкости x

Пространственное строение комплексов Геометрическая форма комплексов – это координационный многогранник, образованный в результате определенного расположения лигандов относительно комплексообразователя. Тип гибридизации определяется числом гибридных орбиталей, их формой, направлением в пространстве, взаимным влиянием друг на друга и определенную форму комплекса. Между координационным числом, типом гибридизации и формой есть взаимосвязь:

Пространственное строение комплексов Связь между координационным числом, типом гибридизации и формой:
![Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4](https://present5.com/presentation/-42515008_134710477/image-27.jpg)
Координационное число = 2 ( строение комплекса [Ag(NH 3)2]+ ) Ag 0 [ ]4 d 10 5 s 1 – электронная конфигурация атома серебра Ag+ [ ]4 d 10 5 s 0 – электронная конфигурация иона серебра Вакантные 5 s- и 5 p- орбитали иона серебра являются акцепторами электронных пар атомов азота молекул аммиака (доноров) .
![Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) - электронная конфигурация атома бора](https://present5.com/presentation/-42515008_134710477/image-28.jpg)
Координационное число = 4 (строение комплекса [BF 4]– тетраэдрическое) – электронная конфигурация атома бора – электронная конфигурация катиона бора
![Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная) Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ - плоскоквадратная)](https://present5.com/presentation/-42515008_134710477/image-29.jpg)
Координационное число = 4 (строения комплекса [Co(NH 3)4]2+ – плоскоквадратная)
![Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое) Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-30.jpg)
Координационное число = 6 (строение внешнеорбитального комплекса [Fe. F 6]4– – октаэдрическое)
![Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое) Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– - октаэдрическое)](https://present5.com/presentation/-42515008_134710477/image-31.jpg)
Координационное число = 6 (строение внутриорбитального комплекса [Fe(CN)6]4– – октаэдрическое)
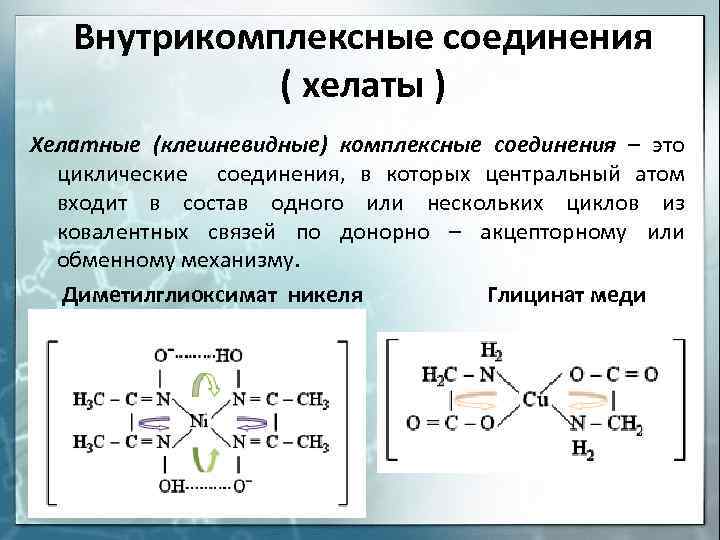
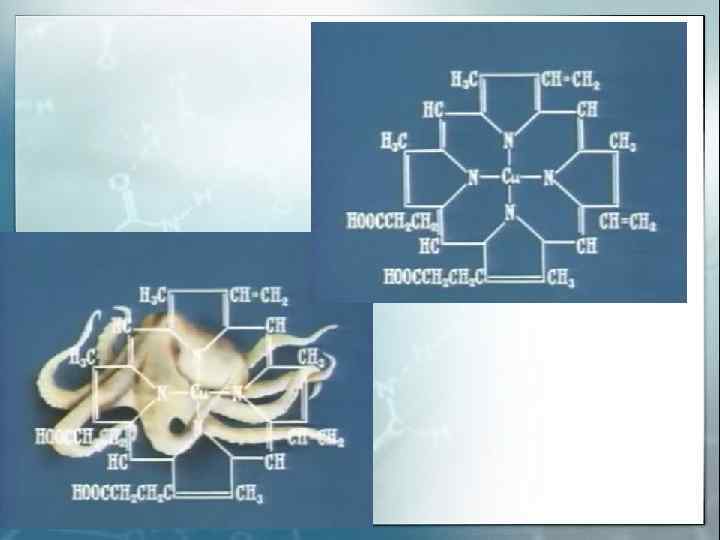
Внутрикомплексные соединения ( хелаты ) Хелатные (клешневидные) комплексные соединения – это циклические соединения, в которых центральный атом входит в состав одного или нескольких циклов из ковалентных связей по донорно – акцепторному или обменному механизму. Диметилглиоксимат никеля Глицинат меди
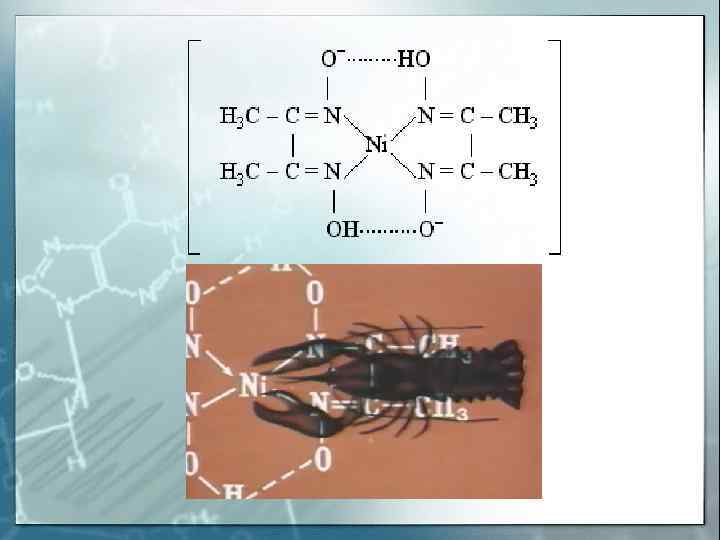
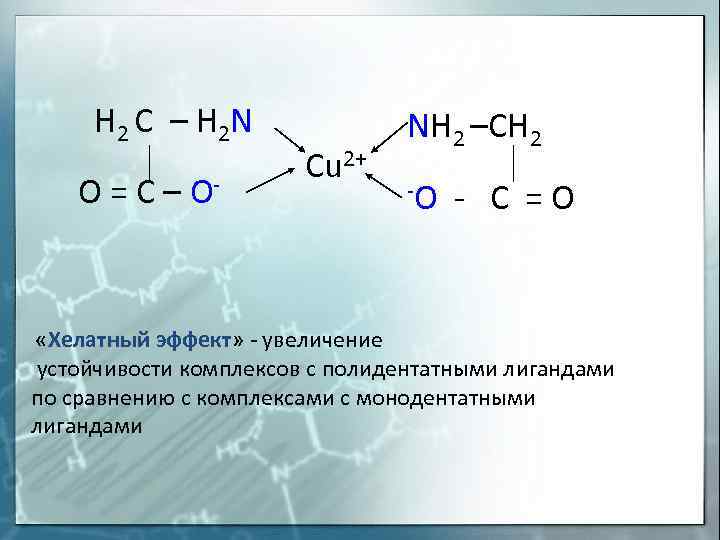
H 2 C – H 2 N O = C – O- «Хелатный Cu 2+ NH 2 –CH 2 -O – C = O эффект» – увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
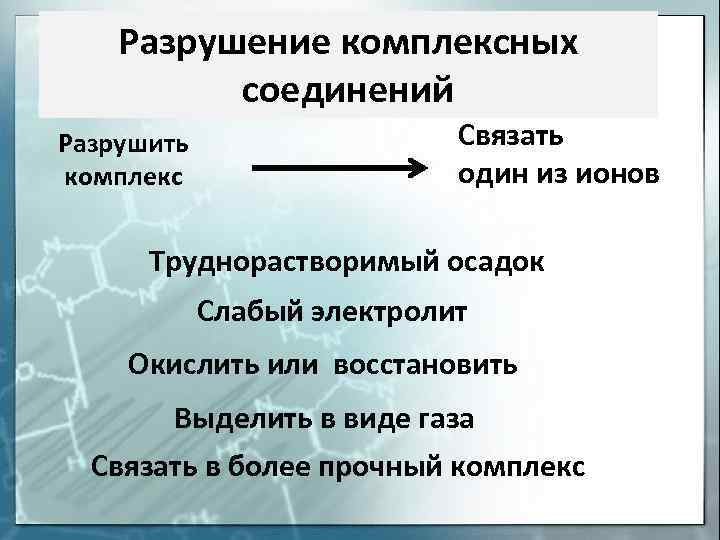
Разрушение комплексных соединений Разрушить комплекс Связать один из ионов Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в более прочный комплекс
![[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + [Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка +](https://present5.com/presentation/-42515008_134710477/image-37.jpg)
[Ag (NH 3)2]+ Ag+ + 2 NH 3 + KI Образование труднорастворимого осадка + HNO 3 + KCN NH 4 NO 3 Образование более прочного комплекса Комплексное соединение может быть разрушено под действием электролита при условии образования более прочного соединения. Таким более прочным соединением могут быть: трудно растворимое соединение или более устойчивый комплекс.
![[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, [Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9,](https://present5.com/presentation/-42515008_134710477/image-38.jpg)
[Ag (NH 3)2]++ KI =Ag. I + 2 NH 3 +K+ Кн = 9, 3 ·10 -8 ПРAg. I = 1, 5·10 -16 [Ag (NH 3)2]++2 CN- = [Ag(CN)2]- +2 NH 3 Кн = 8·10 -22

Химические свойства комплексных соединений. Реакции комплексообразования: Ni. Cl 2 + 4 NH 4 OH → [Ni(NH 3 )4]Cl 2 + 4 H 2 O Реакции обмена с сохранением внутренней сферы комплекса: 4 Fe. Сl 3 + 3 K 4[Fe(CN)6] → Fe 4[Fe(CN)6]3↓ + 12 K Cl
![Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H](https://present5.com/presentation/-42515008_134710477/image-40.jpg)
Реакция разрушения внутренней сферы комплекса: [Cu(NH 3)4 ]SO 4 + Na 2 S +H 2 O → Cu. S↓ + Na 2 SO 4 + 4 NH 3 Реакция замещения лигандов во внутренней сфере: K 3[Fe. F 6] + 6 KSCNизб → K 3[Fe(SCN)6] +6 KF

Окислительно – восстановительные реакции с участием комплексных соединений сопровождаются изменением степени окисления комплексообразователя :
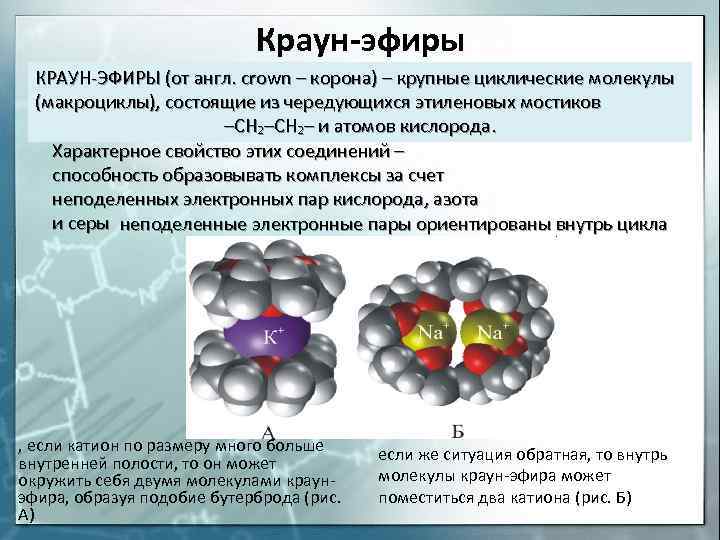
Краун-эфиры КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), состоящие из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. Характерное свойство этих соединений – способность образовывать комплексы за счет неподеленных электронных пар кислорода, азота и серы неподеленные электронные пары ориентированы внутрь цикла , если катион по размеру много больше внутренней полости, то он может окружить себя двумя молекулами краунэфира, образуя подобие бутерброда (рис. А) если же ситуация обратная, то внутрь молекулы краун-эфира может поместиться два катиона (рис. Б)
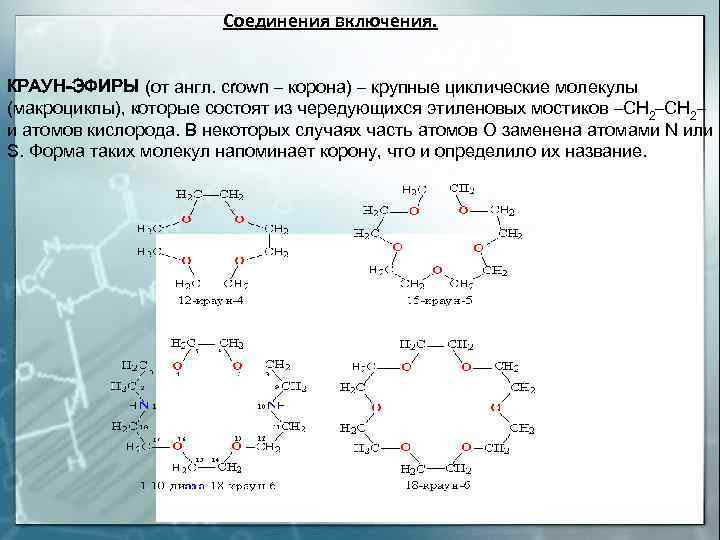
Соединения включения. КРАУН-ЭФИРЫ (от англ. crown – корона) – крупные циклические молекулы (макроциклы), которые состоят из чередующихся этиленовых мостиков –СН 2– и атомов кислорода. В некоторых случаях часть атомов О заменена атомами N или S. Форма таких молекул напоминает корону, что и определило их название.

Реакции комплексообразования. Hg(NO 3)2 + 2 KI (р-р. ) → Hg. I 2 ↓ +2 KNO 3 оранж. Hg. I 2 ↓ + 2 KI (р-р. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый Суммарная реакция: Hg(NO 3)2 + 4 KI (изб. ) → K 2[Hg. I 4] + 2 KNO 3 • желто-зеленый
Источник
Комплексные соединения, рассмотренные нами выше, содержали лиганды, в основном, неорганической природы. Однако, в биологи-ческих системах огромную роль играют комплексные соединения, в которых в качестве лигандов выступают сложные органические молекулы, обладающие полидентатными свойствами (т. е., способны образовывать с комплексообразователем несколько связей).
Металлопротеины
К металлопротеинам относят биополимеры, которые, помимо белка, содержат простетическую группу (компонент небелкового характера), включающую ионы металлов.
Отдельную группу металлопротеинов составляют гемопро-теины, содержащие в качестве простетической группы соединения железа. Одним из важнейших гемопротеинов является гемоглобин. Он состоит из белка (глобина) и комплекса железа с порфирином (гема). В геме ион Fe2+ (комплексообразователь), связан с двумя атомами азота, принадлежащими порфириновому кольцу, ковалентной связью, а еще с двумя – координационной. Координа-ционное число Fe2+ равно шести: в порфириновом комплексе пятое координационное место занимает гистидиновая группа белка, образуя координационую связь атома азота с Fe2+. В отсутствие кислорода шестым лигандом является вода. В случае, когда вода замещается на кислород, образуется оксигемоглобин. Кроме воды и кислорода ион Fe2+ может связывать и некоторые другие лиганды, например, СО, CN- и оксиды азота. Так, с молекулами угарного газа гемоглобин образует карбоксигемоглобин, а с оксидами азота – метгемоглобин, содержащий ионы Fe3+. Накопление этих видов гемоглобина в крови приводит к снижению снабжения тканей кровью.
Схема образования связей в гемоглобине
Гем в виде гем-порфирина является простетической группой производных гемоглобина: миоглобина, каталазы, пероксидазыи цитохромов.
Отличительной особенностью гемоглобина (миоглобина) являет-ся постоянство степени окисления железа Fe2+. Равновесие:
О2 + гемоглобин ⇄ оксигемоглобин
в легких смещено вправо, а в клетках – влево.
Таким образом, гемоглобин (миоглобин) является переносчиком молекул (Н2О, О2).
Транспортные функции выполняют и цитохромы,в которых связь между гемом и полипептидной цепью осуществляется при помощи остатков цистеина белковой цепи.
Однако, в отличие от гемоглобина и миоглобина, механизм их действия основан на изменении степени окисления железа:
Fe2+ – Fe3+,
Fe3+ + Fe2+.
Передавая электроны от цитохрома b к цитохромооксидазе, ионы железа участвуют в процессе окислительного фосфорилирования.
С кислородом и СО цитохромы не взаимодействуют.
Витамины
Единственным витамином, содержащим в своей структуре металл, является витамин В12 (кобаламин).
В его состав входит ион Со3+, который находится в центре плос-кой корриновой системы (подобна порфириновой) и связан с атомами азота восстановленных пиррольных колец. Перпендикулярно плос-кости корриновой системы расположен нуклеотидный лиганд, состо-ящий из 5,6-диметилбензимидазола и рибозы с остатком фосфорной кислоты. Наконец, шестым лигандом является цианид-ион.
Витамин В12 содержится в ферментных системах в виде В12-ко-ферментов или кобамидных коферментов – метилкобаламина, содер-жащего дополнительную метильную группу, и дезоксиаденозин-кобаламина, содержащего 5¢-дезоксиаденозинкобаламин.
Так, метил-кобаламин выполняет функции переносчика метильной группы в реакции синтеза метионина. Кроме того, витамин В12 необходим для образования эритроцитов.
Недостаток витамина12 приводит к нарушениям деятельности нервной системы и вызывает резкое снижение кислотности желудоч-ного сока.
Схема образования связей в витамине B12 (кобаламине)
Ферменты
Ферментами называют класс веществ белковой природы, катали-зирующих большое число химических реакций. Ферменты обеспечи-вают реализацию генетической информации, а также обмен веществ и энергии. Ферменты отличаются от неорганических катализаторов значительно большей активностью и высокой специфичностью действия: один фермент, как правило, катализирует только одну химическую реакцию.
Действующим началом фермента карбоксипептидазы, катализи-рующего процессы гидролиза, является ион Zn2+. Ион цинка оттягивает на себя электроны карбонильной группы С = O в пептиде (- СО – NH -), в результате связь С = O еще больше поляризуется, что облегчает гидролиз и разрыв С-N связи.
Ионы цинка также входят в состав фермента карбоангидразы, который катализирует гидратацию СО2, т. е. образование иона НСО3-, и в тоже время участвует в каталитическом разложении НСО3-, которое сопровождается выделением СО2. Первая реакция протекает в альвеолах легких, вторая (обратная) – в клетках.
Некоторые другие комплексные соединения металлов, играющие определенную биологическую роль, приведены в таблице 2.
Таблица 2. Биологически важные комплексы металлов.
| Металл | Тип биомолекулы | Лиганды | Биологическая функция |
| Cu2+ | Цитохромооксидаза, церулоплазмин и др. | Азотистые основания | Окисление, депонирование и транспорт меди |
| Mn2+ | Аргиназа, декарбокси-лазы аминокислот, фосфотрансферазы и др. | Фосфат, имидазол | Декарбоксили-рование, перенос фосфатных групп |
| Mo2+ | Нитрогеназа, нитрат-редуктаза, ксантин-оксидаза | Не иденти-фицированы | Восстановление N2 в NH3, окисление пуринов |
| Mg2+ | Хлорофилл | Порфирин | Превращение световой энергии в энергию химичес-ких связей |
| Cr3+ | Дрожжи | Никотиновая кислота, амино-кислоты | Участие в угле-водном обмене, усиление действия инсулина |
Источник
Биологическая роль комплексных соединений
Комплексные соединения, рассмотренные нами выше, содержали лиганды, в основном, неорганической природы. Однако, в биологи-ческих системах огромную роль играют комплексные соединения, в которых в качестве лигандов выступают сложные органические молекулы, обладающие полидентатными свойствами (т. е., способны образовывать с комплексообразователем несколько связей).
Металлопротеины
К металлопротеинам относят биополимеры, которые, помимо белка, содержат простетическую группу (компонент небелкового характера), включающую ионы металлов.
Отдельную группу металлопротеинов составляют гемопро-теины, содержащие в качестве простетической группы соединения железа. Одним из важнейших гемопротеинов является гемоглобин. Он состоит из белка (глобина) и комплекса железа с порфирином (гема). В геме ион Fe 2+ (комплексообразователь), связан с двумя атомами азота, принадлежащими порфириновому кольцу, ковалентной связью, а еще с двумя — координационной. Координа-ционное число Fe 2+ равно шести: в порфириновом комплексе пятое координационное место занимает гистидиновая группа белка, образуя координационую связь атома азота с Fe 2+ . В отсутствие кислорода шестым лигандом является вода. В случае, когда вода замещается на кислород, образуется оксигемоглобин. Кроме воды и кислорода ион Fe 2+ может связывать и некоторые другие лиганды, например, СО, CN — и оксиды азота. Так, с молекулами угарного газа гемоглобин образует карбоксигемоглобин, а с оксидами азота — метгемоглобин, содержащий ионы Fe 3+ . Накопление этих видов гемоглобина в крови приводит к снижению снабжения тканей кровью.
Схема образования связей в гемоглобине
Гем в виде гем-порфирина является простетической группой производных гемоглобина: миоглобина, каталазы, пероксидазыи цитохромов.
Отличительной особенностью гемоглобина (миоглобина) являет-ся постоянство степени окисления железа Fe 2+ . Равновесие:
О2 + гемоглобин ⇄ оксигемоглобин
в легких смещено вправо, а в клетках – влево.
Таким образом, гемоглобин (миоглобин) является переносчиком молекул (Н2О, О2).
Транспортные функции выполняют и цитохромы,в которых связь между гемом и полипептидной цепью осуществляется при помощи остатков цистеина белковой цепи.
Однако, в отличие от гемоглобина и миоглобина, механизм их действия основан на изменении степени окисления железа:
Fe 2+ —
Fe 3+ ,
Fe 3+ +
Fe 2+ .
Передавая электроны от цитохрома b к цитохромооксидазе, ионы железа участвуют в процессе окислительного фосфорилирования.
С кислородом и СО цитохромы не взаимодействуют.
Единственным витамином, содержащим в своей структуре металл, является витамин В12 (кобаламин).
В его состав входит ион Со 3+ , который находится в центре плос-кой корриновой системы (подобна порфириновой) и связан с атомами азота восстановленных пиррольных колец. Перпендикулярно плос-кости корриновой системы расположен нуклеотидный лиганд, состо-ящий из 5,6-диметилбензимидазола и рибозы с остатком фосфорной кислоты. Наконец, шестым лигандом является цианид-ион.
Витамин В12 содержится в ферментных системах в виде В12-ко-ферментов или кобамидных коферментов — метилкобаламина, содер-жащего дополнительную метильную группу, и дезоксиаденозин-кобаламина, содержащего 5¢-дезоксиаденозинкобаламин.
Так, метил-кобаламин выполняет функции переносчика метильной группы в реакции синтеза метионина. Кроме того, витамин В12 необходим для образования эритроцитов.
Недостаток витамина12 приводит к нарушениям деятельности нервной системы и вызывает резкое снижение кислотности желудоч-ного сока.
Схема образования связей в витамине B12 (кобаламине)
Ферментами называют класс веществ белковой природы, катали-зирующих большое число химических реакций. Ферменты обеспечи-вают реализацию генетической информации, а также обмен веществ и энергии. Ферменты отличаются от неорганических катализаторов значительно большей активностью и высокой специфичностью действия: один фермент, как правило, катализирует только одну химическую реакцию.
Действующим началом фермента карбоксипептидазы, катализи-рующего процессы гидролиза, является ион Zn 2+ . Ион цинка оттягивает на себя электроны карбонильной группы С = O в пептиде (- СО — NH -), в результате связь С = O еще больше поляризуется, что облегчает гидролиз и разрыв С-N связи.
Ионы цинка также входят в состав фермента карбоангидразы, который катализирует гидратацию СО2, т. е. образование иона НСО3 — , и в тоже время участвует в каталитическом разложении НСО3 — , которое сопровождается выделением СО2. Первая реакция протекает в альвеолах легких, вторая (обратная) — в клетках.
Некоторые другие комплексные соединения металлов, играющие определенную биологическую роль, приведены в таблице 2.
Таблица 2. Биологически важные комплексы металлов.
| Металл | Тип биомолекулы | Лиганды | Биологическая функция |
| Cu 2+ | Цитохромооксидаза, церулоплазмин и др. | Азотистые основания | Окисление, депонирование и транспорт меди |
| Mn 2+ | Аргиназа, декарбокси-лазы аминокислот, фосфотрансферазы и др. | Фосфат, имидазол | Декарбоксили-рование, перенос фосфатных групп |
| Mo 2+ | Нитрогеназа, нитрат-редуктаза, ксантин-оксидаза | Не иденти-фицированы | Восстановление N2 в NH3, окисление пуринов |
| Mg 2+ | Хлорофилл | Порфирин | Превращение световой энергии в энергию химичес-ких связей |
| Cr 3+ | Дрожжи | Никотиновая кислота, амино-кислоты | Участие в угле-водном обмене, усиление действия инсулина |
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: На стипендию можно купить что-нибудь, но не больше. 9350 —
| 7414 — или читать все.
источник
СОЕДИНЕНИЙ
Многие вещества, присутствующие в организме: аминокислоты, белки, нуклеиновые кислоты и их основания, витамины, гормоны, порфирины, — являются активными лигандами и, взаимодействуя с катионами биометаллов, образуют многообразные комплексные соединения, выполняющие определенные биологические функции. Ряд ферментов в составе своих активных центров содержат катионы металлов, что обеспечивает строгое пространственное расположение функциональных групп фермента.
Некоторые природные прочные комплексные соединения содержат в качестве хелатообразующего лиганда порфириновые производные (разд. 10.1), в которых за счет электронодонорных свойств четырех атомов азота образуются четыре связи с комплексообразователем. В зависимости от природы комплексообразователя изменяются биологические функции этих комплексов. Так, комплексы порфирина с катионом железа являются основой гемоглобина и цитохромов, с катионом магния — хлорофилла, а с катионами двух металлов: железа и меди — цито хромоксидазы. Рассмотрим особенности строения гемоглобина миоглобина и метгемоглобина.
Комплексообразователем в гемоглобине и миоглобине является ион Fe 2+ , который, предоставляя шесть свободных атомных орбиталей, образует шесть связей по донорно-акцепторному механизму. Из них четырьмя связями ион железа связан с атомами азота порфиринового лиганда, образуя гем, пятая связь занята лигандом глобином (белок), а шестая — молекулой воды — лигандом, который связан с комплексообразователем лабильно:
Миоглобин связывает часть кислорода, поступающего в ткани, путем замещения молекулы воды во внутренней сфере на молекулу кислорода, образуя оксимиоглобин, который достаточно прочно удерживает кислород. Это позволяет тканям запасать кислород для его использования в случаях острой кислородной недостаточности. Необходимо обратить внимание на то, что кислород не окисляет комплексообразователь Fe 2+ в геме миоглобина.
Гемоглобин содержится в эритроцитах крови. Его молекула состоит из четырех гемов, аналогичных по строению гему миоглобина, которые объединены четырьмя глобиновыми цепями. В молекуле гемоглобина (ННb) различают четыре фрагмента а1 а2 , B1, B2, каждый из которых способен к замещению молекулы воды (лабильного лиганда) на молекулу 02. Находясь в легких, гемоглобин присоединяет в результате лигандообменной реакции вместо молекул воды молекулы кислорода, образуя оксигемоглобин (ННb02), в котором катион железа сохраняет свой заряд +2:
Таким образом, связывание гемоглобином кислорода является реакцией обмена лиганда, при которой нет окислительно-восстановительных превращений. Поэтому нет никаких оснований называть оксигемоглобин окисленной формой, а гемоглобин — восстановленной формой, что, к сожалению, имеет место даже в современной литературе и учебниках. Кроме этих неудачных терминов используется еще ненужный термин «дезокси-гемоглобин», который означает оксигемоглобин, отдавший кислород, а в действительности это просто гемоглобин.
Оксигемоглобин выполняет функцию транспорта кислорода у высших животных. Благодаря оксигемоглобину литр крови переносит 250 мл кислорода в капилляры различных органов. Здесь оксигемоглобин отдает кислород (разд. 8.5), который диффундирует через плазму и стенки капилляров в ткани. Часть поступившего кислорода соединяется с миоглобином для поддержания необходимого парциального давления кислорода в тканях. Основная часть кислорода вступает в процессы метаболизма, превращаясь в конце концов в оксид углерода(4) и воду, которые с помощью венозной крови выводятся из организма (разд. 8.5).
Венозная кровь поглощает С02 из тканей и транспортирует его в легкие на 80 % в виде НСО3(-), 15 % в виде аниона карбамино-гемоглобина (НbСО2)- и 5 % в растворенном виде (С02 * mН2О). В легких, вследствие избытка кислорода, кровь освобождается от СО2 (который далее удаляется при выдохе), а гемоглобин опять насыщается кислородом (разд. 8.5). Гемоглобин и оксигемоглобин являются слабыми кислотами и в крови (рН =7,40) находятся частично в ионизированном состоянии: Hb-
