Концентрация прографа в крови норма
Метод определения
Хемилюминесцентный иммуноанализ (Architect i2000, Abbott).
Метод ориентирован на достижение уровня чувствительности ≤1,5 нг/мл, предел чувствительности, определенный на основе 2 стандартных отклонений разброса нулевого калибратора, составляет около 0,3 нг/мл, функциональная чувствительность метода (уровень, на котором коэффициент вариации в репликах измерений не превышает 20%) 2,0 нг/мл.
Исследуемый материал
Цельная кровь (с ЭДТА)
Такролимус – международное наименование иммуносупрессивного препарата из группы природных макролидов. Открыт в 1987 г. в Японии. Этот препарат используют по назначению врача для предупреждения отторжения трансплантата после пересадки органов. Он входит в официальный перечень жизненно необходимых и важных лекарственных препаратов (ЖНВЛП).
По механизмам действия на клетки иммунной системы такролимус сходен с циклоспорином (см. тест №274), но более активен, чем циклоспорин, и более эффективен в меньших дозах. Реакции отторжения трансплантата на фоне иммуносупрессивной терапии, включающей такролимус, встречаются реже, чем на фоне терапии, включающей циклоспорин, побочные эффекты легче, лучше поддаются купированию. Основной клинический эффект такролимуса связан с мощным избирательным действием, направленным против Т-лимфоцитов, которые участвуют в отторжении трансплантата. Под воздействием такролимуса происходит блокада активации Т-лимфоцитов, торможение Т-клеточной пролиферации и функций Т-клеток, в результате чего уменьшается угроза отторжения трансплантата. Несмотря на то, что такролимус, по сравнению с циклоспорином, имеет лучшие терапевтические характеристики, его применение всё же связано с вероятностью появления токсических эффектов, преимущественно нефротоксичности, а также – нейротоксичности, артериальной гипертензии, бессонницы, тошноты. Поэтому при назначении нужен индивидуальный подбор дозировки и контроль уровня такролимуса в крови.
Фрмакокинетика такролимуса
Оптимальные дозировки препарата зависят от способа применения. Такролимус применяют внутривенно или перорально. Характеристики всасывания препарата из желудочно-кишечного тракта при пероральном приёме и его кинетика могут различаться у разных пациентов, а также изменяться у одного и того же человека. Пик концентрации отмечается в период от 0,5 до 4 часов после приёма. Период полувыведения препарата из крови (преимущественно путем метаболизма в печени и тонком кишечнике) составляет в среднем 8-12 часов, но может варьировать от 4 до 41 часа.
Лабораторный мониторинг такролимуса
Показано, что цельная кровь является наиболее адекватным материалом для контроля уровня такролимуса. Но не существует твердо установленных терапевтических рамок (диапазона) желательной концентрации такролимуса в цельной крови. Особенности клинического состояния, индивидуальные различия в чувствительности к иммуносупрессивному и нефротоксическому эффектам такролимуса, сочетание с другими иммуносупрессорами, тип трансплантата, период после трансплантации и ряд других факторов вносят существенный вклад в индивидуальные различия оптимального уровня такролимуса в крови. В связи с этим, концентрацию такролимуса не следует использовать как единственный показатель для внесения изменений в режим терапии. Перед принятием решений об изменении дозы препарата обязательно оценивают клиническое состояние пациента.
Концентрация такролимуса в пробе, измеренная с использованием тест-систем разных производителей, может варьировать вследствие различия методов и разной специфичности реагентов. Метаболиты такролимуса проявляют кросс-реактивность разной степени в методах иммуноанализа. Обычно, у большинства пациентов, метаболиты присутствуют в крови в незначительной концентрации. Исключением, однако, являются пациенты с трансплантатом печени и гипербилирубинемией, у которых может отмечаться сдвиг результата в сторону повышения при исследовании методами иммуноанализа вследствие нарушения выведения метаболитов такролимуса и аккумуляции их в крови.
Поскольку терапевтические рамки (диапазон) могут в определенной степени варьировать в зависимости от используемого метода измерения концентрации такролимуса, их следует отдельно отрабатывать для каждого метода. Значения, получаемые с применением разных методов исследования, не следует использовать как взаимозаменяемые (нельзя использовать коэффициенты пересчёта!) вследствие различия методов и их разной кросс-реактивности с метаболитами.
Важно! Каждому пациенту рекомендуется для лабораторного мониторинга уровня такролимуса в крови проводить исследования в динамике в одной лаборатории.
Несмотря на то, что терапевтические рамки (диапазон) такролимуса твёрдо не установлены, есть общее согласие специалистов, что целевыми значениями для ранних этапов после трансплантации при измерении концентрации препарата на спаде через 12 часов после приёма являются концентрации в диапазоне 5-20 нг/мл. Более высокие концентрации связаны с повышением опасности возникновения побочных эффектов. Концентрации, измеренные на спаде через 24 часа после приёма, на 33%-50% ниже, чем соответствующие уровни на спаде через 12 часов после приёма.
Пределы определения: 1,5 нг/мл-60,0 нг/мл
Литература
- Клим Ф. Такролимус при трансплантации почки. Нефрология. – 2007. – №4.- c.18-27;
- Tietz Textbook of Clinical Chemistry and Molecular Diagnostic (Ed. Burtis C.A., Ashwood E.R., Bruns D.E. 5th ed., Elsiever, 2012, p.2238);
- Материалы фирмы – производителя реагентов.
Исследование, направленное на определение концентрации лекарственного иммуносупрессивного препарата такролимуса в крови.
Синонимы русские
Такролимус; Такролимус-Тева; Адваграф; Програф; Протопик; Такропик; Такросел.
Синонимы английские
Tacrolimus; FK-506; Fujimycin;Tacrolimus-Teva; Advagraf; Prograf; Protopic; Tacropic; Tacrosel.
Метод исследования
Поляризационный флуороиммуноанализ (ПФИА).
Единицы измерения
нг/мл (нанограмм на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 5-6 часов перед исследованием.
- Исследование проводится по назначению врача через 12 часов после последнего приема препарата.
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Такролимус (FK506) – это иммуносупрессивный лекарственный препарат, относящийся к группе макролидов. При воздействии на иммунную систему он оказывает блокирующее действие на активацию Т-клеточного звена иммунитета, снижая пролиферацию и функционирование Т-лимфоцитов. Отмечается также торможение процесса транскрипции генов, снижение зависимой от Т-хелперов пролиферации В-клеток и снижение продукции цитокинов: интерлейкина-2 и 3, интерферона гамма.
Данный препарат применяется в основном в целях иммуносупрессии после трансплантации печени, почек, сердца и других органов для предупреждения реакции отторжения трансплантата. Такролимус может быть использован в качестве альтернативного лечения циклоспорином при его неэффективности, развитии серьезных побочных эффектов и отторжения трансплантата. Также в отличие от циклоспорина, такролимус является более активным препаратом в наименьших терапевтических дозах. Однако его использование может приводить к развитию некоторых осложнений. К ним относятся нефротоксичность, нейротоксичность, артериальная гипертензия, сахарный диабет. При лечении такролимусом развитие его токсичных эффектов, а в последствии отказ от применения связаны с несколькими причинами. Это узкий диапазон доз, возможность перорального и внутривенного способов введения препарата, различие параметров фармакокинетики и фармакодинамики у пациентов. Также отсутствует четкая взаимосвязь между применяемой дозой препарата и его количеством в циркулируемой крови, что приводит к затруднениям в лечении такролимусом.
В связи с этим для получения наибольшего иммуносупрессивного эффекта при лечении и для снижения числа осложнений всем пациентам, принимающим такролимус, необходимо проводить рутинный лекарственный мониторинг. Он заключается в периодическом определении уровня препарата в крови пациентов в целях подбора индивидуальной терапевтической дозы.
Концентрация такролимуса определяется в крови пациентов после проведения трансплантации органов. Время первого и интервал последующих измерений определяется лечащим врачом и индивидуален для каждого пациента. Известно, что среднее время полувыведения препарата, а следовательно, спад его концентрации в циркулирующей крови, составляет 10-12 часов. Единый терапевтический диапазон такролимуса, определяемый в крови, не установлен. Это связано с видом трансплантируемого органа, особенностью клинического течения после трансплантации, периода после трансплантации, чувствительностью пациентов к эффектам такролимуса, в том числе и токсическим, с индивидуальными характеристиками пациентов, сопутствующей патологией, возрастом, расой. Кроме того, метаболизм препарата связан с особенностью процессов всасывания в желудочно-кишечном тракте, состоянием печени и желчного пузыря, приемом пищи. Известно, что у пациентов после трансплантации печени и при холестазе отмечаются завышенные концентрации такролимуса в крови из-за нарушения его метаболизма и выведения.
Существует несколько методов определения концентрации такролимуса: метод твердофазного иммуноферментного анализа, метод хемилюминесцентного иммуноанализа, метод высокоэффективной жидкостной хроматографии, масс-спектрометрия. Каждый метод имеет свои особенности, преимущества и недостатки, разницу в единицах измерения концентраций такролимуса. Тест-системы различных производителей различаются по параметрам диагностической чувствительности и специфичности.
Поэтому рекомендуется проводить определение количества такролимуса в крови индивидуально для каждого пациента с использованием одного метода лабораторной диагностики и применением единой диагностической системы в течение всего периода после трансплантации. При оценке эффективности проводимой терапии такролимусом необходимо учитывать не только изменение его концентрации в крови, но и особенности клинического состояния пациента после трансплантации.
Для чего используется исследование?
- Для определения концентрации такролимуса в крови;
- Для подбора индивидуальной дозы препарата и ее коррекции;
- Для мониторинга концентрации такролимуса в крови после проведения трансплантации;
- Для оптимизации контроля за лечением с помощью коррекции дозы.
Когда назначается исследование?
- При назначении такролимуса или его аналогов после проведения трансплантации органа;
- При необходимости определения концентрации препарата и мониторинга ее колебаний в крови после трансплантации;
- При недостаточной эффективности применяемого препарата и решении вопроса о коррекции дозы;
- При изменении дозировки и лекарственной формы препарата;
- При подозрении на несоблюдение пациентом режима приема препарата;
- При подозрении на передозировку препаратом;
- При появлении симптомов интоксикации и побочных эффектов на фоне приема такролимуса.
Что означают результаты?
Референсные значения: терапевтический диапазон индивидуален и определяется лечащим врачом. Порог токсичности: значения выше 20 нг/мл связаны с повышением риска побочных эффектов.
Результаты исследования оцениваются лечащим врачом с учетом особенностей проведенной трансплантации, клинического течения после трансплантации, дозы такролимуса, режима его приема, возраста пациента, сопутствующих патологий и индивидуальной переносимости препарата, чувствительности пациентов к эффектам такролимуса, в том числе и токсическим.
Что может влиять на результат?
- После трансплантации печени, при заболеваниях печени, при холестазе может отмечаться увеличение концентрации такролимуса и его метаболитов в крови из-за нарушения его метаболизма и выведения.
- Время и интервалы измерений концентраций препарата, особенности течения периода после трансплантации и клиническое состояние пациента.
Важные замечания
Очень важно проводить определение количества такролимуса в крови индивидуально для каждого пациента с использованием одного метода лабораторной диагностики и с применением единой диагностической системы в течение всего периода после трансплантации. При оценке эффективности проводимой терапии такролимусом необходимо учитывать не только изменение его концентрации в крови, но и особенности клинического состояния пациента после трансплантации, результаты других лабораторных и инструментальных исследований.
Кто назначает исследование?
Хирург, трансплантолог, нефролог, уролог, гепатолог, кардиолог, гастроэнтеролог, терапевт.
Литература
- Urbanowicz T, Straburzyńska-Migaj E, Klotzka A, Baszyńska-Wachowiak H, Misterski M, Grajek S, Jemielity M. Induction therapy, tacrolimus plasma concentration, and duration if intensive care unit stay are risk factors for peripheral leucopenia following heart transplantation / Ann Transplant. 2014 Oct 2;19:494-8.
- Wang CY, Xu X, Li MC, Li Q, Ji SG. Analysis of tacrolimus blood concentrations in renal transplant patients / Genet Mol Res. 2015 Apr 22;14(2):3791-7.
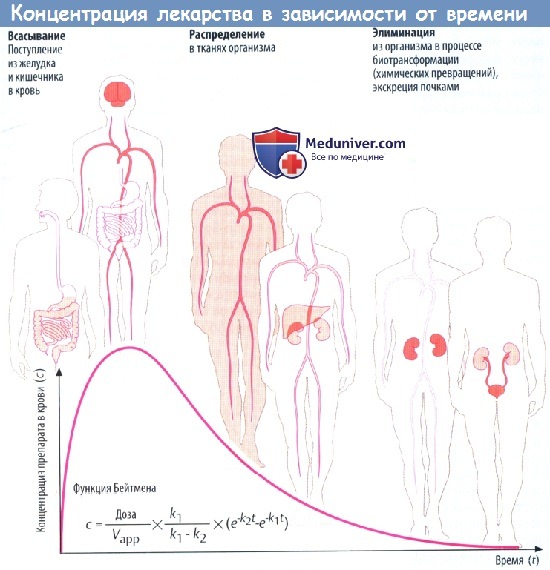
Концентрация лекарства в крови после введения
(А) Лекарственные средства попадают в организм и выводятся из него разными путями. Таким образом, организм представляет собой открытую систему, в которой фактическая концентрация препарата отражает взаимодействие между его поступлением (приемом) и эвакуацией (элиминацией).
Скорость всасывания препарата в желудке и кишечнике зависит от множества факторов: скорости растворения вещества (в случае приема твердой лекарственной формы) и транзита по ЖКТ, проницаемости слизистой для препарата, его градиента концентрации на границе слизистой и крови,кровоснабжения слизистой оболочки.
Всасывание из кишечника приводит к повышению концентрации лекарственного вещества в крови. Препарат разносится с кровью к различным органам (распределение), которые поглощают его в количестве, соответствующем его химическим свойствам и скорости кровотока через орган.
Например, органы с хорошим кровоснабжением, такие как головной мозг, получают большее количество препарата, чем органы с низким кровоснабжением. В результате поглощения тканями происходит снижение концентрации лекарственного вещества в крови. По мере снижения градиента на границе слизистой оболочки и крови всасывание в кишечнике замедляется. Пик концентрации в крови достигается тогда, когда количество вещества, покидающего кровь за единицу времени, равно количеству всосавшегося.
Поступление вещества в ткани печени и почек представляет собой перемещение в органы выведения. Концентрация препарата в крови в различные периоды времени представляет собой совокупность процессов абсорбции, распределения и элиминации, которые пересекаются во времени.
Если распределение происходит значительно быстрее, чем элиминация, снижение концентрации в крови вначале происходит быстро, а затем замедляется. Фаза быстрого снижения обозначается как α-фаза (фаза распределения), медленного — как β-фаза (фаза элиминации). Если препарат распределяется быстрее, чем абсорбируется, концентрацию препарата в крови можно описать математически упрощенной функцией Бейтмена (k1 и k2 — константы скорости для абсорбции и элиминации соответственно).
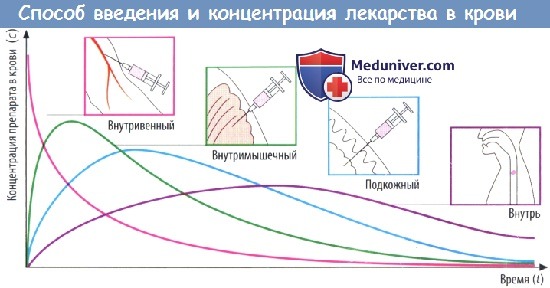
(В) Скорость абсорбции зависит от способа введения препарата. Чем выше скорость абсорбции, тем короче будет время (tmax), которое требуется для достижения пика концентрации в плазме (cmax), тем выше будет cmax и тем раньше уровень препарата в крови снова начнет снижаться.
Площадь под кривой, описывающей зависимость концентрации препарата в крови от времени (AUC), не зависит от пути введения препарата при условии, что доза и биодоступность остаются теми же (закон соответственных состояний). Таким образом, AUC можно использовать для вычисления биодоступности (F) препарата.
Значение AUC, измеренное после приема внутрь и в/в введения определенной дозы конкретного лекарственного вещества, соответствует проценту вещества, попавшего в системный кровоток после приема внутрь: F = AUCприем внутрь/AUCв/в введение.
Определение концентрации препарата в крови позволяет сравнить различные патентованные лекарственные средства, содержащие одно и то же действующее вещество в одинаковой дозе. Идентичные кривые зависимости концентрации в крови от времени для препаратов различных производителей (при условии стандартных лекарственных форм) означают биоэквивалентность стандартного вещества и нового исследуемого препарата.

– Также рекомендуем “Концентрация лекарства в крови при регулярном и нерегулярном приеме”
Оглавление темы “Фармакокинетика лекарств”:
- Механизм выделения лекарств через почки
- Потери лекарства в зависимости от метода поступления – пресистемная элиминация
- Концентрация лекарства в организме в зависимости от времени
- Концентрация лекарства в крови после введения
- Концентрация лекарства в крови при регулярном и нерегулярном приеме
- Механизмы накопления лекарства в организме
- Зависимость эффекта лекарства от дозы
- Зависимость эффекта лекарства от концентрации
- Связывание лекарства с рецептором в зависимости от концентрации
- Типы связывания лекарства с рецептором
[06-236]
Определение фракции трансферрина (CDT) (диагностика злоупотребления алкоголем)
5330 руб.
Углеводдефицитный трансферрин – биомаркер хронического употребления алкоголя (более 60 граммов этанола в сутки).
Синонимы русские
Углеводдефицитный трансферрин (УДТ), карбогидрат-дефицитный трансферрин.
Синонимы английские
Carbohydrate-deficient transferrin (CDT), % CDT.
Метод исследования
Высокоэффективная жидкостная хроматография.
Единицы измерения
% (проценты).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить прием лекарственных препаратов в течение 24 часов перед анализом (по согласованию с врачом).
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Трансферрин – сывороточный белок, главная функция которого – транспорт железа. В крови он присутствует в виде изоформ с различным количеством присоединенных остатков сиаловых кислот (в молекуле трансферрина их может быть до 8). В крови основной формой трансферрина является тетрасиалотрансферрин. При употреблении алкоголя в большом количестве гликозилирование трансферрина нарушается и в крови возрастает концентрация других его изоформ с меньшим количеством остатков сиаловых кислот (асиало-, моно-, дисиалотрансферринов). Их и оценивают как суммарный углевод-дефицитный трансферрин (CDT). Уровень карбогидрат-дефицитного трансферрина значительно возрастает при ежедневном употреблении более 60 граммов этанола (4-5 алкогольных напитков или 0,75 литра вина в день) в течение не менее двух недель. При однократном приеме высоких доз спиртных напитков концентрация углеводно-дефицитного трансферрина в крови не изменяется. Период полувыведения трансферрина составляет 2 недели, поэтому после прекращения употребления алкоголя показатель нормализуется в вышеуказанный срок.
Специфичность CDT для диагностики хронического злоупотребления спиртными напитками составляет 80-90 %, чувствительность – 60-70 %. Исследование, выполненное с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), обладает значительным преимуществом перед иммунологическим методом в плане специфичности и чувствительности. CDT оценивается в относительных единицах ( % от общего трансферрина), поэтому наличие анемии не влияет на результат анализа.
Углеводдефицитный трансферрин – более специфичный показатель для диагностики алкоголизма, чем гамма-глютамилтранспептидаза (ГГТП) и средний объем эритроцита (MCV). Однако отдельное назначение CDT (без дополнительных анализов) в качестве скрининга не рекомендовано в связи с его недостаточной чувствительностью. Необходимо также учитывать, что уровень углевод-дефицитного трансферрина повышается при врождённых нарушениях гликозилирования, галактоземии, беременности и применении гормональных препаратов.
Для чего используется исследование?
- Для диагностики хронического употребления высоких доз алкоголя;
- для оценки эффективности лечения алкоголизма;
- для мониторинга абстиненции в целях выявления рецидивов алкоголизма;
- для дифференциальной диагностики причин изменений функции печени, изменений поведения.
Когда назначается исследование?
- При подозрении на злоупотребление алкоголем;
- при наличии клинических данных и изменений в лабораторных анализах, которые могут быть ассоциированы с употреблением алкоголя (повышение ГГТП, изменение соотношения АЛТ/АСТ, нарушение функции печени, поджелудочной железы, психоневрологические изменения);
- при наблюдении за пациентами с риском рецидива алкоголизма.
Что означают результаты?
Референсные значения
Отсутствие употребления алкоголя в течение 2 недель:
Употребление алкоголя в течение 2 недель: > 2,5 % от общего трансферрина.
Причины повышения CDT:
- злоупотребление алкоголем в дозе более 60 граммов этанола в сутки в течение не менее двух недель;
- врождённые нарушения гликозилирования.
Что может влиять на результат?
- Результаты исследования могут быть искажены при беременности, приеме гормональной заместительной терапии, врождённых нарушениях гликозилирования (например, карбогидрат-дефицитном гликопротеиновом синдроме Iа типа), галактоземии, врождённом нарушении толерантности к фруктозе.
- Исследование более специфично для мужчин, чем для женщин.
- Прием лекарственных препаратов (антидепрессантов, дисульфирамов) не вызывает значительных изменений в результате данного анализа.
Важные замечания
- Уровень CDT снижается до нормы через 2 недели после прекращения употребления алкоголя. Однократные приемы высоких доз алкоголя не вызывают повышения этого показателя.
Также рекомендуется
- Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- Гамма-глютамилтранспептидаза (гамма-ГТ)
- Аланинаминотрансфераза (АЛТ)
- Амилаза общая в сыворотке
- Аспартатаминотрансфераза (АСТ)
- Фосфатаза щелочная общая
- Липидограмма
- Глюкоза в плазме
- Алкогольдегидрогеназа 1B (ADH1B). Выявление мутации A143G (Arg47His)
- Алкогольдегидрогеназа 1C (ADH1C). Выявление мутации A1048G (Ile349Val)
- Определение уровня этилового алкоголя, количественно (кровь, моча)
- Определение наличия суррогатов алкоголя, качественно (кровь, моча)
Кто назначает исследование?
Нарколог, психиатр, невролог, гастроэнтеролог, терапевт, судмедэксперт, токсиколог
Литература
- Fleming MF, Anton RF, Spies CD: A review of genetic, biological, pharmacological, and clinical factors that affect carbohydrate-deficient transferrin levels. Alcohol Clin Exp Res 2004;28(9):1347-1355.
- Golka K, Wiese A. Carbohydrate-deficient transferrin (CDT)–a biomarker for long-term alcohol consumption. J Toxicol Environ Health B Crit Rev. 2004 Jul-Aug;7(4):319-37.
- Tavakoli H.R., Hull M., Okasinski Lt.M. Review of current clinical biomarkers for the detection of alcohol dependence. Innov.Clin.Neurosci. 2011,8,3,26-33.
