Конформационные изменения гемоглобина при оксигенации

Ответ на эти вопросы был получен после того, как выяснилось, что молекула дезоксигемоглобина при связывании кислорода претерпевает конформационные изменення. Первое указание на существование таких изменений относится к тому времени, когда было обнаружено, что кристаллы дезоксигемоглобина, выращенные в бескислородной атмосфере, разрушаются, как только вступают в контакт с кислородом. Это наблюдение наводило на мысль о том, что при связывании кислорода молекулы гемоглобина изменяются в своих размерах и уже не укладываются в кристаллическую решетку дезоксигемоглобина. Это предположение было полностью подтверждено результатами сравнительного рентгеноструктурного анализа, которые показали, что дезоксигемоглобин и оксигемоглобин имеют разные пространственные конформации (рис. 8-10 и 8-18). При оксигенации дезоксигемоглобина третичная структура и -цепей практически не изменяется, поскольку они остаются плотно пригнанными друг к другу и образуют димеры . Однако, как только кислород присоединяется к гемогруппам дезоксигемоглобина, половинки молекулы сохраняя свойственную им жесткую конформацию, изменяют свое положение относительно друг друга и теснее сближаются между собой. Иными словами, оксигенация гемоглобина вызывает изменение его четвертичной структуры, т.е. упаковки субъединиц. В результате молекула оксигемоглобина приобретает несколько более компактную структуру по сравнению с дезоксигемоглобином, и центральная полость уменьшается. Гемы двух Р-цепей сближаются друг с другом, а темы двух -цепей раздвигаются, что и приводит к сигмоидной форме кривой насыщения кислородом. Вследствие этих изменений аминокислотные остатки в и -цепях, связывающие ионы перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщеплепие ионов от протонированных групп; иначе говоря, при оксигенации гемоглобина протонированные группы приобретают свойства более сильных кислот, чем и объясняется эффект Бора. Таким образом, изменение четвертичной структуры гемоглобина в результате его оксигенации находится в прямой связи с существованием обратного соотношения между сродством гемоглобина к кислороду и его сродством к и ионам .
Наконец, еще одну особенность регуляторных свойств гемоглобина выявили Рейнгольд Бенеш и Руфь Бенеш, обнаружившие четвертый лиганд гемоглобина -дифосфоглицерат. Об этой интересной особенности рассказывается в дополнении 8-1.
Рис. 8-18. Схематическое изображение (в виде «стоп-кадров») изменений в четвертичной структуре гемоглобина, обусловленных перемещением пары субъединиц относительно неподвижной пары в процессе освобождения кислорода из оксигемоглобина, переходящего в форму дезоксигемоглобина.
Дополнение 8-1. Дифосфоглицерат и сродство гемоглобина к кислороду
Уже давно известно, что 2,3-дифосфоглицерат (рис. 1) присутствует в эритроцитах в довольно высоких концентрациях, однако функция этого соединения оставалась загадкой до тех пор, пока не было обнаружено, что он оказывает сильное влияние на сродство гемоглобина к кислороду. При добавлении 2,3-дифосфоглицерата (ДФГ) к раствору чистого гемоглобина сродство гемоглобина к кислороду значительно снижается.
Этот эффект обусловлен тем, что ДФГ сам связывается с дезоксигемоглобином. Следовательно, можно написать уравнение еще одной (четвертой по счету) реакции связывания гемоглобина с лигандом:
Таким образом, наблюдается обратная зависимость между двумя процессами – связыванием кислорода и ДФГ (присоединяющихся к разным участкам молекулы гемоглобина).
Рис. 1. А. Структура 2,3-дифосфоглицерата (ДФГ). Красным цветом выделены заряженные группы взаимодействующие с двумя Р-цепями. Б. Расположение молекулы ДФГ (выделена красным цветом) в центральной полости гемоглобина. Отрицательно заряженные группы ДФГ притягиваются к находящимся поблизости положительно заряженным R-группам -цепей (показаны жирными черными линиями).
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. После того как здоровый человек поднимется, скажем, на высоту 4000 м над уровнем моря, в течение первых нескольких часов концентрация ДФГ в его эритроцитах будет возрастать; при этом число молекул ДФГ, связанных с гемоглобином, увеличится, а сродство гемоглобина к кислороду снизится. На большой высоте парциальное давление кислорода значительно ниже, чем на уровне моря. Поэтому и в тканях парциальное давление кислорода снижается. Увеличение содержания ДФГ в эритроцитах при восхождении на большую высоту облегчает освобождение кислорода из гемоглобина в тканях. Изменения противоположного характера наблюдаются у людей, акклиматизировавшихся к условиям высокогорья, например у жителей Гималаев или Андов, когда они спускаются в долины.
Повышение концентрации ДФГ в эритроцитах наблюдается также у людей при гипоксии; это патологическое состояние возникает вследствие недостаточного снабжения тканей кислородом, что может быть обусловлено заболеваниями органов дыхания или нарушениями в системе кровообращения.
С каким участком молекулы гемоглобина связывается ДФГ? В молекуле гемоглобина имеется открытая центральная полость, или канал, который хорошо виден на рис. 8-10. Этот канал, выстланный многими положительно заряженными -группами, и служит местом связывания ДФГ, который присоединяется к дезоксигемоглобину и образует поперечную связь (солевой мостик) между двумя -субъединицами. При связывании гемоглобином кислорода ДФГ вытесняется из полости. Гемоглобин связывает только одну молекулу ДФГ (рис. 1); напомним, что он может связывать по четыре молекулы или и примерно четыре иона Н+.
Рис. 2. Влияние ДФГ на кривую насыщения гемоглобина кислородом.
При обычном выделении гемоглобина из крови он содержит довольно большое количество ДФГ, от которого трудно освободиться полностью. При полном удалении ДФГ из гемоглобина кривая связывания его с кислородом в значительной степени утрачивает свою сигмоидную форму и гемоглобин приобретает намного более высокое сродство к кислороду. После добавления избытка ДФГ к гемоглобину способность последнего к связыванию кислорода понижается (рис. 2). Таким образом, присутствие ДФГ весьма существенно для нормального освобождения кислорода из гемоглобина в тканях. В эритроцитах некоторых птиц содержится не ДФГ, а другое фосфатсодержащее соединение – инозитолгексафосфат, который даже еще более эффективно, чем ДФГ, снижает сродство гемоглобина к кислороду.
Гемоглобин можно рассматривать как молекулярную автоматическую систему управления, которая отзывается на изменение концентрации любого из его четырех лигандов, передает соответствующую информацию, преобразуя ее в конформационные изменения молекулы, и таким путем регулирует свое сродство к другим лигандам.
Рис. 8-19. Симметричная («все или ничего») и последовательная (индуцированное соответствие) модели кооперативного связывания кислорода гемоглобином. В обеих моделях субъединицы могут находиться в двух различных состояниях. Кружками обозначено состояние, в котором субъединицы имеют низкое сродство к кислороду, а квадратами состояние с высоким сродством к кислороду. А. Согласно симметричной модели («все или ничего»), гемоглобин может находиться только в двух формах: в одной из них все субъединицы имеют низкое сродство к кислороду, а в другой высокое. При отсутствии кислорода обе эти формы находятся в равновесии, но форма с низким сродством к кислороду доминирует. Если же кислород присутствует, то он связывается преимущественно с формой гемоглобина, имеющей высокое сродство; при этом равновесие сдвигается вправо и вероятность связывания с гемоглобином оставшегося кислорода увеличивается. В симметричной модели не предусматривается существования промежуточных форм по отношению к формам с низким и высоким сродством к кислороду. Б. В последовательной модели (модели индуцированного соответствия) имеется несколько промежуточных конформаций, последовательно приближающихся к форме с высоким сродством к кислороду. Связывание молекулы кислорода с одной из субъединиц, имеющей низкое сродство к кислороду, индуцирует переход этой субъединицы в форму с высоким сродством. Такой переход в свою очередь повышает вероятность того, что последовательное присоединение кислорода к другим субъединицам будет индуцировать их переход в форму с высоким сродством.
Считается, что связывание кислорода с одной или двумя субъединицами вызывает в них небольшие конформационные изменения, способствующие конформационным перестройкам пустых (не заполненных кислородом) субъединиц, в результате чего изменяется четвертичная структура всей молекулы; при этом ее сродство к кислороду повышается, а сродство к и ионам понижается. Наоборот, при освобождении кислорода четвертичная структура вновь принимает исходную форму, способствующую связыванию и ионов .
Были предложены различные теории для детального объяснения всех структурных изменений гемоглобина, наблюдаемых в процессе его оксигенаиии и дезоксигенации, а также происходящих при этом изменений в его способности к связыванию лигандов (рис. 8-19). Но каковы бы ни были детали всех этих изменений, ясно одно – гемоглобин может служить моделью автоматической регулирующей системы при рассмотрении других олигомерных белков. например ферментов, особенно тех из них, которые обладают как каталитической, так и регуляторной активностью. Многие белки, наделенные такими регуляторными свойствами, состоят из двух или большего числа пригнанных одна к другой полипептидных цепей, образующих характерную четвертичную структуру, способную изменяться при переходе белка из одного активного состояния в другое в процессе его функционирования.
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
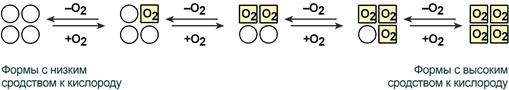
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |


