Конституциональная апластическая анемия фанкони
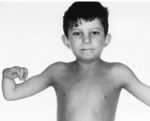

Анемия Фанкони – это генетическое заболевание, которое передается по аутосомно-рецессивному типу и характеризуется нарушением кроветворения, формированием злокачественных новообразований, пороками развития, ломкостью хромосом. Проявляется частыми кровотечениями, кровоподтеками на коже, вялостью, бледностью, склонностью к инфекциям. Диагностика проводится лабораторными методами, назначаются цитогенетическое, молекулярно-генетическое и клиническое исследования крови, миелограмма. Основные способы лечения – пересадка костного мозга, медикаментозное поддержание кроветворения, переливание крови.
Общие сведения
Синонимичные названия анемии Фанкони – врожденная панмиелопатия Фанкони, наследственная панмиелопатия. Заболевание названо по фамилии швейцарского педиатра Гвидо Фанкони, который в 1927 году описал врожденную апластическую патологию на основе симптомов у трех братьев. Анемия Фанкони является редкой генетической болезнью, наследуется согласно аутосомно-рецессивному принципу. Эпидемиологические показатели низкие – 1 больной ребенок на 350 тысяч новорожденных. Распространенность одинакова среди представителей женского и мужского пола, выше в сообществах с разрешенными близкородственными браками, например, у некоторых южноафриканских народов.
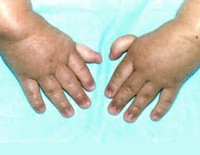
Анемия Фанкони
Причины
Заболевание является наследственным, развивается при передаче дефектного гена от родителей к ребенку. Выявлено 15 генов, мутации которых проявляются анемией Фанкони. Из них 14 расположены в аутосомах и являются рецессивными, 1 тип гена находится в X-хромосоме (сцепленной с полом). Все эти гены отвечают за производство определенного фермента, участвующего в репарации ДНК.
Аутосомно-рецессивное наследование подразумевает, что и отец, и мать должны быть носителями патологической генетической информации. При этом сами они, как правило, здоровы. Вероятность рождения больного ребенка в такой паре составляет 25%. Генетическая панмиелопатия диагностируется у детей и взрослых, получивших от каждого из родителей один и тот же измененный ген. В крайне редких случаях анемия провоцируется передачей дефектной Х-сцепленной хромосомы. Женщины могут быть носительницами мутации, заболевание проявляется только у мальчиков. Риск развития патологии у сына при наличии у матери мутированного гена – 50%.
Патогенез
В норме в клетках организма существуют специальные ферментные системы, которые исправляют разрывы молекул ДНК, поврежденных в процессе биосинтеза или воздействия химических, физических реагентов. При анемии Фанкони обнаруживается генетический дефект в кластере белков, ответственных за репарацию ДНК, что приводит к повышенной ломкости хромосом. В итоге у пациентов развиваются нарушения функций костного мозга – неоплазии и апластическая анемия. Онкологические заболевания чаще всего представлены острым миелоидным лейкозом – злокачественной опухолью миелоидного ростка крови, провоцирующей накопление измененных белых клеток, подавляющих рост эритроцитов, тромбоцитов и нормальных лейкоцитов. При апластической анемии в результате дисплазии костного мозга резко угнетается рост и созревание всех трех видов клеток крови.
Симптомы анемии Фанкони
Более чем у половины пациентов наблюдаются врожденные аномалии развития внутренних органов и скелета. Костные деформации проявляются специфическим внешним видом: больные низкорослые, с уменьшенным размером головы, отсутствием или заметным укорочением большого пальца на руках, недоразвитием лучевой кости, врожденным вывихом бедра и/или наличием шейного ребра, косолапостью, недоразвитым подбородком («птичьим лицом»). Характерна гиперпигментация кожи в виде светлых и коричневатых пятен.
Неврологические расстройства представлены косоглазием, недоразвитием одного или двух глаз, опущением верхнего века, глазным дрожанием, глухотой, умственной отсталостью. Больные зачастую имеют незрелые половые органы, у них отсутствует одно или оба яичка. К распространенным аномалиям строения органов относятся пороки мочевыделительной системы: удвоение мочеточников или лоханки, подковообразные почки, почечные кисты, смещенное наружное отверстие уретры (гипоспадия). Врожденные пороки сердца включают атрезию трехстворчатого клапана, дефект межпредсердной перегородки, митральный стеноз, дефект межжелудочковой перегородки. Пациенты страдают от почечной и сердечной недостаточности.
Ключевые симптомы связаны с постепенным нарастанием нарушений в работе костного мозга. Чаще они дебютируют в детском возрасте (в 5-10 лет). Из-за снижения количества тромбоцитов развивается повышенная кровоточивость: при ранениях кровь долго не сворачивается, легко возникают носовые кровотечения, выделения при менструациях обильны, на теле обнаруживается много «беспричинных» кровоподтеков. Уменьшение числа эритроцитов проявляется анемией с характерной слабостью, быстрой утомляемостью, головокружениями, обмороками, бледностью кожи, учащенным сердцебиением и одышкой. Недостаток лейкоцитов способствует ухудшению сопротивляемости инфекциям. Впоследствии формируется лейкоз, миелодиспластический синдром, онкологические болезни.
Осложнения
Наиболее распространенным осложнением считаются частые инфекционные заболевания. У пациентов развивается ОРВИ, ангина, ринит, бронхит, грипп, тиф, герпес. Рецидивирующий характер болезней и их тяжелое течение приводят к деструкции органов, сопровождаются риском сепсиса. Другим осложнением наследственной анемии являются злокачественные новообразования – лейкемия, эпителиальные опухоли органов шеи и головы, половых органов. Рак у таких больных тяжело поддается лечению из-за повышенной ломкости и сниженной репарации ДНК. Это явление ограничивает применение лучевой терапии, цитотоксических препаратов. Нарушение свертываемости становится причиной больших кровопотерь.
Диагностика
Обследование больных проводят онкологи, гематологи, педиатры, врачи-генетики. Диагностика начинается с анализа анамнестических данных и жалоб. Врач выясняет, имеется ли данное наследственное заболевание у близких родственников, уточняет время появления первых признаков болезни, ранние обращения к врачам. При осмотре оценивает общее состояние пациента, выявляет наличие аномалий развития, гиперпигментированных пятен, кровотечений, кровоподтеков. В большинстве случаев не составляет труда обнаружить типичные деформации костей, недоразвитие глаз. Для подтверждения диагноза и различения анемии Фанкони с приобретенной анапластической анемией проводится ряд лабораторных исследований:
- Клинический анализ крови. Характерны изменения клеточного состава крови. На ранних этапах нарушения кроветворения диагностируется тромбоцитопения и лейкопения, на более поздних – панцитопения (резкое снижение объема эритроцитов, лейкоцитов и тромбоцитов). Возможен умеренный гемолиз без гипербилирубинемии, но с ретикулоцитозом. Значение СОЭ увеличено до 60-80 мм/ч.
- Цитогенетическое исследование клеток. Выполняется проба с диэпоксибутаном, митомицином C, указывающая на частоту и спектр хромосомных аберраций. В пользу генетической анемии рассматриваются показатели ДЭБ-теста более 45%, пограничный уровень – 11-45% (процент клеток с хромосомными разрывами).
- Молекулярно-генетический анализ клеток. Исследуются гены, мутации в которых могут привести к развитию заболевания. В 60-70% случаев мутации обнаруживаются в паре генов FANCA, в 14% – в аллели FANCC, в 10% – в генах FANCG. Частота мутаций в других парах – 0,2-3%.
- Миелограмма. По данным исследования определяется увеличение количества плазматических клеток и макрофагов, фагоцитирующих жиры. Содержание недифференцированных клеток – в пределах нормы. Снижена концентрация клеток миелоцитарного ростка, увеличен показатель лимфоцитов.
Лечение анемии Фанкони
Основная терапия направлена на восстановление процесса кроветворения. Методы лечения подбираются индивидуально, зависят от тяжести заболевания, возраста пациента, наличия и выраженности врожденных аномалий. Дополнительно проводится лечение инфекций и онкопатологий, осуществляются реабилитационные мероприятия. Для устранения анемии используются следующие методы:
- ТКМ. Трансплантация костного мозга является наиболее эффективной в долгосрочной перспективе, но имеет противопоказания, нередко сопровождается развитием осложнений. Оптимальный возраст для проведения операции – до десяти лет. Донорами могут выступать здоровые сестра и братья, подходящие по критериям совместимости. Предварительная интенсивная терапия (кондиционирование) связана с риском токсического воздействия на органы. После трансплантации сохраняется высокая вероятность острого или хронического иммунного конфликта между клетками донора и реципиента.
- Медикаментозная стимуляция кроветворения. При невозможности проведения трансплантации пациентам показано консервативное лечение, временно улучшающее их состояние. Выработка кровяных клеток стимулируется андрогенами (мужскими половыми гормонами) и гематопоэтическими факторами роста – эритропоэтином, фактором стволовых клеток, интерлейкинами-1-12. Параллельно применяются иммунодепрессанты. Медикаментозная терапия способна на протяжении многих лет поддерживать высокое качество жизни больных, но ее эффективность постепенно снижается.
- Переливание компонентов крови. При выраженных побочных эффектах или противопоказаниях к этиотропной терапии (трансплантации, стимуляции кроветворения) назначаются процедуры гемотрансфузии. Переливаются отмытые эритроциты – донорские красные кровяные тельца, освобожденные от поверхностных белков. При кровотечениях и снижении уровня тромбоцитов пациентам вводится тромбоцитарная масса.
Прогноз и профилактика
Продолжительность жизни больных определяется степенью нарушения функции костного мозга. Иногда пациенты доживают до 40 лет без лечения, но нередко умирают в детстве от тяжелой анемии или онкологических заболеваний. Прогноз наиболее благоприятен при своевременном проведении аллогенной трансплантации костного мозга, после которой есть шанс полного восстановления нормального кроветворения и увеличения срока жизни. Поскольку заболевание генетическое, предотвратить его развитие невозможно. Профилактика сводится к медико-генетической консультации супружеских пар из групп риска, планирующих беременность, а также к проведению пренатальной диагностики патологии, в ходе которой из пуповинной вены плода производится забор крови и выполняется ДЭБ-тест. При его положительном результате рассматривается вопрос о прерывании беременности.
Источник
Рубрика МКБ-10: D61.0
МКБ-10 / D50-D89 КЛАСС III Болезни крови, кроветворных органов и отдельные нарушения, вовлекающие иммунный механизм / D60-D64 Апластические и другие анемии / D61 Другие апластические анемии
Определение и общие сведения[править]
Анемия Фанкони
Синонимы: панцитопения Фанкони
Анемия Фанкони — является наследственным нарушением репарации ДНК, характеризуется прогрессирующей панцитопенией с недостаточностью костного мозга, разнообразными врожденными пороками развития и предрасположенность к развитию гематологических или солидных опухолей.
Последние определение несущей частоты дали оценку более чем 1/200, с ожидаемой распространенности при рождении, по крайней мере, 1 / 160,000. В некоторых популяциях, несущая частота значительно выше, из-за мутации-основателей. Более 2000 случаев заболевания сообщались в литературе.
Анемия Фанкони, как правило, аутосомно-рецессивное заболевание, но может произойти и Х-сцепленная передача.
Этиология и патогенез[править]
Анемия Фанкони происходит из-за мутаций в генах, участвующих в репарации ДНК и геномной стабильности. Пятнадцать генов, представляющих 15 комплементационных групп были идентифицированы на сегодняшний день.
Клинические проявления[править]
У 2/3 больных, первые признаки анемии Фанкони – врожденные пороки развития, которые могут затрагивать скелет, кожу, мочеполовую и сердечно-легочную сферу, желудочно-кишечный тракт и центральную нервную систему. Аномалии конечностей могут быть односторонними или двусторонними, причем в последнем случае часто асимметричными. Также могут присутствовать низкий рост и вес, микроцефалия и/или микрофтальм. Нередки пигментация кожи и гипоплазия основания большого пальца (возвышения тенара). Почти 20% пациентов имеют пороки развития уха с или без потери слуха. Врожденные пороки развития могут варьироваться в семье. Если врожденные пороки развития не манифестированы, постановка диагноза может быть отложена до наступления отказа костного мозга (BMF), которое происходит в среднем возрасте до 7 лет. Гематологические нарушения могут возникать в более молодом возрасте, реже у взрослых, при этом 90% пациентов отказ костного мозга развивается в возрасте до 40 лет. У пациентов может развиться острый миелоидный лейкоз, которому часто предшествует миелодиспластический синдром. Пациенты также высоко предрасположены к образованию солидных опухолей головы, шеи и аногенитальной области. Маленький рост часто обусловлен гормональными дефектами. Фертильность полность нарушена у мужчин и сильно нарушается у половине женщин. Беременность часто осложняется.
Конституциональная апластическая анемия: Диагностика[править]
Анемию Фанкони можно заподозрить при панцитопении и характерных фенотипических проявлениях. Прогрессирующая апластическая анемия обычно развивается в возрасте старше 1 года, в среднем — в возрасте 7 лет. Макроцитоз наблюдается еще до возникновения цитопении. При подозрении на анемию Фанкони необходим поиск сопутствующих аномалий развития. Диагноз подтверждают усиленным разрушением хромосом под действием диэпоксибутана, митомицина С или других веществ, повреждающих ДНК. Возможна пренатальная диагностика.
Дифференциальный диагноз[править]
Клинические проявления анемии Фальконе совпадают со многими нарушениями мальформации (Дубовица, Секеля, Холта-Орама, Баллера-Герольда, тромбоцитопения с отсутствуем радиальной кости, синдром неймегеновского повреждения, VACTERL ассоциация, врожденный дискератоз.
Диагностика анемии Фальконе более очевидна когда у пациента развивается отказ костного мозга или злокачественные опухоли. Анемию Фальконе следует рассматривать в дифференциальной диагностике всех молодых пациентов с отказом костного мозга неизвестной этиологии.
Следует также рассмотреть другие синдромы с предрасположенностью к новообразованиям (синдром Блума, Ротмунда-Томсона или синдром Вернера) или синдромы, сопровождающиеся панцитопенией (анемия Блекфана-Даймонда, иммунная панцитопения, синдром Пирсона или синдром Швахмана-Даймонда).
Конституциональная апластическая анемия: Лечение[править]
Поддерживающая терапия включает в себя переливание эритроцитов или очищенных тромбоцитов. Единственным средством для лечения гематологических проявлений является пересадка гемопоэтических стволовых клеток. Тем не менее, этот подход несет тенденцию к увеличению риска солидных опухолей. Симптоматическое лечение включает в себя пероральное введение андрогенов, что улучшает показатели крови у некоторых пациентов, в частности, кол-во эритроцитов. Назначение факторов роста кроветворения может быть рассмотрено после проведения аспирации и биопсии костного мозга, которые должны выполняться регулярно во время лечения.
Прогноз
Отказ костного мозга и злокачественные опухоли ухудшают прогноз, сокращая продолжительность жизни.
Профилактика[править]
Прочее[править]
Анемия Блекфена-Даймонда
Синонимы: синдром Аазе, врожденная аплазия эритроцитов, врожденная эритроцитарная аплазия, врожденная гипоплатическая анемия типа Блекфена-Даймонда
Определение и общие сведения
Анемия Блекфена-Даймонда является врожденной арегенеративной и часто макроцитарной анемией с эритробластопенией.
Ежегодная заболеваемость в Европе по оценкам составляет около 1 / 150,000. Оба пола в равной степени подвержены заболеванию и ни в одной этнической группе не было выявлено предрасположенности к врожденной гипопластической анемии.
Анемия Блекфена-Даймонда наследуется как аутосомно-доминантный признак с переменной пенетрацией.
Этиология и патогенез
В настоящее время, вызывающие болезнь мутации выявляются у 40-45% пациентов. Все вовлеченные в патогенез анемии Блекфена-Даймонда гены кодируют белки рибосом, среди них есть как небольшие субъединицы (RPS7, RPS17, RPS19, RPS24 ), так и крупные (RPL5, RPL11, RPL35a). Мутации в RPS19, RPL5 и RPL11 наблюдаются у 25%, 9% и 6,5% пациентов соответственно, в то время как другие гены, отвественны за 1-3% случаев. Единственная очевидная корреляция генотип/фенотип – частые краниофациальные аномалии у носителей мутации RPL5 и RPL11 и наоборот эти аномалии редки у носителей мутации RPS19.
Клинические проявления
Анемия Блекфена-Даймонда обнаруживается в раннем возрасте, как правило, в течение первых 2-х лет жизни, возникновение анемии после 4-х лет очень маловероятно. Первые признаки заболевания – бледность и одышка, особенно во время кормления или во время сосания. Бледность, без органомегалии – признака, указывающего на гемолиз или вовлечением других гемопоэтических клеточных линий. Более половины всех пациентов демонстрируют низкий рост и врожденные аномалии, наиболее часто черепно-лицевые (синдром Пьера-Робина и расщепление нёба), большого пальца и урогенитального тракта. Беременность у женщин-носителей признака несет высокий риск, как для матери, так и для ребенка. Пациенты с анемией Блекфена-Даймонда также имеют более высокий риск лейкемии и новообразований.
Диагностика
У ребенка с анемией и эритробластопенией диагноз может быть поддержан семейной историей (10-20% случаев), сопутствующими пороками развития (40% случаев), а также повышенным уровнем эритроцитарной аденозиндезаминазой, который является частым, но неспецифическим признаком, поскольку также может быть повышена у родственников при отсутствии других симптомов заболевания. Обнаружение болезнетворной мутации имеет диагностическое значение.
Генетическое консультирование и пренатальная диагностика затруднена из-за изменчивости клинических проявлений и того факт, что только 40-45% пациентов имеют мутации в пределах гена RP. В семейных случаях, риск рецидива составляет 50%. Проводить ультразвуковое наблюдение во время беременности рекомендуется во всех случаях.
Дифференциальный диагноз
Дифференциальный диагноз должен включать в себя транзиторную эритробластопению, хронические инфекции парвовируса В19 и другие врожденные анемии.
Лечение
Регулярные переливания крови и долгосрочная терапия кортикостероидами. Лечение должно быть адаптировано к каждому случаю и в зависимости от возраста пациента. Стероиды не следует вводить в течение первого года жизни. Низкий рост, как в рамках синдрома так и из-за связанных с лечением осложнений (стероиды, гемохроматоз), является серьезной проблемой для таких пациентов. Аллогенная трансплантация костного мозга должны быть рассмотрена при резистентности к кортикостероидам, если доступен здоровый и HLA-идентичный сиб.
Прогноз
Прогноз, как правило, хороший. Тем не менее, осложнения лечения и более высокий уровень заболеваемости раком может привести к снижению продолжительности жизни. Тяжесть заболевания зависит от качества и реакции на лечение. Для пациентов, проходящих регулярные переливания, качество жизни явно не страдает.
Синдром Швахмана-Даймонда
Синонимы: недостаточность поджелудочной железы и дисфункция костного мозга, синдром Швахмана, синдром Швахмана-Бодиана-Даймонда
Определение и общие сведения
Синдром Швахмана-Даймонда является редким мультисистемным синдромом, который характеризуется хронической и обычно легкой нейтропенией, экзокринной недостаточностью поджелудочной железы со стеатореей, скелетной дисплазией с низким ростом и повышенным риском развития аплазии костного мозга или лейкозной трансформации.
Во всем мире распространенность оценивается примерно 1/350000 и распространенности при рождении на уровне около 1 / 200.000 живорожденных. Передача аутосомно-рецессивная.
Этиология и патогенез
Синдром Швахмана-Даймонда в 95% случаев вызывается мутаций гена SBDS (7q11.22), кодирующим белок рибосом, участвующий в биогенезе рибосом и других клеточных процессах.
Клинические проявления
Синдром Швахмана-Даймонда имеет переменную клиническую картину, даже внутри одной семьи. Как правило, он проявляется в младенчестве или раннем детстве. Наиболее распространенный симптом – интерметтирующая умеренная нейтропения, сопровождаемая развитием рецидивирующих инфекций. Умеренная анемия и тромбоцитопения также могут наблюдаться у пациентов. Экзокринная недостаточность панкреатической железы приводит к снижению прибавки массы тела, замедлении роста и хронической стеаторее. Участие со строны костной ткани характеризуется замедленным созреванием костей, дисплазией метафизов, впалой грудной клеткой и генерализованной остеопенией. Другие симптомы включают в себя экзему или ихтиоз кожи, аномалии зубнов и психомоторную заторможенность. Умеренный или тяжелый интеллектуальный дефицит (50% пациентов) вызывает трудности в обучении. Гематологические проявления могут быть осложнены аплазией костного мозга, острым миелолейкозом и миелодиспластическим синдромом. В неонатальном периоде патология обычно не наблюдается, но в некоторых случаях сообщалось о панцитопении, респираторным дистрессе и тяжелой спондилометафизарной дисплазии.
Диагностика
Диагноз основывается на клинических, лабораторных и рентгенологических исследованиях. Анализ крови демонстрирует наличие нейтропении (абсолютное количество нейтрофилов <1500 / мл), которая может сопровождаться от легкой до умеренной тромбоцитопенией, умеренной анемией и повышением фетального гемоглобина. Экзокринная недостаточность поджелудочной железы проявляется низкими уровнями поджелудочной изоамилазы и/или трипсиногена, низким уровнем фекальной эластазы в анализе кала, жировой дистрофией на МРТ (МРТ картина может быть нормальной до возраста 5 лет). Рентгенография позволяет обнаружить, как правило в возрасте после 5 лет, – аномалии метафизов и пластин роста. Мазок костного мозга выявляют различную степень с дисгранулопоэза или дисэритропоэза. Диагноз подтверждается с помощью генетического тестирования.
Дифференциальный диагноз
Дифференциальный диагноз включает муковисцидоз, синдром Пирсона, анемию Фанкони, синдром Йохансона-Близзарда, анемию Блекфана-Даймонда, целиакию и аутосомно-рецессивную тяжелую врожденную нейтропению вследствие дефицита G6PC3.
Лечение
Недостаточность поджелудочной железы требует назначения панкреатических ферментов и адаптированной диеты. Антибиотикопрофилактика терапия может быть достаточной, чтобы избежать инфекций; в противном случае, может быть предложен гранулоцитов колониестимулирующий фактор. Тяжелые гематологические осложнения требуют трансплантации гемопоэтических стволовых клеток. Хирургическое вмешательство может быть предложено для скелетных аномалий. Пациенты с трудностями в обучении требуют специальной образовательной поддержки.
Прогноз
Прогноз является переменным. Опасная для жизни осложнения включают аплазию костного мозга и лейкозную трансформацию, а иногда и вирусные инфекции. Около 1/3 пациентов имеют данные осложнение, некоторые из них могут быть успешно купированы трансплантацией костного мозга.
Врожденная амегакариоцитарная тромбоцитопения
Синонимы: врожденная амегакариоцитарная тромбоцитопеническая пурпура
Определение и общие сведения
Врожденная амегакариоцитарная тромбоцитопения является редким наследственным синдромом недостаточности костного мозга, характеризуется изолированным тяжелым уменьшением количества тромбоцитов и мегакариоцитов в первые годы жизни ребенка, которое позже развивается в недостаточность костного мозга с панцитопенией.
Точная распространенность неизвестна, менее чем 100 случаев описано в литературе. Кроме того, заболеваемость может быть недооценена из-за трудной диагностики заболевания. Наследование аутосомно-рецессивное.
Этиология и патогенез
Врожденная амегакариоцитарная тромбоцитопения происходит из-за мутаций в гене MPL (1p34), кодирующем рецептор (с-MPL) тромбопоэтина, экспрессирущий в плюрипотентных гемопоэтических стволовых клетках и в мегакариоцитах. Различные типы мутаций связаны с различными фенотипами патологии. Нонсенс-мутации приводят к полной потере функции рецептора тромбопоэтина – I тип, миссенс мутации ведут к остаточной функции рецептора – тип II. Случаи, без каких-либо дефектов в гене MPL рассматриваются как тип III.
Делеции 21q22 приводят к RUNX1 гаплонедостаточности – развивается вариант амегакариоцитарной тромбоцитопении с различными аномалиями: задержка роста, дефицит слуха, грыжи и трудности кормления.
Клинические проявления
Врожденная амегакариоцитарная тромбоцитопения проявляется с рождения, часто в первый день или, по крайней мере, в течение первого месяца жизни петехиями, пурпурой, желудочно-кишечными или внутричерепными кровоизлияниями, кровоизлияними в легких вследствие наличия изолированной тромбоцитопении и почти полным отсутствием мегакариоцитов в костном мозге. Тип I является тяжелой формой заболевания и характеризуется постоянно низким количеством тромбоцитов и раннем прогрессированием (как правило, в возрасте до 2-х лет) аплазии костного мозга, сопровождаемой панцитопенией. Тип II является более мягкой формой, которая проявляется транзиторным увеличением количества тромбоцитов, более 50×109/л, в течение первого года жизни или позже в возрасте 3-6 лет и не сопровождается развитием панцитопении.
Есть сообщения о случаях сопутствующих дефектов межпредсердной и межжелудочковой перегородок, гипоплазии головного мозга и мозжечка, а также замедления психомоторного развития.
Диагностика
Диагноз основывается на клинических признаках, тромбоцитопении (количество тромбоцитов ниже 50×109/л) с нормальным средним объемом тромбоцитов, значательном повышении уровня тромбопоэтина в сыворотке и отсутствии или малом количестве мегакариоцитов в аспирате костного мозга. Генетическое тестирование может подтвердить диагноз.
Дифференциальный диагноз
Дифференциальный диагноз проводят с идиопатической тромбоцитопенической пурпурой, на поздней стадии с апластической анемией, а также с анемией Фанкони, тромбоцитопенией с отсутствием лучевой кости и синдромом Вискота-Олдрича.
Лечение
Лечение поддерживающее, показаны переливания тромбоцитов. Трансплантация кроветворных стволовых клеток является единственной эффективной лечебной стратегией.
Прогноз
Прогноз неблагоприятный, трилинейная аплазия костного мозга происходит в течение первых лет жизни.
WT конечностно-кровяной синдром
Характеризуется гематологическими аномалиями (анемия Фанкони, лейкоз и лимфомы), которые часто обнаруживаются в детстве. Также присутствуют аномалии развития конечностей и кистей рук: расщепление или гипоплазия большого пальца, кожная синдактилия, дефекты локтевой и лучевой костей. Синдром был описан в нескольких семьях. Передача аутосомно-доминантная.
Синдром атаксии с панцитопенией
Синонимы: атаксия-панцитопения синдром, миелоцеребеллярный синдром
Синдром атаксии с панцитопенией характеризуется мозжечковой атаксией, различной гематологической цитопенией и предрасположенностью к недостаточности костного мозга и миелоидному лейкозу, иногда связан с моносомией 7 пары.
Вызвается миссенс мутацией гена SAMD9L. Наследование аутосомно-доминантное.
Источники (ссылки)[править]
https://www.orpha.net
Am J Hum Genet. 2016 Jun 2; 98(6): 1146–1158.
Дополнительная литература (рекомендуемая)[править]
Действующие вещества[править]
- Гидрокортизон
- Дексаметазон
- Метилпреднизолон
- Преднизолон
Источник
