Кооперативный эффект как основа функционирования гемоглобина

ЧАСТЬ I. КОНФОРМАЦИЯ И ДИНАМИКА
ГЛАВА 4. ГЕМОГЛОБИН: АЛЛОСТЕРИЧЕСКИЙ БЕЛОК
4.2. Кооперативность связывания кислорода гемоглобином
Отношение занятых кислородом участков связывания к их общему числу представляет собой степень насыщения, или просто насыщение гемоглобина кислородом, и обозначается У. Значение У изменяется от 0 (все участки свободны) до 1 (все участки заняты). График зависимости У от парциального давления кислорода рO2 называется кривой диссоциации кислорода. Кривые диссоциации кислорода для гемоглобина и миоглобина различаются в двух отношениях (рис. 4.2 и 4.3). Во-первых, при любом рO2 для миоглобина насыщение У выше, чем для гемоглобина. Другими словами, миоглобин обладает более высоким сродством к O2, чем гемоглобин. Сродство к кислороду характеризуют величиной Р50, численно равной парциальному давлению кислорода, при котором насыщены 50% участков связывания (т.е. У= 0,5). Для миоглобина Р50 составляет обычно 1 торр, а для гемоглобина-26 торр.
Рис. 4.2. Диссоциационная кривая кислорода для миоглобина и гемоглобина. Насыщенность участков, связывающих кислород, показана как функция парциального давления кислорода в окружающем растворе

Рис. 4.3. Кривая диссоциации кислорода для гемоглобина. На оси абсцисс отмечены значения pO2, характерные для капилляров работающей мышцы и для альвеол легких. Обратите внимание, что Р50 для гемоглобина в физиологических условиях лежит между этими величинами

Торр-единица давления, численно равная тому давлению, которое производит столбик ртути высотой 1 мм при 0°С и стандартном ускорении силы тяжести (1 мм Hg). Названа в честь Эванджелисты Торричелли (1608-1647), изобретателя ртутного барометра.
Второе различие состоит в том, что кривая диссоциации кислорода в случае миоглобина имеет гиперболическую форму, а в случае гемоглобина-сигмоидную. Как будет указано ниже, сигмоидная форма кривой идеально соответствует физиологической роли гемоглобина как переносчика кислорода в крови. На молекулярном уровне сигмоидность формы означает, что связывание кислорода гемоглобином происходит кооперативно, т. е. присоединение кислорода к одному гему облегчает его присоединение к остальным.
Рассмотрим кривые диссоциации кислорода с количественной стороны, начав с миоглобина как более простого. Связывание кислорода с миоглобином (МЬ) описы-
вается следующим уравнением:
МbO2 ⇄Мb + O2. (1)
Константа равновесия процесса диссоциации оксимиоглобина составит
![]()
где [МbO2]- концентрация оксимиоглобина, [Мb]-концентрация дезоксимиоглобина, [O2]- концентрация свободного кислорода, причем все эти величины выражены в молях на литр. Степень насыщения У определяется как
![]()
Производя замещения в уравнении (3) на основе равенства (2), получаем
![]()
Поскольку O2 – это газ, удобнее выражать его концентрацию в виде рO2, т.е. парциального давления кислорода (в торрах) в окружающей раствор атмосфере. Тогда уравнение (4) принимает следующий вид:
![]()
Уравнение (5) графически выражается гиперболой. В самом деле, кривая диссоциации кислорода, рассчитанная по уравнению (5) при Р50, равном 1 торр, хорошо соответствует экспериментальной кривой, полученной для миоглобина.
В отличие от этого для гемоглобина кривая диссоциации кислорода имеет сигмоидную форму и не совпадает ни с одной кривой, описываемой уравнением (5). Это свидетельствует о кооперативном связывании О2 молекулой гемоглобина. Рассмотрим крайний случай, когда имеются только дезоксигемоглобин и гемоглобин (Нb), содержащий 4 связанные молекулы O2:
Нb(O2)4 ⇄ Нb + 4O2. (6)
Константа равновесия этой гипотетической реакции составит
![]() (7)
(7)
и далее
![]() (8)
(8)
Графически уравнение (8) выражается сигмоидной кривой (рис. 4.4). Заметим, однако, что расчетная кривая идет круче, чем кривая, полученная экспериментально. Другими словами, схема процесса, описанная уравнением (6), является крайностью.
Рис. 4.4. Кривая насыщения гемоглобина кислородом лежит между диссоциационными кривыми, рассчитанными для n — 1 (некооперативное связывание) и n = 4 (полностью кооперативное связывание)

Как же тогда охарактеризовать процесс связывания с промежуточной степенью кооперативности? В 1913 г. Арчибальд Хилл показал, что кривая, построенная по данным определения связывания кислорода гемоглобином, описывается уравнением, соответствующим гипотетическому процессу:
Нb(O2) n ⇄ Нb + nO2. (9)
Насыщение У в этом случае составит
![]() (10)
(10)
После преобразований получим
![]() (11)
(11)
Последнее уравнение показывает, что отношение оксигема (У) к дезоксигему (1 — У) равно возведенному в n-ю степень отношению рO2 к Р50. Прологарифмируем это уравнение:
![]() (12)
(12)
Подчеркнем, что зависимость Ig [У/(1— — У)] от Ig pO2 выразится прямой с углом наклона n. Такой график называется графиком Хилла, а величина наклона n в точке полунасыщения кислородом (У=0,5) составляет коэффициент Хилла.
Миоглобин дает линейный график Хилла с n = 1, 0, тогда как гемоглобин-с n = 2,8 (рис. 4.5). Наклон, равный 1,0, означает, что молекулы кислорода присоединяются к миоглобину независимо друг от друга, как это описано в уравнении (1). С другой стороны, коэффициент Хилла, равный 2,8, указывает на кооперативное связывание кислорода гемоглобином. Присоединение O2 к одному гему облегчает присоединение кислорода к другим гемам того же тетрамера, и обратно: отщепление кислорода от одного гема облегчает его отщепление от остальных. Другими словами, в молекуле гемоглобина имеется взаимосвязь между гемами. Кооперативность связывания кислорода гемоглобином называют иногда взаимодействием гем—гем. Механизм его мы обсудим ниже.
Рис. 4.5. График Хилла для связывания кислорода миоглобином и гемоглобином. Наклон 2,8 для гемоглобина свидетельствует о кооперативном связывании кислорода; миоглобин, напротив, связывает кислород некооперативно, о чем свидетельствует наклон кривой, равный 1,0

Источник
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Источник
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
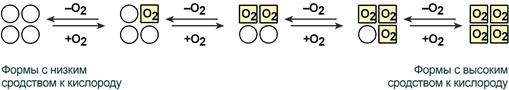
Схема кооперативного взаимодействия субъединиц гемоглобина
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.

Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород “вытесняет” ион водорода из связи с остатком гистидина гемоглобиновой молекулы.

Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.

Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.

Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
Источник
Министерства
здравоохранения и социального развития
РФ
«Волгоградский
государственный медицинский университет»
Кафедра
теоретической
биохимии с курсом клинической биохимии
Выполнил
студент 7 гр.
1
курса лечебного факультета
Кондратьева
Екатерина Андреевна
Преподаватель
ассистент
кафедры
Агеева
Елизавета Михайловна
Волгоград
2013
год.
Оглавление
:
Введение
Кооперативность —
это явление в биохимии, характерное
для ферментов или рецепторов,
которые имеют множественные сайты
связывания. Также явление кооперативности
отмечено для больших молекул, имеющих
многие идентичные субъединицы
(ДНК, белки, фосфолипиды),
в момент, когда происходят фазовые
переходы —плавление,
разворачивание, расплетание.
Олигомерные
белки проявляют свойства, отсутствующие
у мономерных белков. Влияние четвертичной
структуры на функциональные свойства
белка можно рассмотреть, сравнивая
строение и функции двух родственных
гемсодержащих белков: миоглобина и
гемоглобина. Оба белка имеют общее
эволюционное происхождение, сходную
конформацию отдельных полипептидных
цепей и сходную функцию (участвуют в
транспорте кислорода), но миоглобин –
мономерный белок, а гемоглобин – тетрамер.
Наличие четвертичной структуры у
гемоглобина придаёт этому белку свойства,
отсутствующие у миоглобина.
А.
Структура и функции миоглобина
Миоглобин
относят к классу гемсодержащих белков,
т.е. он содержит простетическую группу
– гем, довольно прочно связанную с
белковой частью. Миоглобин относят к
глобулярным белкам; он имеет только
одну полипептидную цепь.
1. Клеточная локализация и функция
Миоглобин
содержится в красных мышцах и участвует
в запасании кислорода. В условиях
интенсивной мышечной работы, когда
парциальное давление кислорода в ткани
падает, О2 освобождается
из комплекса с миоглобином и используется
в митохондриях клеток для получения
необходимой для работы мышц энергии.
2. Строение миоглобина
Миоглобин
содержит небелковую часть (гем) и белковую
часть (апомиоглобин).
Гем –
молекула, имеющая структуру циклического
тетрапиррола, где 4 пиррольных кольца
соединены метиленовыми мостиками и
содержат 4 метальные, 2 винильные и 2
пропионатные боковые цепи. Эта
органическая часть тема называется
протопорфирином. Возможны 15 вариантов
расположения боковых цепей, но в составе
гемопротеинов присутствует только
один изомер, называемый протопорфирин
IX. В теме 4 атома азота пиррольных колец
протопорфирина IX связаны четырьмя
координационными связями с Fe2+,
находящимся в центре молекулы (рис.
1-29).Апомиоглобин –
белковая часть миоглобина; первичная
структура представлена последовательностью
из 153 аминокислот, которые во вторичной
структуре уложены в 8 ?-спиралей. ?-Спирали
обозначают латинскими буквами от А до
Н, начиная с N-конца полипептидной цепи,
и содержат от 7 до 23 аминокислот. Для
обозначения индивидуальных аминокислот
в первичной структуре апомиоглобина
используют либо написание их порядкового
номера от N-конца (например, Гис64,
Фен138),
либо букву ?-спирали и порядковый номер
данной аминокислоты в этой спирали,
начиная с N-конца (например, Гис F8).Третичная
структура имеет вид компактной глобулы
(внутри практически нет свободного
места), образованной за счёт петель и
поворотов в области неспирализованных
участков белка. Внутренняя часть
молекулы почти целиком состоит из
гидрофобных радикалов, за исключением
двух остатков Гис, располагающихся в
активном центре.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник


