Кортизол в крови норма у собак
Кортизол является основным стероидным гормоном, секретируемым корой надпочечников. Большая часть кортизола находится в крови в связанном состоянии с белками плазмы, и только 10% от общего уровня циркулирующего кортизола находятся в свободной, метаболически активной форме. Этот гормон влияет на метаболизм углеводов, белков и липидов, стимулирует глюконеогенез и вызывает периферическую инсулинорезистентность, подавляя транспорт глюкозы в клетки.
Кортизол также имеет противовоспалительный эффект отчасти в результате воздействия на лейкоциты в крови. Нейтропения, умеренный лимфоцитоз и эозинофилия являются характерными изменениями при недостаточности кортизола. Также понижению уровня кортизола могут сопутствовать нерегенеративная анемия и снижение гематокрита, которые возникают в результате отсутствия стимулирующего влияния стероидных гормонов на костный мозг. В противоположность этому избыток эндогенных или экзогенных глюкокортикоидов может вызвать лейкоцитоз у собак и кошек.
Лейкограмма («стрессовая лейкограмма») характеризуется нейтрофилией с преобладанием зрелых (сегментоядерных) форм, лимфопенией и эозинопенией. У собак возможно выявление моноцитоза, который, как правило, не обнаруживается у кошек.
Нейтрофилия со сдвигом вправо обусловлена несколькими факторами, такими как повышенное высвобождение нейтрофилов из костного мозга, перемещение нейтрофилов из маргинального пула в циркулирующее русло и замедление прохождения нейтрофилов из крови в ткани.
Лимфопения является результатом перераспределения циркулирующих лимфоцитов. К тому же высокие дозы глюкокортикоидов могут приводить к лизису лимфоцитов. Эозинопения вызвана ингибированием высвобождения эозинофилов из костного мозга и секвестрацией эозинофилов в тканях. У собак избыток глюкокортикоидов может спровоцировать тромбоцитоз.
Глюкокортикоиды участвуют в нормальном функционировании и поддержании целостности желудочно-кишечного тракта. Избыток глюкокортикоидов вызывает замедление роста и обновления клеток слизистой оболочки желудка и сокращение секреции слизи, что приводит к нарушению барьерной функции слизистой оболочки желудка. Терапия глюкокортикоидами может привести к возникновению желудочно-кишечных кровотечений, образованию язв и перфорации толстого кишечника.
Действие глюкокортикоидов на центральную нервную систему (ЦНС) заключается в поддержании адекватных концентраций глюкозы в крови, что необходимо для нормального функционирования мозга, поддержания мозгового кровотока и электролитного баланса в ЦНС. Глюкокортикоиды уменьшают образование спинномозговой жидкости, участвуют в регуляции возбуждения нейронов и, возможно, обладают нейропротекторным действием.
Кортизол и некоторые синтетические глюкокортикоиды обладают минералокортикоидной активностью. В зависимости от концентрации или дозы они вызывают задержку натрия и потерю калия через почки.
Глюкокортикоиды обладают положительным инотропным и хронотропным действием на сердце. Поскольку глюкокортикоиды повышают чувствительность рецепторов к катехоламинам, то тем самым они способствуют поддержанию нормального сосудистого тонуса. Глюкокортикоиды снижают проницаемость капилляров за счет ингибирования активности кининов и бактериальных эндотоксинов, а также за счет уменьшения количества гистамина, высвобождаемого базофилами. Длительное воздействие стресса может вызвать рефрактерный шок у особей с дефицитом глюкокортикоидов.
Избыток глюкокортикоидов может привести к развитию гипертензии путем активации различных механизмов, таких как повышение минералокортикоидной активности, активации ренин-ангиотензин-альдостероновой системы (РААС), простациклина и калликреин-кининовой системы и др. Точные механизмы этих процессов у собак и кошек пока не установлены. Глюкокортикоиды способствуют увеличению числа и аффинности бета-2 рецепторов, тем самым способствуя бронходилатации.
Регуляция синтеза кортизола осуществляется через гипоталамо-гипофизарную системупо принципу отрицательной обратной связи. Кортизол выделяется в ответ на действие адренокортикотропного гормона (АКТГ), образующегося в передней доле гипофиза. Выработка АКТГ находится под контролем пептидного кортикотропин-рилизинг гормона гипоталамуса. Возрастание уровня кортизола в крови ингибирует в гипоталамусе секрецию кортикотропин-рилизинг гормона, в результате чего снижаются выработка и выделение АКТГ из гипофиза и секреция кортизола надпочечниками.
Повышение уровня кортизола в крови (как эндогенного, так и экзогенного) способствует чрезмерному отложению гликогена в печении (у собак) и росту активности печеночных ферментов. При длительном сохранении высокого уровня кортизола в крови, вызванного стрессом, у животных может возрастать активность щелочной фосфатазы. В результате пульсирующего характера выделения кортизола животные с гиперадренокортицизмом и гипоадренокортицизмом часто имеют уровни кортизола, которые не выходят за пределы референсных значений. Кроме того, базальный уровень кортизола может повышаться в результате стресса, вызванного транспортировкой, госпитализацией, врачебными манипуляциями или развитием тяжелых острых или хронических заболеваний.
Основным заболеванием клубочковой зоны коры надпочечников является гиперадренокортицизм, или болезнь Иценко-Кушинга. Это расстройство, как правило, является вторичным по отношению к развитию аденомы гипофиза, при которой отмечается избыточная секреция АКТГ.
Гиперадренокортицизм также может быть вызван опухолью коры надпочечников, которая автономно производит глюкокортикоиды, или ятрогенным путемв результате введения глюкокортикоидов. Независимо от причины, все клинические признаки и изменения лабораторных показателей при гиперадренокортицизме обусловлены повышением кортизола в сыворотке крови.
У собак, кошек и лошадей сетчатая зона коры надпочечников, синтезирующая глюкокортикоиды и половые гормоны, играет незначительную роль в развитии гиперадренокортицизма. У хорьков эта зона имеет большое значение, поскольку большинство клинических нарушений обусловлены увеличением уровня половых стероидов.
Первичный гипоадренокортицизм связан с двусторонними повреждением надпочечников и составляет большинство (более 95%) случаев гипоадренокортицизма у собак. Требуется потеря более 90% функции коры надпочечников, прежде чем разовьются клинические признаки глюкокортикоидной и минералокортикоидной недостаточности, поэтому клиническое проявление гипоадренокортицизма происходит только в случае двустороннего нарушения функции коры надпочечников.
Вторичный гипоадренокортицизм возникает в результате пониженной секреции АКТГ из гипофиза и является менее распространенной причиной недостаточности надпочечников. Снижение уровня АКТГ вызывает атрофию коры надпочечников (не затрагивающую сетчатую зону надпочечников) и нарушение секреции глюкокортикоидов, не влияющей на синтез минералокортикоидов.
Определение базальной концентрации кортизола в крови дает ограниченную информацию о функции коры надпочечников. Однако определение уровня кортизола полезно в ряде стимулирующих или подавляющих тестов, которые предоставляют более полную информацию о функции коры надпочечников в случаях предполагаемого развития гиперадренокортицизма или гипоадренокортицизма.
ПРЕАНАЛИТИКА
Перед проведением исследования животные должны находиться на голодной диете не менее 12 часов. Стабильность кортизола в сыворотке крови составляет пять дней при температуре хранения +2ºС…+8ºС, два месяца при температуре хранения -17ºС…-23ºС (при условии соблюдения преаналитических требований по взятию биоматериала на гормональные исследования).
ИНТЕРПРЕТАЦИЯ
Результаты исследования содержат информацию исключительно для врачей. Диагноз ставится на основании комплексной оценки различных показателей и дополнительных сведений.
Единицы измерения: нмоль/л.
Пересчет единиц изменения: мкг/дл х 27,6 (нмоль/л).
Референсные значения:
Собаки: 28-170,0 нмоль/л.
Кошки: 28-140,0 нмоль/л.
При подозрении на гиперадренокортицизм и для постановки окончательного диагноза требуется проведение функциональных тестов (АКТГ-стимулирующего или подавляющих тестов с дексаметазоном).
У собак с гиперадренокортицизмом базальный уровень кортизола зачастую находятся в пределах референсных значений. На уровень кортизола оказывает влияние стресс и сопутствующие заболевания, напрямую не связанные с заболеваниями гипоталамо-гипофизарно-надпочечниковой системы.
У собак при подозрении на развитие гипоадренокортицизма значение кортизола менее 28 нмоль/л будет подтверждать диагноз, если присутствуют клинические признаки заболевания. При этом значение кортизола более 140 нмоль/л исключает диагноз. При промежуточных значениях кортизола (от 28 нмоль/л до 140 нмоль/л) диагноз гипоадренокортицизм не является окончательным.
Повышение уровня:
- Гиперадренокортицизм
- Стресс
- Тяжелые заболевания, не связанные непосредственно с патологией коры надпочечников
- Повышение эстрогенов в крови (эструс)
- Нарушение преаналитики
Прием лекарственных препаратов (преднизолона или других стероидных гормонов)
Понижение уровня:
- Гипоадренокортицизм (в том числе ятрогенный)
- Действие гестагенов
- Нарушение преаналитики
Диагностика эндокринных болезней является трудным и ответственным процессом, требующим осторожного подхода. Во избежание ошибок врачу необходимо собрать как можно больше данных, подтверждающих или опровергающих предполагаемый диагноз животного.
Глюкокортикоиды участвуют В регуляции углеводного, липидного белкового обменов. Важнейшим из них является кортизол, который в первую очередь способствует повышению содержания глюкозы в крови. Его действие основано на способности активировать глюконеогенез в печени и снижать потребность периферических тканей (в основном жировой и лимфоидной) в глюкозе. Биологический смысл такого воздействия заключается в обогащении крови глюкозой при стрессах, низком содержании углеводов в рационе, голодании, поскольку запасы гликогена в печени могут лишь кратковременно обеспечивать ее высвобождение.
Кортизол стимулирует синтез белка в печени. Вместе с тем он тормозит синтез и ускоряет распад белка в мышечной, жировой и лимфоидной тканях, в коже и фибробластах, что приводит к высвобождению аминокислот — базовых в глюконеогенезе соединений. Кроме того, глюкокортикоиды снижают аффинность рецепторов инсулина, подавляют его секрецию. Они стимулируют липолиз, что объясняется понижением ими поглощения и утилизации глюкозы на периферии, однако в некоторых тканях они, наоборот, усиливают липогенез. Это обусловлено различной чувствительностью рецепторного аппарата в разных клетках. В целом их эффекты связаны не только с регуляцией различных видов обмена веществ, но и с контролем пролиферативных процессов и активности иммунной системы. Так, под влиянием глюко-кортикоидов тормозится высвобождение цитокинов (интерлейкинов-1 и -2 и у-интерферона) из лимфоцитов и макрофагов, а также угнетается высвобождение эозинофилами медиаторов воспаления и метаболизм арахидоновой кислоты.
Глюкокортикоиды обладают иммунодепрессивной активностью — это суммарный результат подавления иммуногенеза на разных этапах, а именно миграции стволовых клеток и В-лимфоцитов. Некоторые цитокины, в частности интерлейки-ны -1 и -6, играют роль модуляторов и в иммунной, и в эндокринной системах. ИЛ оказывают потенцирующее воздействие на выработку кортикотропин-рилизинг-гормона (КРГ) и, соответственно, на секрецию кортизола. Очевидно, такое взаимодействие представляет собой тонко настроенный механизм, служащий для осуществления адекватной защитно-приспособительной реакции организма в ответ на любое антигомеостатическое воздействие.
Нарушение синтеза кортикоидов как в сторону увеличения, так и снижения, несомненно, оказывает неблагоприятное влияние на обменные процессы и осуществление иммуноопосредованных реакций. Эти гормоны увеличивают скорость клубочковой фильтрации и уменьшают реабсорбцию воды, повышая диурез. Их продукция регулируется гипоталамо-гипофизарной системой. В гипоталамусе вырабатывается кортиколиберин, контролирующий секрецию АКТГ передней долей гипофиза.
Выделение АКТГ определяют несколько факторов:
— механизм отрицательной обратной связи, реализуемой главным образом кортизоном:
— воздействие стресса — стимулы из высших центров головного мозга и симпатической нервной системы увеличивают секрецию гипоталамусом КРГ, нейрогипофизом — вазопрессина, мозговой долей надпочечников — катехоламинов. Все перечисленные гормоны стимулируют секрецию АКТГ;
— воспалительные цитокины, фактор некроза опухолей и интер-лейкины усиливают секрецию КРГ и вазопрессина;
— снижение уровня глюкозы в крови.
Таким образом, секреция кортизола у животных подвержена влиянию множества факторов. Увеличение его концентрации в крови может свидетельствовать как о нормальной адреналовой реакции на стрессорное воздействие, так и о патологически повышенной секреции гормона.
Поэтому автор статьи счел обоснованным провести анализ результатов исследования концентрации кортизола в крови у собак.
Концентрация кортизола определялась методом иммуноферментного анализа у 173 собак. Исходя из данных, полученных при сборе анамнеза, удалось выявить доминирующие устойчивые патологические признаки, благодаря которым всех исследуемых животных распределили по опытным группам (таблица 1).
патологический признак | кол-во животных | примечание |
пиодермия острая | 27 собак | исследование проведено в течение 2 месяцев после появления симптомов |
пиодермия хроническая | 39 собак | – |
алопеция | 16 собак | без полиурии и полидипсии |
гиперпигментация кожи | 8 собак | зуд отсутствует |
кожный зуд | 26 собак | – |
полиурия/полидипсия | 43 собаки | – |
ожирение | 14 собак | – |
Таблица 1. Состав опытных групп животных
Среди исследованных животных выявлялись собаки как с более низкой концентрацией кортизола, так и с более высокой, причем между ними существовала выраженная контрастность. В таблице 2 показаны статистически обработанные результаты исследования. Эти ре зультаты свидетельствуют о различной степени изменения секреции кортизола при острой и хронической пиодермии и полиурии/полидипсии. Можно предположить, что воспалительный процесс на коже, сопровождающийся болью, зудом, должен проходить с увеличением продукции кортизола, который в свою очередь регулирует интенсивность воспаления, препятствует гиперэргии. В исследованиях автора у большинства животных с данными патологиями определилось повышение секреции гормона. Более низкие значения при хронической пиодермии, возможно, объясняют следующие причины:
— боль и зуд менее выражены;
— «усталость» надпочечников;
— возможное применение синтетических глюкокортикостероидов (подавление продукции гормонов надпочечниками);
— надпочечниковая недостаточность.
клиническиепризнаки | низкаяконцентрациякортизола (нмоль/л) | высокаяконцентрациякортизола (нмоль/л) | ||||
интервал | кол–во | среднеезначение (М±ш) | интервал | кол–во | среднеезначение (М+т) | |
пиодермия острая | 65,2-121,4 | п=4 | 101,5+9,3 | 178,3-342,6 | п=23 | 296,3+17,5 |
пиодермия хроническая | 20,3-79,6 | п=19 | 46,7+3,1 | 129,3-194,6 | п=20 | 161,4±9,8 |
полиурия/полидипсия | 42,3-98,5 | п=28 | 57,4±3,1 | 183,6-674,8 | п=15 | 341,4±25,2 |
Таблица 2. Результаты исследования концентрации кортизола
Следует обратить внимание, что именно среди животных с хронической пиодермией у половины особей выявляются самые низкие значения кортизола, что должно стать поводом для проверки функциональной способности надпочечников с помощью стимулирующих тестов.
Что касается собак с признаками полиурии и полидипсии, то у трети из исследованных животных было выявлено увеличение концентрации кортизола, что, вероятнее всего, обусловлено гиперадренокортицизмом. Однако нельзя полностью опровергать наличие этой патологии у остальных животных. Увеличение жажды может свидетельствовать о ряде других заболеваний (сахарный и несахарный диабет, почечная недостаточность, пиометра), тем не менее при гипофизарной форме гиперадренокортицизма возможны флюктуации кортизола.
Среди собак с признаками кожного зуда, алопеции и ожирения не было выявлено разнонаправленных изменений. Данные таблицы 3 свидетельствуют о том, что у животных с алопецией и ожирением не выражены колебания концентрации кортизола — она практически не выходила за пределы референтных значений. Что касается собак с кожным зудом, то у 100% особей определялась гиперкортизолемия.
Таким образом, изменения концентрации кортизола у собак могут быть связаны как с первичной патологией (надпочечников или нарушения продукции АКТГ), так и с вторичной (патологиями, приводящими к увеличению секреции).
При подозрении на гипо- или гиперадренокортицизм измерение базального уровня кортизола не всегда информативно, поэтому для исключения данных заболеваний необходимо дополнительно проводить функциональные тесты:
– для исключения гиперадренокортицизма — малый дексаметазоновый тест;
– для исключения гипоадрено-кортицизма — стимулирующий тест с синактеном
клинические признаки | кол-во | концентрация кортизола (нмоль/л) | |
интервал | среднее значение (М+т) | ||
кожный зуд | п=26 | 187,4-298,3 | 245,4±17,1 |
алопеция | п=16 | 32,6-143,7 | 71,5+5,8 |
ожирение | п=14 | 41,7-119,4 | 62,4±4,9 |
Таблица 3. Результаты исследования концентрации кортизола
С. ВАСИЛЬЕВА, ветврач, научный сотрудник «Клинико-биохимической лаборатории»,
ассистент кафедры биохимии СПбГАВМ, г. Санкт-Петербург
Масимов Э.Н., к.б.н., ветеринарный врач ИВЦ МВА, г.Москва
Устойчивое длительное повышение уровня кортизола в крови, сопровождаемое нарушением ряда клинических функций называется синдромом Кушинга (гиперадренокортицизм). Гиперадренокортицизм ассоциирован с излишней продукцией или экзогенным введением глюкокортикоидов, и является одной из наиболее часто диагностируемой эндокринопатией у собак.
В гуманной медицине можно встретить такое понятие как «синдром Иценко-Кушинга», «болезнь Иценко-Кушинга». Эти два определения имеют довольно четкие различия. Так, например, болезнь Иценко-Кушинга, нейроэндокринное заболевание. Синдромом Иценко-Кушинга принято обозначать новообразование надпочечника, доброкачественного или злокачественного характера.
В ветеринарной медицине, как правило, таких строгих разграничений нет. Под термином «синдром Кушинга» принято подразумевать и новообразование надпочечника, так и новообразование гипофиза, так и ятрогенную форму заболевания.
Надпочечник, или адреналовая железа – парный инкреторный орган, который располагается у краниального конца почки, соединяясь с ней жировой тканью и кровеносными сосудами. В формировании надпочечников учувствуют мезодерма в виде межпочечной ткани, являющейся производным метамерно расположенных утолщений перитонеального эпителия, и супреренальной, или хромаффинной ткани, развивающейся из зачатков симпатических нервных узлов. Из-за срастания двух типов железистой ткани образуются две части надпочечника – кора и мозговое вещество, каждая из которых вырабатывает «свои гормоны». Кортикостероиды вырабатывает кора надпочечников, а норадреналин и адреналин – мозговое вещество. Из особенности строения у собак можно отметить его длину – 1-2см, удлиненно-овальную форму, а также характерный желтоватый оттенок1.
В основе гиперадренокортицизма собак лежат множественные патофизиологические нарушения, но все они сводятся к хроническому избытку кортизола в организме.
Патофизиологическая классификация причин синдрома Кушинга собак включает:
- Гипофизарные опухоли, продуцирующие и секретирующие избыточное количество АКТГ, сочетающееся с вторичной гиперплазией надпочечников.
- Ятрогенные факторы вследствие передозировки экзогенного АКТГ или избыточной терапии глюкокортикоидами.
- Первичный избыток кортизола, который автономно секретируется аденомой или карциномой надпочечников5.
У 80-85% собак со спонтанно развившимся синдромом Кушинга имеют гиперкортицизм, зависимый от гипофиза, т.е. избыточную секрецию АКТГ гипофизом, которая вызывает двустороннюю гиперплазию коры надпочечников и повышенную концентрацию глюкокортикоидов в плазме крови. Почти у всех собак с гипофизарным гиперадренокортицизмом имеется гипофизарная аденома, чаще всего локализованная в передней доле.
Первичные опухоли коры надпочеников, как аденомы, так и карциномы, по-видимому, развиваются автономно5. Процессы, приводящие к образованию опухолей коры надпочечников, изучены недостаточно. Секреция кортизола в данных случаях носит неупорядоченный, эпизодический характер.
Стоит также отметить, что двусторонние опухоли коры надпочечников и по литературным данным, и по личному наблюдению автора, встречаются у собак редко. В исследовании Hoerauf, Reusch в 1999г у 15 исследованных собак с синдромом Кушинга, который был вызван активными опухолями коры надпочечников, у трех собак опухоли имелись в обоих железах.
Гиперадренокортицизм встречается у собак среднего или старого возраста, с возрастным диапазоном от 2 до 16 лет и средним возрастом 7-9 лет. По данным ряда авторов, патология надпочечникового происхождения встречается у более пожилых собак, чей средний возраст 11-12 лет. Породной предрасположенности нет. Из практики автора чаще всего данное заболевание диагностируется у собак пород такса, пинчер, пудель. Половая предрасположенность также отсутствует.

Рис.1 Собака пинчер, 7 лет, сука, новообразование надпочечника.
Клинические признаки гиперадренокортицизма весьма разнообразны. Самый частый симптомокомплекс это полиурия/полидипсия. Полидипсия – состояние, когда потребление воды свыше 100 мл/кг веса тела в течения дня, и полиурия, определяемая как продукция мочи свыше 50 мл/кг веса тела в течение дня, наблюдаются в большинстве случаев гиперадренокортицизма.
Далее, из симптомов, можно выделить полифагию, отвисший живот, алопеции, медленный рост шерсти, мышечная атрофия, одышка, у сук встречается анэструс, неврологические симптомы.
Также одним из «показательных» симптомов являются именно дерматологические признаки заболевания. Кожа, особенно на вентральной стороне живота, истончается и теряет эластичность. Вены живота выступают и легко заметны через тонкую кожу. Имеется повышенное образование поверхностных чешуек, и наблюдаются комедоны, вызванные закупоркой фолликулов, особенно вокруг молочных желез3.
Избыточное выделение кортизола негативно влияет на один из циклов роста волоса – анаген. Происходит истончение шерстного покрова, приводящее к билатеральной симметричной алопеции. Голова, лапы и хвост обычно поражаются последними.
Гиперадренокортицизм начинается незаметно для владельцев собаки и медленно прогрессирует в течение месяцев.
На текущее время диагностика синдрома Кушинга разнообразна. Для постановки диагноза можно использовать различные лабораторные методы, визуальную диагностику, а также проводить диагностические тесты.
Ультразвуковая диагностика применима только в случае дифференциации ГАК надпочечникового происхождения от патологии гипофиза.
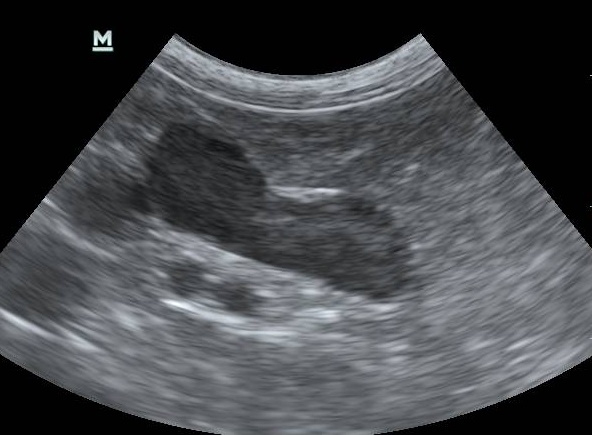
Рис.2 Патологический надпочечник.
Особое внимание стоит уделить гематологическим и биохимическим исследованиям крови. У собак, с предварительным диагнозом ГАК можно выделить следующие особенности лабораторных исследований.
Клинический анализ крови: нейтрофилия, лейкоцитоз, лимфопения, эозинопения. В биохимическом исследовании наблюдается повышение уровня триглицеридов и холестерина, снижение уровня мочевины, повышение щелочной фосфатазы.
Стоит уделить внимание и анализу мочи, в результатах которого отмечается снижение удельного веса.
Рис.3 Собака шитцу, 9 лет, гипофизарная форма ГАК.
Редко проводимое исследование при подозрении на ГАК – радиография. При данном исследовании отмечают признаки остеопороза, минерализации надпочечников. Адреномегалия является крайне редкой находкой при рентгенографии брюшной полости, все же большое увеличение предполагает, но не диагностирует, наличие карциномы надпочечников.
Компьютерная томография – дорогостоящий вид исследования, в последнее время все чаще применяемый для визуализации новообразования гипофиза, опухолей надпочечников, гиперплазии надпочечников.
Диагностические тесты, применяемые в практике, являются подтверждением или полным опровержением диагноза. Скрининг-тесты – АКТГ-стимулирующий тест, а также проба с низкими уровнями дексаметазона. В арсенале ветеринарного врача также имеется тест на соотношение кортизол/креатинин в моче. У всех исследований есть и свои преимущества, и свои недостатки.
Из личного опыта автора, соотношение кортизол/креатинин в моче, не является тестом, на который можно полагаться при постановке окончательного диагноза. Данный тест используется в практике крайне редко. Данное соотношение является идеальным для исключения гиперадренокортицизма (если результат в норме), но не подтверждает наличие заболевания. В данном случае моча должна быть собрана дома, утром, при спонтанном мочеиспускании, без стресса. Чувствительность данного теста приближается к 98%3.

Рис.4 Собака пинчер, 7 лет, сука, новообразование надпочечника.
Дексаметазоновая проба (проба с низкими уровнями дексаметазона) – у пациента собирают около 3 мл плазмы или сыворотки для определения концентрации кортизола; далее, вводят внутривенно дексаметазон из расчета 0,01мг/кг; далее, собирают вторую пробу для определения концентрации кортизола через 3-4 часа и третью пробу через 8 часов после введения дексаметазона.
Супрессивная проба низкими дозами дексаметазона не подходит для определения ятрогенного гиперадренокортицизма. Также она довольно длительна по продолжительности – 8 часов. Тем не менее, она более надежна для подтверждения гиперадренокортицизма, так как позволяет диагностировать у собак все случаи гиперадренокортицизма надпочечникового происхождения и в 90-95 % случаях гипофизарный гиперадренокортицизм. Концентрация кортизола более 40 нмоль/л через 8 часов предполагает подтверждение диагноза гиперадренокортицизм.
Стимулирующая проба с АКТГ является лучшим выбором для дифференциации спонтанного и ятрогенного гиперадренокортицизма. Проба с АКТГ является незаменимой для мониторинга лечения синдрома Кушинга.
Техника проведения данного теста: Взятие пробы крови для определения базального уровня кортизола. Далее, введение 0,25 мг синтетического АКТГ внутривенно или внутримышечно. Собакам весом менее 5кг – 0,125мг. Взятие второго образца крови через 30-60 мин после введения АКТГ внутривенно и 60-90 мин, – после внутримышечного введения. Результаты теста считаются позитивными, если после стимуляции АКТГ уровень кортизола вырос> 600 нмоль/л у собак с характерными клиническими признаками. Уровень кортизола <450нмоль/л после стимуляции считается нормой для животного, у которого нет гиперадренокортицизма.
Лечение синдрома Кушинга (ГАК) имеет несколько вариантов в зависимости от причины заболевания – это хирургический метод, или медикаментозный.
В случае, если ГАК является ятрогенным, то животному осторожно уменьшают дозу, а затем прекращают терапию глюкокортикоидами3.
Хирургическое лечение применимо в случае с гиперадренокортицизмом надпочечникового происхождения имеет лучший прогноз, если опухоль может быть полностью удалена хирургическим путем. Односторонняя адреналэктомия требует большого опыта и экспертной оценки, из-за сложной анатомии. Техника хорошо описана с использованием паракостального, бокового доступа. Во время проведения операции и после нее требуется дополнительное введение глюкокортикоидов и минералокортикоидов, так как кора противоположного надпочечника будет атрофирована и не способна адекватно отвечать на стресс.
Хирургическое лечение применимо и в случае с гипофизарным происхождением ГАК. Но хирургическое вмешательство, в данном случае, технически сложная и ассоциирована с высокой заболеваемостью и смертностью. Частыми осложнениями являются кровотечение и неполная визуализация и удаление большего поражения. Может развиться транзиторный несахарный диабет.
Медикаментозное лечение применяется довольно широко. Даже несмотря на официальную недоступность на территории России таких препаратов как Трилостан или Митотан, их применение является по сути единственным лечением ГАК.
Назначение в виде лечения препаратов с содержанием кетоконазола или L-дипренила является малоэффективным и практически не используется. Альтернативная терапия имеет или минимальный эффект, либо эффект отсутствует вовсе. Мелатонин, метапирон, бромокриптин – все эти препараты не имеют доказанной эффективности при лечении ГАК2.
Препаратом выбора, на взгляд автора, является Трилостан («Веторил»). Трилостан – обратимый конкурентный ингибитор 3β- гидроксистероиддегидрогеназы, блокирующий синтез стероидов в надпочечниках. Дозировки, применяемые для животных – от 2,5 до 5мг/кг, 1 раз в день. Контроль лечения: первая проба с АКТГ – через 7-14 дней лечения, тест проводится через 4-6 часов после дачи препарата. Целью является уровень кортизола 50-120 (250) нмоль/л. Контроль лечения: первая проба с АКТГ – через 7-14 дней лечения, тест проводится через 4-6 часов после дачи препарата. Целью является уровень кортизола 50-120 (250) нмоль/л7.
Митотан эффективный и относительно безопасный препарат для применения у собак с гиперадренокортицизмом надпочечникового происхождения. Однако собаки с опухолью надпочечников склонны быть более устойчивыми к митотану, чем собаки с гипофизарным гиперадренокортицизмом. Митотан назначают внутрь в дозе 50 мг/кг/день. Его следует давать вместе с кормом, так как это жирорастворимый препарат. Лечение митотаном относительно безопасно, а побочные эффекты, которые возникают наиболее часто, например, анорексия, рвота или диарея, редко серьезны, при условии, что их рано заметили, так что лечение митотаном может быть приостановлено.
Подводя итог данному обзору, можно отметить широкие возможности диагностики синдрома Кушинга, а также распространенные методы лечения данного заболевания. Продолжительность жизни собаки с ГАК, в среднем, 30 месяцев. Так, например, пациент бостон-терьер «Тема», являющийся пациентом автора, на текущий момент имеет продолжительность жизни после постановки диагноза 18 месяцев.
Также необходимо отметить факт, что в 80-85% случаев диагностируется гипофизарный гиперадренокортицизм.
Список литературы:
- Акаевский А.И., Юдичев Ю.Ф., Селезнев С.Б., «Анатомия домашних животных», 5-е издание, Москва, 2005, Аквариум
- Small animal dermatology 2nd ed, Karen Helton Rhodes, Alexander H.Werner, 2011, Blackwell
- Материалы II международного ветеринарного дерматологического симпозиума, 2013г., Спб
- Руководство по эндокринологии мелких домашних животных, под редакцией Эндрю Дж. Торранс и Кармел Т. Муни, 1998, Аквариум
- Эндокринология и репродукция собак и кошек, Э.Фелдмен, Р.Нельсон., 2008, Софион
- Canine and Feline Endocrinology, Mooney C. T., Peterson M. E., BSAVA, 2004
- Игнатенко Н.А., «Гиперадренокортицизм: диагностика и лечение у собак», журнал Vetpharma №6-2012, Москва
Вернуться к списку
