Кривая насыщения гемоглобина кислородом имеет вид
При транспорте кислорода все состояния вносят вклад, пропорциональный числу присоединенных молекул (свободное состояние E вносит нулевой вклад). Общий эффект связывания представляет степень насыщения гемоглобина, как отношение количества связанного кислорода Y по отношению к максимально возможному связыванию.
Для рассматриваемой схемы связывания степень насыщения
Насыщение гемоглобина принято выражать в зависимости от парциального давления кислорода в равновесии с кровью P, а не от концентрации кислорода в растворе (кровь, тканевая жидкость и т.п.) непосредственно (которая пропорциональна давлению P в соответствии с растворимостью для данной среды и температуры). Давление кислорода в газовой фазе удобнее измерять, зачастую она известна, как заданная некоторыми условиями, например, давление кислорода в воздухе (21%, т.е. 21 кПа). Если использовать такую конвенцию, то аналогично через давления естественно выражать и диффузионные потоки.
Кривая насыщения гемоглобина, как зависимость количества связанного кислорода Y(P) (в сравнении с максимально возможным связыванием) от концентрации кислорода P (используемой вместо S, если определять степень насыщения указанным образом/ в зависимости от парциального давления кислорода), имеет вид (рис. кривые насыщения гемоглобина и миоглобина БФХ = «Биофизическая химия», с. 104).
;
где константы равновесия определены Ki = ki/k–i. в соответствии со схемой связывания выше (получение зависимостей такого рода и их свойства подробнее обсуждались в части 1)
Математическое выражение для кривой насыщения гемоглобина предполагает более широкие возможности, чем узко сигмоидный вид (в частности, за счет подбора констант кривую можно изменить и противоположным образом)
= есть дополнительные степени свободы (в сравнении с гиперболой)
(И) практическая математика: как сравнить две существенно разные математические зависимости?
Чем кривая насыщения гемоглобина отличается от гиперболического связывания?
(М) микроскопические константы связывания
Как использованы эти степени свободы?
Кривая насыщения имеет сигмоидный вид.
Подробнее.
Выражение для кривой насыщения гемоглобина, учитывающее число микросостояний (комбинаторику) [Биофизическая химия, с. 106]
При равенстве микроскопических констант (Ki = K) получаем полный куб в числителе и полную четвертую степень в знаменателе. После сокращения получаем ту же гиперболическую зависимость, что и при связывание переносчика с одной молекулой как для миоглобина.
Иными словами, сигмоидный вид требует прогрессирующей тенденции связывания кислорода с гемоглобином, чтобы от первой связываемой молекулы к четвертой сродство возрастало, т.е. возрастания от K1 к K4.
Константы равновесия (связывания) могут различаться более, чем на 2 порядка (например, [«Биофизическая химия», с. 106]: возрастание от K1 до K4 с характерными значениями K1 = 0,025 Торр–1, K4 = 7 Торр–1), что и объясняет наблюдаемую зависимость. Как уже говорили, ее называют сигмоидной или S-образной (из-за характерного перехода кривой от выпуклости вниз при малых значениях аргумента к выпуклости вверх, т.е. изменением знака второй производной).
как эквивалент обычной для теплокровных животных (сигмоидной) кривой насыщения используют уравнение Хилла
(Д)
Кривую насыщения гемоглобина (при характерном для теплокровных животных соотношении констант, обсуждение для холоднокровных – см. ниже) можно приближенно представить уравнением Хилла, т.е. зависимостью вида
Y=pn/(Kn+pn), n = 2,8
хотя при низких концентрациях кислорода кривая насыщения, вроде бы, имеет совсем другой вид (почти кубическая парабола), чем для гемоглобина (для которого она линейна)
(Д) для человека и животных с близкой массой, значение K находится в диапазоне 3–4 кПа.
(М) проверки (контроля) качества описания: наложение зависимости Хилла на кривую насыщения в общем случае при наблюдаемых значениях констант связывания
Иллюстрация с подбором при значениях констант из БФХ (по исходной зависимости, уравнению Хилла + наиболее близкая к исходной гиперболическая кривая – как имитация возможностей приблизиться к наблюдаемому виду за счет одного связывания).
Результат сравнения (по данным из БФХ, с. ): зависимости практически совпадают (точнее, есть существенное различие при малых концентрациях кислорода, но рабочая область как значения Pa и Pv, см. ниже, находятся в другом диапазоне).
Иными словами, уравнение Хилла хорошо описывает реальную зависимость, если не рассматривать малые концентрации, где кривая насыщения линейна.
Таким образом, уравнение Хилла фиксирует соотношение констант связывания (и степеней свободы).
Иными словами, сигмоидность кривой насыщения в данном случае выражает возможность приближенно описать ее уравнением Хилла
Связь по кривой насыщения дают основные этапы переноса кислорода – поступление в ткани, перенос системой кровообращения, который уже обсуждали), поступление в кровь из легких (в органах дыхания).
Особые свойства молекулы гемоглобина, которые делают его столь эффективным переносчиком кислорода в крови, легче всего уяснить из сравнения миоглобина и гемоглобина в отношении их сродства к кислороду. На рис. 8-16 показаны кривые насыщения кислородом для гемоглобина и миоглобина, характеризующие степень насыщения этих белков кислородом (т.е. отношение числа участков молекулы, связывающих кислород, к общему числу участков, способных к такому связыванию) в зависимости от парциального давления газообразного кислорода, находящегося в равновесии с раствором белка.
Рис. 8-15. Фоток рафия нормальных эритроцитов человека, полученная при помощи сканирующего электронного микроскопа.
Прежде всего из графика ясно, что миоглобин имеет очень высокое сродство к кислороду: при парциальном давлении кислорода, равном всего лишь 1-2 мм рт. ст., он уже на 50% насыщен кислородом. Кроме того, мы видим, что кривая насыщения миоглобина кислородом имеет вид простой гиперболы, как и следует ожидать из закона действующих масс применительно к равновесной реакции:
При парциальном давлении кислорода, равном 20 мм рт. ст., миоглобин оказывается насыщенным кислородом более чем на 95%. В отличие от миоглобина гемоглобин характеризуется значительно более низким сродством к кислороду; кроме того, кривая насыщения гемоглобина кислородом имеет сигмоидную, т.е. S-образную, форму (рис. 8-16). Это означает, что при связывании первой молекулы кислорода (нижняя часть S-образной кривой, соответствующая парциальным давлениям кислорода ниже 10 мм рт. ст.), гемоглобин имеет очень низкое сродство к кислороду, тогда как при связывании следующих молекул кислорода его сродство к ним становится намного выше, о чем свидетельствует крутая часть -образной кривой.
Рис. 8-16. Кривые насыщения кислородом для миог лобина и гемоглобина. Миоглобин обладает намного более высоким сродством к кислороду, чем гемоглобин. 50%-ное насыщение миоглобина кислородом достигается уже тогда, когда парциальное давление О, составляет всего 1 -2 мм рт. ст., тогда как для гемоглобина такое насыщение кислородом наступает лишь при парциальном давлении кислорода около 26 мм рт. ст. Обратите внимание, что в артериальной крови, вытекающей из легких (при парциальном давлении кислорода около 100 мм рт. ст.) оба белка – и миоглобин и гемоглобин – насыщены кислородом более чем на 95 %„ тогда как в покоящейся мыщце, где парциальное давление кислорода равно 40 мм рт. ст., гемоглобин насыщен кислородом лишь на 75%, а в работающей мышце при парциальном давлении кислорода всего около 10 мм рт. ст. только на 10%. Таким образом, гемоглобин очень эффективно отдает свой кислород в мышцах и других периферических тканях. Что же касается миоглобина, то при парциальном давлении кислорода, равном всего 10 мм рт. ст„ он все еще остается насыщенным кислородом почти на 90% и поэтому даже при столь низких парциальных давлениях кислорода отдает очень малую часть связанного с ним кислорода. Таким образом, сигмоидная кривая насыщения гемоглобина кислородом является результатом молекулярной адаптации гемоглобина к выполнению им транспортной функции в составе эритроцитов.
Фактически после связывания первой молекулы кислорода сродство повышается почти в 500 раз. Таким образом, четыре гемсодержащие полипептидные субъединицы гемоглобина различаются по степени их сродства к кислороду и зависят друг от друга в процессе его связывания.
Как только первая гемсодержащая полипептидная субъединица свяжет молекулу кислорода, она передает информацию об этом остальным субъединицам, у которых сразу же резко повышается сродство к кислороду. Такой обмен информацией между четырьмя гемсодержащими полипептидными субъединицами гемоглобина обусловлен кооперативным взаимодействием между субъединицами. Поскольку связывание первой молекулы кислорода одной из субъединиц гемоглобина увеличивает вероятность связывания следующих молекул кислорода остальными субъединицами, мы говорим, что гемоглобин имеет положительную кооперативностъ. Для положительной кооперативности характерны сигмоидные кривые связывания, подобные кривой насыщения гемоглобина кислородом. При связывании кислорода миоглобином, содержащим одну гемогруппу, молекула белка может присоединить только одну молекулу кислорода; в этом случае кооперативного связывания не наблюдается и кривая насыщения имеет вид простой гиперболы. Теперь мы понимаем. почему миоглобин и гемоглобин столь сильно различаются между собой по кислород-связывающей способности.
Мы будем использовать термин лиганд для обозначения специфической молекулы, связывающейся с белком; это может быть, например, молекула кислорода, если речь идет о гемоглобине (слово «лиганд» происходит от латинского слова, которое переводится как «связывать», «присоединять» и буквально означает «то, что присоединяется»). Многие другие олигомерные белки тоже имеют по нескольку лиганд-связывающих центров и, подобно гемоглобину, проявляют положительную кооперативность. Однако есть олигомерные белки, проявляющие отрицательную кооперативность: в этом случае связывание одной молекулы лиганда уменьшает вероятность связывания других молекул лиганда.
| Рис. 17.6. Кривая насыщения гемоглобина кислородом. Объяснение в тексте. |  |
| Рис. 13. Кривые насыщения гемоглобина (1) и миоглобина (2) кислородом. | 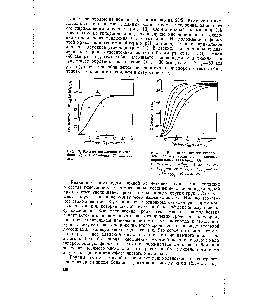 |
Особые свойства молекулы гемоглобина, которые делают его столь эффективным переносчиком кислорода в крови, легче всего уяснить из сравнения миоглобина и гемоглобина в отношении их сродства к кислороду. На рис. 8-16 показаны кривые насыщения кислородом для гемоглобина и миоглобина, характе- [c.206]
| Фиг. 107. Кривые насыщения гемоглобина кислородом и СО. | 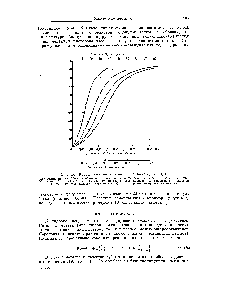 |
Численно сродство гемоглобина к кислороду принято выражать величиной Р д-парциальное напряжение кислорода, при котором 50% гемоглобина связано с кислородом (pH 7,4 температура 37°С). Нормальная величина Рз около 34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом вправо означает уменьшение способности гемоглобина связывать кислород и, следовательно, сопровождается повышением Рз . Напротив, смещение кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду, величина Рз снижена. [c.594]
Возрастание интенсивности окислительных процессов в тканях, например при усиленной мышечной работе всегда связано с более полным извлечением кислорода из крови. Кроме того, при физической работе резко увеличивается скорость кровотока. Зависимость между степенью насыщения гемоглобина кислородом и Р ,, можно выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации оксигемоглобина, которая имеет 8-образную форму и характеризует сродство гемоглобина к кислороду (рис. 17.6). [c.593]
Ход кривой насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с pH. Чем ниже pH, тем меньше способность гемоглобина связывать кислород и тем выше Рз . В тканевых капиллярах pH ниже (поступает большое количество СО,), в связи с чем гемоглобин [c.594]
А. Сигмоидная кривая, полученная для гомотропного фермента, субстрат которого служит также положительным (активирующим) модулятором. Величина. Kg 5 – это концентрация субстрата, при которой скорость реакции равна половине максимальной. Обратите внимание, что относительно небольшое повышение концентрации субстрата в крутой части кривой может вызвать весьма значительное увеличение скорости реакции. Обратите внимание также на то, что эта кривая напоминает кривую насыщения гемоглобина кислородом. [c.261]
Зависимость степени насыщения гемоглобина кислородом от парциального давления кислорода должна описываться несколько другим уравнением, как это видно из рис. 7.5. Особенностью кривой для гемоглобина является то, что по мере связывания молекул кислорода сила связи кислорода с гемоглобином не уменьшается, как в большинстве равновесий, включающих последовательно связываемые лиганды (в данном случае молекулы кислорода), а увеличивается. Эта особенность имеет огромное физиологическое значение, поскольку оксигемоглобин диссоциирует с выделением кислорода в значительно более узком интервале [c.231]
Кривая насыщения гемоглобина кислородом [c.533]
| Рис. 8-17. Влияние pH на кривую насыщения гемоглобина кислородом. При низком значении pH, характерном для тканей (pH 7,2), кислород освобождается легче, чем при более высоком значении (pH 7,6), характерном для легких, где кислород легче связывается. | 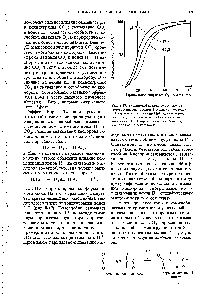 |
При ВЫСОКИХ концентрациях СО , наблюдающихся в тканях, часть СО2 связывается с гемоглобином и его сродство к О2 снижается, что приводит к освобождению 02- И наоборот, когда в легких с гемоглобином связывается О2, уменьшается сродство гемоглобина к СО2. Из сказанного следует, что кривая насыщения гемоглобина кислородом зависит как от pH, так и от концентрации СО2. Такая обратная зависимость между связыванием О2, с одной стороны, и связыванием СО2 и ионов Н -с другой, дает организму большие преимущества. В тканях при низких pH и высоких концентрациях СО2 кислород обычно освобождается из гемоглобина, тогда как в легких высокая концентрация кислорода способствует вьщелению СО2 и ионов Н. Таким образом, благодаря способности молекулы гемоглобина передавать информацию о связывании лигандов от одной полипептидной субъединицы к другой эта молекула оказывается великолепно приспособленной к осуществлению совместного переноса эритроцитами О2, СО2 и ионов Н . [c.210]
| Рис. 2, Влияние ДФГ на кривую насыщения гемоглобина кислородом. | 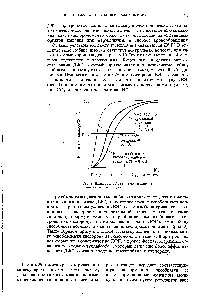 |
Гемоглобин состоит из двух а- и двух р-полипептидных цепей и четырех ге-мовых групп, каждая из которых присоединена к полипептидной цепи (разд. 8.9, 8.10). Одна гемовая группа обратимо связывает одну молекулу молекулярного кислорода. Поскольку гемоглобин содержится в эритроцитах в большом количестве, в 100 мл цельной крови млекопитающего при полном насыщении кислородом транспортируется приблизительно 21 мл газообразного кислорода. Связывание кислорода гемоглобином зависит от четырех факторов 1) парциального давления О2 2) pH,- 3) концентрации 2,3-бисфосфоглицерата и 4) концентрации СО2 (разд. 8.12-8.16). На рис. 24-21 приведены кривые насыщения гемоглобина кислородом. Сигмоидная форма этих кривых свидетельствует о том, что связывание первой молекулы [c.768]
Характерная для гемоглобина 8-образная кривая насыщения кислородом свидетельствует, что связывание первой молекулы кислорода одним из [c.593]
У некоторых амфибий переход к наземной жизни сопровождается появлением новых форм гемоглобина, которые в отличие от заменяемых ими ювенильных гемоглобинов характеризуются ярко выраженными 8-образнымн (кооперативного типа) кривыми насыщения Ог. У других амфибий как ювенильным, так и взрослым гемоглобинам свойственна кооперативная кинетика связывания кислорода однако у этих видов эффект Бора обнаруживает только гемоглобин взрослого типа. Высокая кооперативность связывания Ог и выраженная зависимость сродства к кислороду от pH позволяют гемоглобинам взрослых амфибий высвобождать значительную часть кислорода против крутого концентрационного градиента в интенсивно дышащих тканях. [c.370]
Парциальное давление кислорода максимально в легких и минимально в других различных тканях организма. Из представленных кривых (рис. 3.17) видно, что сродство миоглобина к кислороду выше, чем гемоглобина. Следующее различие заключается в том, что кривая насыщения кислородом в случае миоглобина имеет гиперболическую форму, а для гемоглобина — сигмоидную. [c.51]
Из многообразия производных гемоглобина, представляющих несомненный интерес для врача, следует прежде всего указать на оксигемоглобин НЪО, — соединение молекулярного кислорода с гемоглобином. Клслород присоединяется к каждому гему молекулы гемоглобина при помощи координационных связей железа, причем присоединение одной молекулы кислорода к тетрамеру облегчает присоединение второй молекулы, затем третьей и т.д. Поэтому кривая насыщения гемоглобина кислородом имеет сигмоидную форму, свидетельствующую о кооперативности связывания кислорода. Эта кооперативность обеспечивает не только связывание максимального количества кислорода в легких, но и освобождение кислорода в периферических тканях этому способствует также наличие П и СО, в тканях с интенсивным обменом. В свою очередь кислород ускоряет высвобождение СО, и П в легочной ткани. Эта аллостерическая зависимость между присоединением П, О, и СО, получила название эффекта Бора. [c.84]
Обратите внимание, что в артериальной крови, вытекающей из легких (при парциальном давлении кислорода около 100 мм рт. ст.) оба белка – и миоглобин и гемоглобин – насыщены кислородом более чем на 95%, тогда как в покоящейся мыщце, где парциальное давление кислорода равно 40 мм рт. ст., гемоглобин насыщен кислородом лишь на 75%, а в работающей мышце при парциальном давлении кислорода всего около 10 мм рт. ст.-только на 10%.Таким образом, гемоглобин очень эффективно отдает свой кислород в мышцах и других периферических тканях. Что же касается миоглобина, то при парциальном давлении кислорода, равном всего 10 мм рт. ст., он все еще остается насыщенным кислородом почти на 90% и поэтому даже при столь низких парциальных давлениях кислорода отдает очень малую часть связанного с ним кислорода. Таким образом, сигмоидная кривая насыщения гемоглобина кислородом является результатом молекулярной адаптации гемоглобина к вьшолнению им транспортной функции в составе эритроцитов. [c.207]
Сравнение свойств гемоглобинов, содержащихся в эритроф1тах матери и плода. При изучении транспорта кислорода у беременных самок было показано, что кривые насыщения гемоглобина кислородом в крови матери и плода, полученные в одних и тех же условиях, сильно различаются. Это явление обусловлено присутствием в эритроцитах плода гемоглобина (гемоглобин Р, Л2У2), который по своей структуре отличается от обьиного гемоглобина А ( гРг) содержащегося в эритроцитах матери. [c.225]
Реакции с кислородом каждой из четырех групп гема, входящих в состав гемоглобина, взаимосвязаны соединение с кислородом одной группы гема увеличивает сродство к кислороду других групп. Этот эффект получил название гем-гемного взаимодействия. Именно гем-гем-ное взаимодействие обусловливает, в основном, сигмоидную форму кривых насыщения, которая способствует наиболее эффективному переносу кислорода. Физиологическая роль гем-гемного взаимодействия заключается в основном не столько в увеличении сродства к кислороду при последовательном присоединении молекул кислорода к гемоглобину в легких, сколько в понижении этого сродства при последовательной диссоциации молекул кислорода в тканях. Это особенно важно потому, что парциальное давление кислорода в тканях не намного ниже, чем в легких. Если бы кривая насыщения гемоглобина кислородом имела гиперболоидную форму, в тканях освобождалась бы очень небольшая часть переносимого кислорода это приводило бы к гибели организма от удушья даже в атмосфере чистого кислорода. [c.136]
Эффект Бора. Сродство гемоглобина к кислороду зависит от pH окружающей среды, тогда как для миоглобина такой зависимости не наблюдается. Снижение pH в физиологических пределах сдвигает кривую насыщения гемоглобина кислородом вправо, т. е. сродство к кислороду уменьшается при повышении кислотности среды. Увеличение содержания СО2 (при постоянном значении pH) также уменьшает сродство гемб-глобина к кислороду. В тканях активно протекают метаболические процессы (например, в результате интенсивной работы мышц), в результате чего образуется много СО2 и органических кислот, что вызывает понижение pH крови. Повышение содержания СО2 и Н в капиллярах активно метаболизирующих тканей способствует высвобождению О2 из оксигемоглобина. После освобождения от О2 гемоглобин присоединяет Н и СО2 (при этом протоны связываются ионизированными карбоксильными группами глобина). Этот важный механизм был открыт в 1904 г. К. Бором. [c.215]
Дана зависимость насыщения гемоглобина (НЬ) кислородом при pH 7,2 от концентрации свободного кислорода. Концентрации 0 в капиллярах легких (125 мкМ) н в капиллярах тканей, потребляющих (50 мкМ), зафиксированы в узких пределах. Кривая а в отсутствие дифосфоглицерата (ДФГ) гемоглобин насыщается О в легких, но не может доставлять его к тканям. Кривая б прн физиологическом уровне ДФГ (4.5 мМ. приблизительно 30% Оа. поглощенного легкими, высвобождается в тканях (стрелка 1). Кривые бив поскольку гемоглобин плода (кривая в) имеет более низкое сродство к ДФГ. чем материнский гемоглобин, освобожденный из материнской крови молекулярный кислород может захватываться гемоглобином плода (стрелка [[I). Кривая г высокая концентрация ДФГ (8 мМ) приводит к повышенному снабжению тканей кислородом (стре.жи I и [[). Кривая д при отсутствии кооператнвиостн между субъединицами гемоглобина от легких к тканям транспортировалось бы меньше Оз. При построении гипотетической кривой связывания (5) для комплекса НЬОз принята константа диссоциации 38 мкМ. [c.258]
Важной особенностью гемоглобина, которая обусловлена наличием нескольких гем-групп, является форма кривой связывания кислорода не простая гиперболическая кривая насыщения, как для миоглобина, а S-образная. Сродство гемоглобина к кислороду возрастает с давлением. Поэтому при умеренных давлениях гемоглобин эффективно связывает кислород в легких, но отдает его миоглобину при низких давлениях в тканях. При потере кислорода образуется дезоксигемоглобин, субъединицы молекулы слегка смещаются относительно друг друга и поворачиваются так, что два р-гема удаляются друг от друга на расстояние около 6,5 А. Эта конформационная перестройка, несомненно, тесно связана с кооперативным взаимодействием гемов, которое позволяет им более прочно связывать кислород, когда молекула уже частично окислена. Однако детали этого взаимодействия еще не ясны. В концентрированных солевых растворах (например, в 4 М Na l) молекула [c.375]
Как только первая гемсодержащая полипептидная субъединица свяжет молекулу кислорода, она передает информацию об этом остальным субъединицам, у которых сразу же резко повьппается сродство к кислороду. Такой обмен информацией между четырьмя гемсодержа-щими полйпептидньши суб 1 гемоглобина обусловлен кооперативным взаимодействием между субъединицами. Поскольку связывание первой молекулы кислорода одной из субъединиц гемоглобина увеличивает вероятность связывания следующих молекул кислорода остальными субъединицами, мы говорим, что гемоглобин имеет положительную кооперативность. Для положительной кооперативности характерны сиг-мощны кривые связывания, подобные кривой насьыцения гемоглобина кислородом. При связывании кислорода миоглобином, содержащим одну гемогруппу, молекула белка может присоединить только одну молекулу кислорода в этом случае кооперативного связывания не наблюдается и кривая насыщения имеет вид простой гиперболы. Теперь мы понимаем, почему миоглобин и гемоглобин столь сильно различаются между собой по кислород-связывающей способности. [c.207]
Теперь представим себе, что гемоглобин в эритроцитах заменен на миоглобин. Из гиперболической кривой насыщения миоглобина кислородом (рис. 8-16) видно, что понижение парциального давления от 100 мм рт. ст. в легких до 26 мм рт. ст. в мьшщах должно приводить к высвобождению из миоглобина всего 1-2% связанного кислорода. Поэтому миоглобин мало пригоден для переноса кислорода от легких к тканям сродство к кислороду у него намного вьппе, чем у гемоглобина, и при парциальных давлениях кислорода, существующих в мьшщах и других периферических тканях, он отдает им очень мало кислорода. Гемоглобин же, наоборот, очень эффективно вьшолняет эту функцию, поскольку характерная для него кривая связыва- [c.208]
Большинство гемоглобинов позвоночных, так же как и регуляторные ферменты, обладает четвертичной структурой (рис. 113). Подобно тому как регуляторные ферменты часто состоят из разнородных (регуляторных и каталитических) полипептидных субъединиц, гемоглобины в большинстве случаев тоже построены из субъединиц двух различных типов. Наиболее обычный гемоглобин взрослого позвоночного представляет собой тетрамер, состоящий из двух а- и двух р-цепей, к каждой из которых присоединен гем (рис. 113). По-видимому, наличие в молекуле разнородных субъединиц существенно для кооперативного характера связывания кислорода (см. кривую для НЬ на рис. 112). У гомотетрамеров кривые насыщения кислородом имеют гиперболическую форму, сходную с формой кривой насыщения миоглобина. Благодаря сложности структуры высшего порядка (т. е. гетеротетрамерии) у гемоглобинов и регуляторных ферментов смогла выработаться высокая регуляторная эффективность. В частности, те и другие белки способны резко изменять свою функциональную активность при незначительных изменениях в концентрации субстрата или газа. У гемоглобинов это выражается в том, что они могут высвобождать большие количества связанного кислорода при крутом градиенте концентрации Ог в тканях. Вместе с тем концентрации свободного кислорода в плазме крови поддерживаются на низком уровне. [c.361]
О значении адаптации регуляторной функции гемоглобина (в отличие от адаптации, касающейся только общей кислородной емкости крови) свидетельствует то, что у многих видов рыб, почти не различающихся по общей кислородной емкости крови, существуют заметные различия в регуляции использования этого свойства. У более активных видов гемоглобин обладает гораздо большей способностью отдавать связанный кислород тканям против крутого градиента концентрации Оа. Мануэлл и Бейкер высказали предположение, что гетерозис , отмеченный у одного гибрида рыб из сем. Сеп1гагсЬ1(1ае, обусловлен более выраженной 5-образной формой кривой насыщения его гемоглобина (т. е. большей способностью НЬ отдавать Ог). Это еще один случай, когда адаптация к среде связана с появлением улучшенного варианта определенной молекулы, а не просто с повышением общей концентрации данного вещества. [c.371]
Основы биохимии Т 1,2,3 (1985) — [
c.207
,
c.209
]
