Лечение анемии после гбн
Re: ГБН и анемия
Сообщение qwaspol » 19 ноя 2011, 18:00
Здравствуйте Александр!
Много лет назад мы столкнулись с такой же проблемой, я думаю, что наша история каким-либо образом поможет Вам, ну хотя бы воодушевит. Когда подросли наши старшие, поменял я свои 5 соток на 25 в ближайшей деревне. Построил небольшой домик и осваивал землю. Во время каждой поездки в деревню старшие рассуждали, что мама их всему научила, а вот как обращаться с маленькими они не знают и просили родить еще маленькую девочку-пальмочку. Мама говорила , что поздно, ей уже 40. Как-то мне эти разговоры надоели, и я сказал, что сегодня дети будут делать грядки, а мы с мамой будем выполнять их заказ. Мы посмеялись, но потом все так и произошло, причем заказ-то выполнили несколько раз, на что жена сказала, что мы не такие уж и старые. Пару месяцев спустя жена начала меня укорять, что я стал плохо водить машину, поскольку ее укачивает, иногда даже приходилось останавливаться. Вскоре она попросила отвести ее в женскую консультацию, из которой вышла с какой-то растерянной улыбкой, и сообщила мне, что беременна. Долго все обсуждали, вопрос осложнялся тем, что у жены была уникальная кровь, которая не имела ни одного антигена и подходила всем при переливании, я же был обладателем группы В и резуса. Первый ребенок у таких пар как правило нормально рождается, а у следующих могут быть проблемы в зависимости от количества антител в крови матери. Последствия могли быть ужасными, и у нас был пример второго ребенка моего однокашника, которого не совсем успешно лечили много лет. Посоветовались со всеми и врачами в том числе, заручились поддержкой и постоянным медицинским сопровождением, зарезервировали место в лучшем роддоме города. Я ни разу не видел, чтобы все так ждали этого ребенка. Жену заранее поместили в роддом, и у нее было море посетителей каждый день. И вот это событие произошло, при посещении я получил от жены сумбурную записку, понял, что при родах были какие-то осложнения, девочка не жизнеспособна, её поместили в спецкамеру для новорожденных. Поговорил с врачом, мне показали дочь. Через стекло этого бокса я увидел мраморное личико с голубыми глазами, устремленными в вечность, и прошептал – нэцкэ, это прозвище ,в последствии, прилипло к ней надолго . Потом повернулся к врачу и сказал, – Делай что хочешь, док, но ребенок должен жить, лекарства и другие средства, что нужно – все будет. Две недели бессонных ночей, поиск лекарств, крови для переливания. В состоянии стабильно плохом, с угрожающе низким гемоглобином, дочку вместе с женой перевозят в городскую детскую и все продолжается, радует одно – ребенок все таки ест. Через два месяца, переговорил с лечащим врачом и врачом по крови и понял переливание крови не дает положительных результатов. Забрал жену с ребенком домой, и начали мы свое лечение – ежедневно холодная ванна на 3-5 секунд, специальное кормление, мумиё, сок петрушки, моркови и шпината по каплям, закутывание в специальное одеяло, лечение прибором, излучающим красный свет. Ни одеяло, ни прибор не были сертифицированы, использовали мы их по рекомендации друзей. От материнского молока пришлось отказаться, поскольку оно плохо усваивалось и вызывало расстройство желудка. Сначала использовали специально подобранную детскую смесь, а затем готовили кашу на молоке и крупы из пророщенной пшеницы. К концу 4 месяца гемоглобин начал медленно подниматься. Вы бы видели глаза жены, когда она бежала ко мне с результатами анализа крови дочери. К году дочь практически не отставала в развитии от сверстников, были отклонения, но для нас это уже не было проблемой. В школе же опережала в физическом развитии даже мальчишек, бегала быстрее, а прыгала выше и дальше.
До сих пор я не знаю, что помогло нам справиться с проблемами, помогли ли эти приборы, данных по ним у меня нет, у нас в городе они были как первые образцы, это ведь было почти 16 лет назад. Одеяло нам удалось купить, а прибор брали на время.
С пожеланиями здоровья, Елена и Александр, родители троих детей и бабушка с дедушкой двух внуков.
С уважением, Александр.
Гемолитические анемии у детей – это группа разных по патогенезу заболеваний, главным признаком которых является уменьшение продолжительности жизни эритроцитов, развитие их гемолиза. Клиническая картина имеет общие симптомы: возникновение желтухи, спленомегалии, реже гепатомегалии, тёмное окрашивание мочи. Для лабораторных исследований характерно снижение гемоглобина, ретикулоцитоз, повышение уровня билирубина (в основном за счет непрямой фракции), повышение ЛДГ, уробилиногена мочи. Метод лечения зависит от этиологии анемии: возможна медикаментозная терапия, проведение гемотрансфузий, спленэктомия при гиперспленизме.
Общие сведения
Гемолитические анемии – это эритроцитопатии, при которых имеет место стойкое или массированное преобладание разрушения эритроцитов над их образованием. Среди всех анемий у детей встречаются в 11,5% случаев, в 5,3% ‒ от общего числа заболеваний крови. В числе больных незначительно преобладают лица мужского пола. Чаще диагностируются наследственные формы (76,6%) и особенно – наследственная сфероцитарная гемолитическая анемия (56,4%). Некоторые формы связывают с этнической принадлежностью: талассемия характерна для азиатов, жителей Кавказский республик, побережья Средиземного моря; серповидноклеточная анемия – для лиц негроидной расы, дефицит Г-6-ФД – для представителей еврейской национальности. Гемолитическая болезнь плода на территории РФ встречается у 0,6% новорожденных.
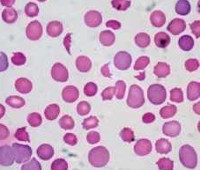
Гемолитическая анемия у детей
Причины
Этиология у наследственных и приобретенных гемолитических анемий различна. При наследственных анемиях патологии в строении эритроцитов запрограммированы на генетическом уровне: известно 16 вариантов с аутосомно-доминантным типом наследования, 29 – с рецессивным, 7 разновидностей – с Х-сцепленным. Все причины, которые приводят к гемолизу, разделяются на внеклеточные и внутриклеточные.
Внеклеточные причины типичны для анемий приобретенного характера. В этом случае эритроциты дефектов не имеют, а разрушаются под воздействием внешних факторов: ретикулоэндотелиальной гиперактивности (гиперспленизм), механических и химических нарушений целостности эритроцитов, иммунологических отклонений (под воздействием антител), паразитарной инвазии, витаминодефицита, некоторых инфекций. Внутриклеточные причины гемолиза – это нарушение структуры и функций эритроцитов, такие как дефекты эритроцитарного метаболизма, строения гемоглобина, мембран клеток.
Патогенез
В патогенезе наследственных гемолитические анемии главную роль играет внесосудистый гемолиз – разрушение эритроцитов происходит в клетках ретикулоэндотелиальной системы. Высвобождаемый гем распадается до несвязанного билирубина. В печени такое количество билирубина не может полностью связаться с глюкуроновой кислотой, развивается гипербилирубинемия. Клинически проявляется нарастанием желтухи, формированием у детей в раннем возрасте камней желчного пузыря, содержащих билирубинат кальция. В кишечнике билирубин метаболизируется в уробилин, избыток которого окрашивает мочу в темный цвет. Гиперактивность селезенки приводит к увеличению ее размеров с развитием гиперспленизма.
Внутрисосудистый гемолиз возникает при приобретенных гемолитических анемиях. Происходит распад эритроцитов в кровотоке, высвободившееся количество гемоглобина не связывается полностью с гаптоглобином в плазме, вследствие чего развивается гемоглобинурия. Избыток гемосидерина, который образуется в селезенке, почках, печени, способствует развитию гемосидероза данных органов и нарушению их функции. Компенсаторное усиление эритропоэза вызывает ретикулоцитоз. Гиперплазия костного мозга ведет к деформации черепа и скелета у детей.
Классификация
Общепринятая классификация гемолитических анемии у детей предложена Идельсоном Л.И. в 1975 году. Согласно ей выделяются две основные группы: наследственные и приобретенные, в каждой из которых обозначаются этиопатогенетические формы. Наследственные анемии классифицируются по локализации генетической аномалии, которая приводит к неполноценности эритроцитов. К ним относятся:
- Мембранопатии. Гемолитические анемии связаны с дефектами белковых и липидных комплексов мембран эритроцитов: врожденная эритропоэтическая порфирия, наследственные эллиптоцитоз и сфероцитоз – болезнь Минковского-Шоффара.
- Ферментопатии. Гемолиз обусловлен дефицитом эритроцитарных ферментов, которые обеспечивают пентозо-фосфатный цикл, гликолиз, синтез АТФ и порфиринов, обмен нуклеотидов и глютатиона.
- Гемоглобинопатии. Патологические состояния, вызванные структурными нарушениями гемоглобина и изменением синтеза его цепей: талассемия, серповидноклеточная анемия, эритропорфирия.
Приобретенные гемолитические анемии связаны с влиянием различных факторов, которые способствуют гемолизу в сосудистом русле и в органах ретикулоэндотелиальной системы. Среди них выделяют:
- Иммунные формы. Причиной гибели эритроцитов является выработка к ним антител. При изоиммунном варианте в организм проникают антиэритроцитарные антитела (гемолитическая болезнь новорожденных) или попадают красные кровяные клетки, к которым у больного есть сенсибилизация (посттрансфузионные анемии). Для гетероиммунных форм характерна фиксация на эритроцитах медикаментозных препаратов (пенициллины, сульфаниламиды, хинидин) или вирусов, что делает их антигеном. Аутоиммунные анемии вызваны образованием антител к собственным нормальным эритроцитам при онкологических заболеваниях, лимфолейкозе, миеломной болезни, системной красной волчанке, а также выработкой тепловых и холодовых антител.
- Механические формы. Гемолиз вызван механическим разрушением эритроцитов. Прямое повреждение возможно искусственными сердечными клапанами, паразитарной инвазией (малярийный плазмодий, токсоплазма), бактериальными токсинами (β-гемолитический стрептококк, менингококк), ядами змей, насекомых. При маршевой гемоглобинурии и анемии спортсменов после длительной интенсивной нагрузки гемолиз происходит в капиллярах нижних конечностей. Гиперспленизм является причиной разрушения нормальных эритроцитов в селезенке.
Симптомы
Клиническая картина, развивающаяся при разных типах гемолиза, имеет общие черты. Для приобретенных гемолитических анемий характерно острое нарастание симптоматики. Большинство наследственных анемий протекает хронически с периодическими гемолитическими кризами. Для развития криза необходимо воздействие триггера: переохлаждения, употребления токсичных препаратов, инфекционного заболевания. Первыми симптомами являются общая слабость, лихорадка, диспепсические расстройства, головная боль. В дальнейшем нарастают признаки билирубиновой интоксикации: иктеричность слизистых оболочек и желтушность кожи; появляются тяжесть, дискомфорт в верхних отделах живота из-за гепато- и спленомегалии, потемнение мочи – от розового до почти черного цвета. На фоне анемизации нарастает бледность с восковидным оттенком, появляются ощущения сердцебиения и перебоев в работе сердца. В тяжелых случаях развивается олигурия (уменьшение количества выделяемой мочи) и анурия, вплоть до шока.
Для наследственных форм характерно выявление стигм дизэмбриогенеза: челюстных и зубных деформаций, гиперхромии радужки, «башенного» черепа, западения переносицы, «готического» нёба; в анамнезе есть указания на гемолитические состояния у родственников, отягощена наследственность по желчнокаменной болезни. Клиническая картина изоиммунных анемий при конфликте «мать-плод» зависит от причины конфликта (резус-фактор, группа крови и другие). Высокий титр антител и их непосредственное влияние на плод на 20-29 неделе гестации приводят к водянке плода, попадание к плоду антител антенатально (после 29 недели) или в момент родов – к развитию гемолитической болезни.
Осложнения
При разных гемолитических анемиях возможны типичные только для них осложнения. Новорожденные с тяжелой гипербилирубинемией, вызванной наследственными формами, угрожаемы по развитию ядерной желтухи. К трем-четырем годам есть риск возникновения холестаза, хронического гепатита, цирроза печени. Большое количество гемотрансфузий у лиц с тяжелым течением способствует гемосидерозу селезенки, костного мозга, печени. Инфицирование парвовирусом В19 больных талассемией, серповидно-клеточной анемией ведет к фатальным последствиям – развитию арегенераторного криза. Для всех гемолитических состояний грозными осложнениями являются диссеминированное внутрисосудистое свертывание, острая сердечная и почечная недостаточность, анемическая кома.
Диагностика
Диагностика гемолитических анемий в педиатрии имеет некоторые особенности. После 12 месяцев в крови ребенка исчезают черты, характерные для неонатального типа кроветворения: макроцитоз, фетальный гемоглобин, пониженная минимальная осмотическая стойкость эритроцитов, нестабильность уровня ретикулоцитов. Поэтому точное типирование гемолитической анемии возможно только после этого возраста. В диагностике принимают участие педиатр и детский гематолог. В план обследования должны быть включены:
- Сбор анамнеза и общий осмотр. Выясняется этническая принадлежность, наличие у родственников гемолитических анемий, желчнокаменной болезни, история беременности и родов матери, группа крови, резус-фактор родителей. Педиатр осматривает ребенка на предмет выявления желтухи, типичной бледности, стигм дизэмбриогенеза; проводит пальпацию живота для выявления гепато-, спленомегалии, аускультацию сердца с целью выслушивания систолического шума на верхушке сердца, учащения сердцебиения.
- Клинические анализы. Общий анализ крови проводится с определением морфологии эритроцитов, лейкоцитов и тромбоцитов. При исследовании выявляются снижение гемоглобина, атипичные формы эритроцитов (при мембранопатиях и гемоглобинопатиях), наличие ретикулоцитов (как признака напряжения эритропоэза), тельца Гейнца-Эрлиха (при дефиците Г6ФД), повышение СОЭ. В общем анализе мочи отмечается повышение уробилина, гемоглобинурия.
- Биохимия крови. Для биохимического анализа типичны гипербилирубинемия, повышение ЛДГ, при внутрисосудистом гемолизе – гипергемоглобинемия, гипогаптоглобинемия. Прямая проба Кумбса (прямой антиглобулиновый тест) положительна при наличии аутоантител к поверхности эритроцитов, характерных для иммунных гемолитических анемий. Но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА или IgM- аутоантителами, проба может быть отрицательной.
- Инструментальные методы. УЗИ либо КТ органов брюшной полости с высокой точностью определяют увеличения размер печени, селезенки, их структуру, состояние желчевыводящей системы. Трепанобиопсия костного мозга проводится с целью определения типа эритропоэза (нормо-, мегало- или сидеробластный), а также исключения патологии со стороны костного мозга (апластическая анемия, лейкоз, метастатическое поражение при злокачественных образованиях).
Специфические методы исследования. Определение длительности жизни эритроцитов может проводиться методами дифференциальной агглютинации, продукции угарного газа, проточной цитометрией (клеточное биотинилирование и др.), прямыми радиоизотопическими исследованиями. Генетические исследования и определение мутаций уточняют причины наследственного гемолиза.
Лечение
Лечение гемолитической анемии проводится в стационарных условиях, под наблюдением педиатра, гематолога, при переливаниях крови – трансфузиолога. Лечебный подход зависит от тяжести состояния пациента, периода заболевания (гемолитический криз или ремиссия), причины возникновения гемолиза. Методы терапии можно объединить в следующие группы:
- Медикаментозная терапия. Назначается как этиотропно, так и симптоматически. При увеличении селезенки и гепатомегалии применяют глюкокортикоидные гормоны. Аутоиммунные анемии требуют назначения цитостатиков, эритропоэтина. При дефиците фолатов назначают цианокобаламин и фолиевую кислоту. Гемолитический криз требует инфузионной терапии, снятия симптомов интоксикации. Для выведения избытка железа больным проводятся курсы хелаторной терапии (десферал). Во многих случаях с профилактической целью используются желчегонные средства.
- Гемотрансфузии. Переливание компонентов крови проводят в стационарных условиях при выраженной анемии по жизненным показаниям. Трансфузия эритроцитарной массы осуществляется строго по индивидуальному подбору, предпочтительно использовать отмытые и размороженные эритроциты. Длительная гемотрансфузионная терапия может осложниться избыточным отложением железа в тканях.
- Хирургическое лечение. Спленэктомия – хирургическое удаление селезенки – используется при спленомегалии, если лекарственная терапия не имеет эффекта. Метод особенно эффективен при гиперспленизме, когда секвестрация эритроцитов происходит в селезенке. При гемолитических анемиях часто развивается холелитиаз, который требует оперативного удаления желчного пузыря (холецистэктомии) или экстракции конкремента из желчных путей.
Прогноз и профилактика
Прогноз при гемолитических анемиях у детей зависит от этиологического фактора. Приобретенные формы и большинство наследственных имеют благоприятный исход при своевременно начатом лечении и соблюдении мер профилактики. В качестве системы питания используется диета №5 по Певзнеру, предназначенная для снижения нагрузки на билиарный тракт. Необходим охранительный режим: избегание перегрева и переохлаждений; исключение контактов с инфекционными больными; ознакомление со списком препаратов и веществ, которые могут вызвать гемолиз (хинин, сульфаниламиды, левомицетин, аспирин, нитрофураны и прочие); определение показаний и строгих противопоказаний к вакцинации (при дефиците глюкозо-6фосватдегидрогеназы, аутоиммунных анемиях иммунизация запрещена, при сфероцитозе – рекомендована).
Гемолитическая болезнь новорожденных (ГБН) – явление, встречающееся у 0,6% родившихся детей. Несмотря на то, что современная медицина обладает широкими возможностями лечения даже самых тяжелых заболеваний, на сегодняшний день детская смертность от этой патологии составляет около 2,5%. К сожалению, большинство родителей не догадываются о том, что собой представляет ГБН. Знание причин возникновения гемолитической болезни новорожденных, основных ее проявлений и способов терапии позволит избежать тяжелых последствий и в ряде случаев сохранить жизнь младенца.
Что такое гемолитическая болезнь?
Гемолитической болезнью новорожденных называют явление, характеризующееся распадом эритроцитов в организме родившегося ребенка в результате иммунологического конфликта матери и плода. В отличие от физиологической желтухи новорожденных, которая встречается у 80-90 % младенцев и легко поддается излечению, для гемолитической желтухи новорожденных свойственно исключительно тяжелое течение, в большинстве случаев заканчивающееся гибелью ребенка.
Какие причины приводят к развитию болезни?
К причинам развития гемолитической болезни новорожденных относится несовместимость иммунных систем матери и плода. Происходит это чаще всего в результате конфликта крови мамы и малыша по резус-фактору (Rh). В более редких случаях в основе возникновения заболевания находится несочетаемость групп крови женщины и ребенка. В ряде ситуаций патология возникает по причине конфликта антигенов, не связанных с перечисленными факторами.
Классификация по формам
В зависимости от характера иммунологического конфликта заболевание делится на 3 формы. К ним относится гемолитическая болезнь новорожденных, возникшая в результате несоответствия:
- группы крови матери и ребенка (по системе АВО);
- их резус-факторов;
- антигенов по другим, более редким причинам.
Наряду с этим выделяют отечную, желтушную и анемичную клиническую форму заболевания. Существует также классификация ГБН по степени тяжести, в соответствии с которой болезнь может иметь легкую, среднетяжелую и тяжелую форму.
Желтуха по группе крови
ГБН в этом случае возникает, когда мама имеет 0(I), а ребенок А(II) или В(III). Наиболее часто иммунологический конфликт происходит у женщины с 0(I) и плода с А(II). Вероятность развития такого рода несовместимости повышается с каждой последующей беременностью. Во время вынашивания первого ребенка данная ситуация может произойти, если у матери существует скрытая сенсибилизация, возникшая до зачатия.
Приобретенная организмом повышенная чувствительность к аллергенам может развиться в результате вакцинации, тяжелых инфекционных патологий, переливаний крови. ГБН, возникшая из-за несовместимости группы крови матери и ребенка, в отличие от других форм болезни протекает достаточно легко. Такая клиническая картина связана со следующими моментами:
- формирование достаточной иммунизации у женщины требует большого количества плодной крови;
- в отличие от D-антигена, А- и B-антигены содержатся не только в эритроцитах, но и в околоплодных водах, тканях плаценты и плода, что способствует нейтрализации большей части антител матери.
Гемолитическая болезнь по резус-фактору
Вероятность развития ГБН в результате несочетаемости резус-факторов мамы и малыша возрастает с каждой последующей беременностью. Этот конфликт происходит, как правило, в тех случаях, когда женщина имеет Rh-, в то время как ребенок унаследовал от отца Rh+. Данное явление в медицине носит название «резус-конфликт».
Развитию желтушной формы гемолитической болезни новорожденных способствует наличие в анамнезе у матери:
- одного или нескольких прерываний беременности;
- выкидышей;
- вынашивания и рождения ребенка с Rh+;
- переливаний крови;
- отслойки плаценты;
- осложнений в процессе вынашивания в виде отеков, наличия белка в урине, повышения давления;
- тяжелых инфекционно-воспалительных патологий;
- инфицирования околоплодных вод;
- трансплантаций органов или тканей;
- гемолитической болезни новорожденных во время предыдущих родов.
Желтуха новорожденных по системе АВО
Согласно системе АВО, существует 4 группы крови, которые характеризуются присутствием либо отсутствием агглютиногенов А и В на поверхности эритроцитов, и агглютининов альфа (α) и бета (β) в плазме крови. Иммунная система синтезирует агглютинины в плазме против тех агглютиногенов, которые отсутствуют на поверхности эритроцитов. Если на ней присутствуют агглютиногены А, тогда в плазме крови будут находиться агглютинины бета.
Одноименные агглютиногены и агглютинины не могут содержаться в крови одного и того же человека, поскольку их взаимодействие приводит к гибели эритроцитов. Возможны следующие сочетания агглютиногенов и агглютининов:
- Если на поверхности эритроцитов отсутствуют агглютиногены, в плазме крови будут находиться агглютинины альфа и бета. Данное сочетание соответствует 0 (I).
- Комбинация агглютиногена А с агглютинином бета характерна для А (II).
- При взаимодействии агглютиногена В с агглютинином альфа получается В (III).
- Для АВ (IV) свойственно присутствие на поверхности эритроцитов обоих агглютиногенов при отсутствии агглютининов.
Конфликт крови матери и ребенка развивается следующим образом: при зачатии происходит формирование системы «женщина – плацента – плод». Именно с помощью плаценты осуществляется взаимодействие мамы с малышом во время беременности. Благодаря этому эмбриональному органу их кровь никогда не взаимодействует. Однако в силу различных причин в кровь женщины могут проникать клетки из кровотока плода, что провоцирует возникновение конфликта по системе АВО.
Во время родовой деятельности целостность плаценты нарушается, в результате чего происходит смешивание крови матери и ребенка с риском возникновения их несовместимости.
Это явление исключено у женщины с АВ (IV), поскольку в ее плазме отсутствуют агглютинины альфа и бета. Наиболее вероятен конфликт у матери с 0 (I) и ребенка с А (II), В (III) или АВ (IV).
Женщина с I группой крови обладает обоими видами агглютининов. Несовместимость исключена лишь в том случае, когда ребенок имеет такую же группу крови без агглютиногенов. При попадании в кровь новорожденного агглютинины матери атакуют его эритроциты, в результате чего они разрушаются, выделяя при этом непрямой билирубин. По той же схеме отторжение происходит при других сочетаниях.
Основные симптомы
Каждая клиническая форма заболевания имеет определенные симптомы. Для отечного вида патологии, являющегося самым тяжелым из всех, характерны следующие проявления:
- бледность кожных покровов и слизистых оболочек;
- обширные отеки подкожной клетчатки и мягких тканей;
- надутый живот из-за увеличенной печени и селезенки;
- желтоватый оттенок околоплодных вод и пуповины;
- низкая оценка по шкале Апгар;
- мышечная гипотрофия;
- глухие тоны сердца;
- нарушение работы дыхательных органов;
- сердечная недостаточность;
- замедленные рефлексы;
- тяжелая анемия;
- скопление жидкости в брюшной полости и предсердной сорочке.
Отечная гемолитическая желтуха нередко приводит к выкидышам, мертворождению и гибели детей. К симптомам анемической формы заболевания относятся:
- анемия;
- бледность кожных покровов;
- отсутствие либо слабо выраженная желтуха;
- одновременное увеличение селезенки и печени;
- незначительное повышение уровня билирубина в крови.
Этот вид патологии протекает легче всего, при этом общее самочувствие малыша остается удовлетворительным. Самой распространенной формой заболевания является желтушная ГБН. Тяжесть проявлений и прогноз зависят от активности разрушения эритроцитов. Распознать этот тип болезни можно по следующим признакам:
- насыщенный желтый оттенок кожных покровов и слизистых оболочек вследствие чрезмерного скопления в кровотоке желчного пигмента билирубина и его производных;
- недостаток красящего пигмента и красных телец в единице объема крови;
- сильное увеличение размеров селезенки и печени;
- развитие желтухи сразу после рождения ребенка либо в течение первых суток – этот процесс со временем прогрессирует;
- вялость — чем больше накапливается билирубин в крови, тем более безжизненным выглядит ребенок;
- угнетение рефлексов;
- мышечная гипотрофия;
- увеличение на 3-4 сутки концентрации токсичного билирубина до критической отметки – более 300 мкмоль/л.
При поражении подкорковых ядер головного мозга патология приобретает ядерную форму. Проявляется это состояние в виде:
- повышения тонуса мышц затылка;
- судорожной позы с тоническим сокращением мышц конечностей, спины и шеи;
- пронзительного «мозгового крика»;
- симптома заходящего солнца.
По прошествии 7 дней кожные покровы приобретают зеленоватый оттенок, каловые массы становятся бесцветными, увеличивается уровень прямого билирубина. Чем раньше возникает у новорожденного желтуха, тем тяжелее течение ГБН.
Диагностика
Существует дородовая диагностика несовместимости иммунной системы матери и плода. В группе риска находятся пациентки, имеющие в анамнезе самопроизвольное прерывание беременности, мертворождение, а также те женщины, чьи дети умерли от ГБН в первые сутки после рождения. Кроме того, вероятность развития этой патологии у ребенка велика в том случае, если матери делали переливание крови без учета резус-фактора. Дородовое диагностирование включает следующие мероприятия:
- Определение группы крови и резус-фактора родителей. Женщина находится в группе риска, если она имеет Rh-, а у плода выявлен Rh+. При этом сопоставляют генотип мужчины с прогнозом Rh будущих детей. Наряду с этим ГБН может быть выявлен у ребенка, чья мать имеет 0 (I).
- Проверяется динамика титра антител с противоположными резус-факторами. Женщину, имеющую Rh-, обследуют минимум трижды в течение всего срока вынашивания ребенка.
- При наличии вероятности развития у малыша патологии, на 34 неделе беременности производится забор околоплодной жидкости.
- Плацента обследуется с помощью ультразвукового исследования на предмет утолщения и многоводия.
- В обязательном порядке осуществляется кардиотокография и допплерометрия плода.
После рождения ребенка также проводится диагностирование на основании клинически проявленных симптомов в процессе родовой деятельности и сразу после ее окончания. Назначается консультация детского гематолога, который будет курировать лечение выявленного заболевания. К лабораторным способам исследования в этом случае относятся:
- контроль уровня билирубина и глюкозы в крови ребенка в динамике;
- определение группы крови и резус-фактора;
- иммунологические исследования на наличие антител в крови младенца и матери, а также в грудном молоке.
Лечение
Лечение гемолитической болезни новорожденных включает консервативные и хирургические способы. Лечебная тактика зависит от тяжести состояния ребенка и уровня билирубина.
При относительно легком течении болезни применяют следующие терапевтические методы:
- Инфузионная терапия. В кровоток малыша капельно вводятся питательные (глюкоза с витамином В, физраствор, раствор Рингера) и детоксикационные средства («Гемодез», «Полиглюкин»). Данная мера позволяет устранить интоксикацию детского организма билирубином и ускоряет выведение этого желчного пигмента.
- Фототерапия (светолечение). Процедура заключается в помещении младенца под специальную флуоресцентную лампу белого или синего цвета. Облучение способствует окислению токсичного билирубина, после чего образовавшиеся из него водорастворимые вещества выводятся из организма естественным образом.
- Медикаментозная терапия. Используются лекарственные средства, направленные на активацию ферментной функции печени, например, «Зиксорин». Также применяются препараты с абсорбирующими свойствами («Карболен», агар-агар). Желчегонные средства в организм малыша вводятся с помощью электрофореза. При лечении ГБН использование витаминов Е, С, В является обязательным. Наряду с этим применяются стабилизаторы мембран тучных клеток, гепатопротекторы («Эссенциале») и препараты с гемостатическим эффектом («Адроксон»).
Продолжительность лечения патологии имеет индивидуальный характер. В большинстве случаев при легком течении болезни ее признаки исчезают на 7-8 день жизни младенца. Выписка из родильного дома происходит лишь в случае удовлетворительного состояния малыша. Тяжелое течение заболевания, при котором его симптомы плохо поддаются фототерапии, либо осложненная ГБН предполагают дальнейшее обследование и лечение в условиях детской больницы.
Современная медицина располагает возможностями терапии еще не родившегося ребенка. Если во время его вынашивания подтвержден диагноз ГБН, при этом выявлена выраженная анемия, а также существует угроза здоровью и жизни плода, то переливание крови ему делают еще до рождения. Однако эта процедура выполняется далеко не в каждом родильном доме.
Переливание крови
В случае тяжелых проявлений заболевания прибегают к оперативному лечению, которое представляет собой заменное (обменное) переливание крови. Показаниями к его применению являются:
- показатели билирубина более 68 мкмоль/л, более 170 мкмоль/л в 1день жизни младенца, 256 мкмоль/л на 2 день, 340-400 мкмоль/л на 3 сутки после рождения;
- тяжелая анемия;
- быстрый прирост гипербилирубинемии – больше чем на 6-8 мкмоль/л в час;
- реакция Кумбса.
Суть этого способа лечения заключается в следующем. Кровь ребенка, содержащая готовые к разрушению эритроциты, через пупочную вену практически полностью заменяется донорским биоматериалом, который не содержит конфликтный антиген и способен противостоять действию антител матери. Для заменного переливания ребенку с Rh+ подбирается донор с Rh-. Это значит, что в результате замены крови в детский организм не попадут эритроциты с Rh+, которые могут разрушиться антителами, циркулирующими по его кровяной системе. В этом случае малыш получит устойчивые к действию антител матери эритроциты с Rh-.
В тяжелых ситуациях однократного переливания бывает недостаточно, поэтому процедуру проводят повторно. Одновременно с этим требуется дезинтоксикация организма. С этой целью с помощью пищевого зонда внутрь вводится жидкость. Также осуществляется внутривенное введение глюкозы, плазмы, раствора «Альбумин».
Возможные осложнения
Последствия описываемого заболевания зависят от характера его течения. При развитии тяжелой формы ГБН нередко заканчивается смертью плода в последние месяцы беременности либо гибелью ребенка в течение первых 7 дней жизни.
Данная патология может привести к возникновению следующих осложнений:
- врожденной инвалидности;
- задержки психомоторного развития;
- реактивного гепатита, сопряженного с воспалительными процессами в печени и застоем желчи;
- детского церебрального паралича;
- тугоухости;
- нарушения зрения, вплоть до полной слепоты;
- развитию психовегетативного синдрома, сопровождающемуся психическими заболеваниями;
- тревожных состояний, депрессивных расстройств, нарушений сна и пищевого поведения.
Перенесенная детьми старшего возраста болезнь может привести к развитию склонности к частым заболеваниям, неадекватным реакциям на вакцинацию, возникновению аллергии. У детей в подростковом периоде выявляется снижение работоспособности, апатичные и тревожные состояния.
Профилактические меры
Если заболевание развивается в результате несовместимости по системе АВО, его практически невозможно предупредить. Чего нельзя сказать про ГБН, возникающую вследствие конфликта Rh. В этом случае существуют определенные меры профилактики, которые закреплены в соответствующих нормативных актах. Эти профилактические мероприятия делятся на 2 вида:
- Неспецифические. Подразумевают профилактику абортов и невынашивания, иными словами, других, отличных от естественных исходов первой беременности у женщин с Rh-. При этом важно, чтобы до рождения ребенка не было случаев прерывания беременности, поскольку это увеличивает риск развития у него ГБН.
- Специфические. Заключаются во введении женщине с Rh- после первого аборта или выкидыша антирезусного иммуноглобулина, что позволяет защитить ребенка, которого она будет вынашивать при последующей беременности, от антител, не позволив им сформироваться.
При окончании первой беременности у женщины с Rh-родами, определяется резус-принадлежность ребенка. Если он имеет Rh+, маме также вводят иммуноглобулин. Если у младенца выявляют Rh-, препарат не назначается в силу невозможности образования антител.
Современная медицина обладает возможностями введения иммуноглобулина женщине с Rh- во время вынашивания ребенка. Если отец имеет Rh+, при этом отсутствуют материнские антитела, на сроке 28 и 34 недели будущей матери может быть введен антирезусный иммуноглобулин. В это
