Лекарства вызывающие гемолитическую анемию

Лекарственная иммунная гемолитическая анемия составляет около 20% от
всех приобретенных иммунных гемолитических
анемий .При большинстве других лекарственных иммунных гемолитических
анемий антитела направлены против комплекса лекарственное
средство-мембранный гликопротеид. Гемолиз
наблюдается только во время приема препарата и обычно быстро прекращается
после его отмены.
Бензилпенициллин (и
другие пенициллины ) вызывает такой
гемолиз при введении в высоких дозах (10 млн ед/сут и более). Он довольно
прочно связывается с мембраной эритроцита. Комплемент обычно не
фиксируется, и гемолиз редко бывает тяжелым. Антитела, как правило,
относятся к классу IgG ,
поэтому возможны микросфероцитоз и
усиленное разрушение эритроцитов в селезенке.
Большинство других
препаратов (например, хинин , хинидин , сульфаниламиды , производные сульфанилмочевины , фенацетин , стибофен ,
метамизол ) прикрепляются к мембране не столь прочно и при отмывании
эритроцитов в процессе прямой и непрямой проб
Кумбса удаляются вместе с антителами. Правда, большинство этих антител
способны фиксировать
комплемент (особенно
IgM ). Его компоненты остаются на поверхности эритроцита после
отмывания, поэтому прямая проба Кумбса положительна с антикомплементарной,
но не с антиглобулиновой сывороткой. Непрямая проба Кумбса положительна
только в присутствии лекарственного средства.
Гемолиз может быть довольно тяжелым, временами внутрисосудистым , но обычно быстро
проходит после отмены препарата.
Патогенез см.
табл. 16.3 .
Образование иммунных комплексов. Иммунные комплексы,
состоящие из лекарственного средства и антитела, неспецифически связываются
с мембранами эритроцитов с последующей активацией комплемента. Прямая проба Кумбса с
антителами к комплементу обычно положительна, а с антителами к IgG –
отрицательна. Антитела к препарату можно обнаружить с помощью инкубации
сыворотки больного с нормальными эритроцитами в присутствии комплемента и
данного препарата. Большинство случаев лекарственной иммунной
гемолитической анемии обусловлены именно этим механизмом ( табл.16.3 ). Повторное назначение препарата даже в
небольшой дозе вызывает острый
внутрисосудистый гемолиз , проявляющийся
гемоглобинемией , гемоглобинурией ,
острой почечной недостаточностью .
Образование цитотоксических антител . При
связывании с эритроцитами препарат становится иммуногенным и стимулирует
образование антител, обычно IgG. Положительная лишь прямая проба Кумбса с
антителами к иммуноглобулинам . Антитела к
препарату определяют следующим образом. После инкубации нормальных
эритроцитов с этим препаратом их смешивают с сывороткой больного. При
наличии антител к препарату развивается гемолиз
. Классическим примером иммунной гемолитической анемии, вызванной
цитотоксическими антителами, служит анемия при
применении бензилпенициллина . Она возникает редко и только при
назначении препарата в высоких дозах (более 10 млн. ед./сут в/в): прямая
проба Кумбса с антителами к иммуноглобулинам положительна примерно у 3%
больных, гемолиз развивается еще реже. Появление IgG к бензилпенициллину не
связанно с аллергией к пенициллинам ,
обусловленной IgE.
Некоторые лекарственные средства, например цефалоспорины , вызывают агрегацию
неспецифических IgG и комплемента, хотя это редко сопровождается
гемолитической анемией. Прямая проба Кумбса может быть положительной, непрямая проба Кумбса всегда отрицательна.
Образование аутоантител. Лекарственные средства могут стимулировать
образование аутоантител к антигенам
системы Rh . Вероятно, это происходит за счет угнетения активности
Т-супрессоров пролиферации клонов В-лимфоцитов, продуцирующих
соответствующие антитела. Прямая проба Кумбса с антителами к
иммуноглобулинам положительна. Инкубация сыворотки больного с нормальными
эритроцитами в отсутствии лекарственного средства приводит к абсорбции IgG
на эритроцитах. Синтез аутоантител к эритроцитам вызывают метилдофа , леводофа и мефенамовая кислота . Прямая проба Кумбса
положительна примерно у 15% больных, принимающих метилдофу, однако
гемолитическая анемия развивается менее чем у 1% больных. Влияние метилдофы
на образование аутоантител к эритроцитам, по-видимому, дозозависимо. Анемия
развивается постепенно, в течение нескольких месяцев применения препарата,
и обусловлена внесосудистым гемолизом.
Лечение. Первый и наиболее
важный этап лечения лекарственной иммунной гемолитической анемии – отмена
препарата, вызвавшего ее. При гемолизе, вызванном иммунными комплексами,
после этого быстро наступает выздоровление. В тяжелых случаях наблюдается
острая почечная недостаточность .
При гемолизе, вызванном аутоантителами, выздоровление более медленное
(обычно несколько недель). Проба Кумбса может оставаться положительной в
течение 1-2 лет.
Лекарственные средства, вызывающие иммунную
гемолитическую анемию, в зависимости от механизма действия делят на две
группы.
К первой относятся
метилдофа (гипотензивное средство) и некоторые другие препараты; они
вызывают заболевание, почти идентичное
аутоиммунной гемолитической анемии с тепловыми антителами .
Ко
второй группе относятся препараты, способные связываться с поверхностью
эритроцита как гаптены и стимулировать образование антител к комплексу
эритроцит-лекарственное средство. Одни из них, например пенициллины , довольно прочно связываются с
мембранным белком, другие, например
хинидин , – слабо. Препаратов, действующих подобно хинидину, –
большинство.
Положительная прямая проба
Кумбса наблюдается почти у 10% больных, получающих метилдофу в суточной дозе 2 г и более. У
отдельных больных развиваются
микросфероцитоз и гемолиз , в ряде случаев
тяжелый. Эта гемолитическая анемия обусловлена, вероятно, тем, что
метилдофа повреждает белки системы Rh ,
вследствие чего они становятся иммуногенными . Антитела к
ним перекрестно реагируют с нормальными антигенами системы Rh. Антитела не
реагируют с самой метилдофой, и непрямая проба Кумбса положительна
практически у всех больных, даже когда препарат при исследовании не
добавляют. На эритроцитах обнаруживают IgG , но не СЗ . Гемолиз ослабевает
через несколько недель после отмены препарата, но прямая проба Кумбса может
оставаться положительной дольше года.
Ссылки:
- Проба Кумбса: введение
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для данной группы заболеваний типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Общие сведения
Гемолитическая анемия (ГА) – малокровие, обусловленное нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Данная группа анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных когортах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. Патология характеризуется укорочением жизненного цикла эритроцитов и их распадом (гемолизом) раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
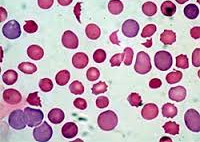
Гемолитическая анемия
Причины
Этиопатогенетическую основу наследственных гемолитических синдромов составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфофункциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды, среди которых:
- Аутоиммунные процессы. Образование антител, агглютинирующих эритроциты, возможно при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии). Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода.
- Токсическое действие на эритроциты. В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Вызывать разрушение клеток крови может прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков).
- Механическое повреждение эритроцитов. Гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.

Гемолитическая анемия
Патогенез
Центральным звеном патогенеза ГА является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. При аутоиммунном механизме анемии происходит образование антиэритроцитарных АТ (тепловых, холодовых), которые вызывают ферментативный лизис мембраны эритроцитов. Токсические вещества, являясь сильнейшими окислителями, разрушают эритроцит за счет развития метаболических, функциональных и морфологических изменений оболочки и стромы красных кровяных телец. Механические факторы оказывают прямое воздействие на клеточную мембрану. Под влиянием этих механизмов из эритроцитов выходят ионы калия и фосфора, а внутрь поступают ионы натрия. Клетка разбухает, при критическом увеличении ее объема наступает гемолиз. Распад эритроцитов сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Классификация
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные. Наследственные ГА включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии – анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные ГА подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные) – обусловлены воздействием антител
- токсические – анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- механические – анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Симптомы
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке. Манифестация микросфероцитарной ГА возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом – обтурационная желтуха. При микросфероцитозе во всех случаях увеличена селезенка, а у половины пациентов – еще и печень. Кроме наследственной микросфероцитарной анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические анемии связаны с недостатком определенных ферментов эритроцитов (чаще – Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет. Особенностям клинического течения гемоглобинопатий – талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных приобретенных вариантов чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер. Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка. При некоторых формах аутоиммунных анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия. Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Осложнения
Каждый вид ГА имеет свои специфические осложнения: например, ЖКБ – при микросфероцитозе, печеночная недостаточность – при токсических формах и т.д. К числу общих осложнений относятся гемолитические кризы, которые могут провоцироваться инфекциями, стрессами, родами у женщин. При остром массивном гемолизе возможно развитие гемолитической комы, характеризующейся коллапсом, спутанным сознанием, олигурией, усилением желтухи. Угрозу жизни больного несут ДВС-синдром, инфаркт селезенки или спонтанный разрыв органа. Неотложной медицинской помощи требуют острая сердечно-сосудистая и почечная недостаточность.
Диагностика
Определение формы ГА на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки. Лабораторный диагностический комплекс включает:
- Исследование крови. Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. При аутоиммунных анемиях большое диагностическое значение имеет положительная проба Кумбса.
- Анализы мочи и кала. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина.
- Миелограмму. Для цитологического подтверждения выполняется стернальная пункция. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, порфирии, гемобластозы. Пациента консультируют гастроэнтеролог, клинический фармаколог, инфекционист и другие специалисты.

Аутоиммунная гемолитическая анемия
Лечение
Различные формы ГА имеют свои особенности и подходы к лечению. При всех вариантах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной анемии выполняется спленэктомия. Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов.
Прогноз и профилактика
Течение и исход зависят от вида анемии, тяжести протекания кризов, полноты патогенетической терапии. При многих приобретенных вариантах устранение причин и полноценное лечение приводит к полному выздоровлению. Излечения врожденных анемий добиться нельзя, однако возможно достижение длительной ремиссии. При развитии почечной недостаточности и других фатальных осложнений прогноз неблагоприятен. Предупредить развитие ГА позволяет профилактика острых инфекционных заболеваний, интоксикаций, отравлений. Запрещается бесконтрольное самостоятельное использование лекарственных препаратов. Необходимо тщательная подготовка пациентов к гемотрансфузиям, вакцинации с проведением всего комплекса необходимых обследований.
