Литература по анемии 2012 года
В статье освещены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий у детей. Представлены основные принципы дифференциальной диагностики и лечения указанных дефицитных анемий у детей.
В настоящей публикации на основании данных литературы и анализа собственных наблюдений представлены клинико-анамнестические и лабораторные особенности железодефицитной, фолиеводефицитной и витамин В12-дефицитной анемий, а также принципы их лечения у детей. Установлено, что основной формой дефицитных анемий (ДА) в педиатрической популяции является анемия, обусловленная недостаточным содержанием в организме железа. При этом особо подчеркивается, что железодефицитная анемия (ЖДА) не только наиболее распространенная ДА, но и самое частое гематологическое заболевание у детей [1–3]. С учетом того, что другие типы анемий (в т. ч. развивающиеся при дефиците таких витаминов, как фолиевая кислота и В12) хуже известны врачам-педиатрам, их верификация, как правило, запаздывает, т. к. они ошибочно принимаются за ЖДА. Поздняя диагностика и отсутствие адекватной терапии при этом приводят к прогрессированию патологических процессов. Это негативно сказывается на росте и развитии детского организма и ухудшает качество жизни ребенка. Принимая во внимание актуальность данной проблемы, авторы пришли к выводу о необходимости представить для практикующих врачей-педиатров ключевые положения дифференциальной диагностики и лечения анемий, обусловленных дефицитом железа, фолиевой кислоты и витамина В12 у детей.
Дифференциальная диагностика ДА у детей
Критерием анемии, независимо от этиологии, является снижение уровня гемоглобина (Hb) ниже возрастной нормы. Так, синдром анемии констатируют, если концентрация Hb в капиллярной крови ниже: 110 г/л — у детей в возрасте от 1 мес. до 5 лет, 115 г/л — у детей 6–12 лет, 120 г/л — у детей старше 12 лет и подростков. Кроме этого, зная уровень Hb, можно определить тяжесть анемического синдрома. Так, для детей, достигших месячного возраста и старше, снижение Нb до 90 г/л является признаком анемии легкой степени, уровень Нb в пределах 70–90 г/л характерен для анемии средней тяжести, а падение Нb ниже 70 г/л определяет тяжелую степень анемии [1–4].
Нозологическая верификация характера анемии проводится на основе анализа клинико-анамнестических данных, результатов лабораторного и, если необходимо, инструментального обследования пациента. Общими клиническими проявлениями анемии, независимо от этиологии, являются повышенная утомляемость, снижение работоспособности, склонность к инфекциям. Среди дополнительных симптомов, которые могут отмечаться при ЖДА, — извращение аппетита и пристрастие к необычным запахам, изменение ногтевых пластин, расслоение ногтей, выпадение волос, атрофия сосочков языка, дисфагия. В свою очередь, при витамин В12-дефицитной анемии имеют место неврологические нарушения (атаксия, парестезии, гипорефлексия и другие проявления фуникулярного миелоза), «лакированный» язык и желтуха. Непрямая гипербилирубинемия может также отмечаться и при фолиеводефицитной анемии (табл. 1).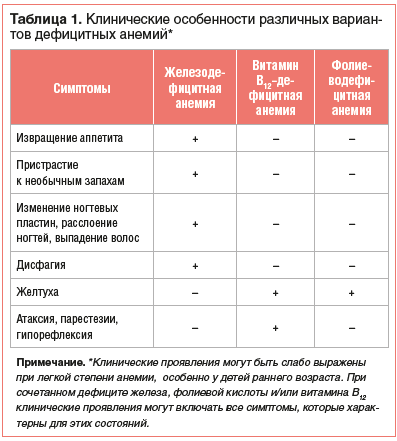
Наличие желтухи и анемии при этом нередко становится причиной ошибочного заключения о гемолитическом характере анемии, если врач не обращает внимания на отсутствие ретикулоцитоза. Следует отметить, что иктеричность при анемиях, обусловленных дефицитом витамина В12 или фолиевой кислоты, связана с неэффективным эритропоэзом и повышенным разрушением предшественников эритроцитов в костном мозге [1–3, 5–7].
Несмотря на описанные выше симптомы, типичные для конкретных ДА, их клинические проявления могут быть слабо выражены при легкой степени анемии, особенно у детей раннего возраста. В связи с этим этиологическая верификация генеза анемического синдрома проводится на основании не только клинических проявлений и анамнестических данных. Обязательным условием установления диагноза является корректная трактовка результатов лабораторного обследования. При этом минимально достаточным уровнем лабораторного обследования является проведение клинического и биохимического анализов крови.
Хорошо известно, что показаниями к исследованию клинического анализа крови для исключения анемии у детей являются анамнестические (недоношенность, задержка внутриутробного развития, исключительно грудное вскармливание ребенка, если мать имеет хронические заболевания кишечника или является вегетарианкой и др.) и/или клинические факторы риска (геморрагический синдром, синдром мальабсорбции, инфекционно-воспалительные заболевания, желтуха, лимфаденопатия, гепато- или спленомегалия и другие патологические состояния). При оценке результатов клинического анализа крови нельзя ограничиваться только поиском лабораторных признаков анемии. Обязательно должны быть проанализированы все параметры гемограммы (эритроциты и их индексы, ретикулоциты, тромбоциты и их индексы, общее количество лейкоцитов, лейкоцитарная формула, а также абсолютное количество нейтрофилов, лимфоцитов, моноцитов и эозинофилов, СОЭ). Это позволяет уже при первичном обращении пациента очертить круг основных причин выявленной анемии и наметить основные диагностические мероприятия для расшифровки генеза заболевания [1–4].
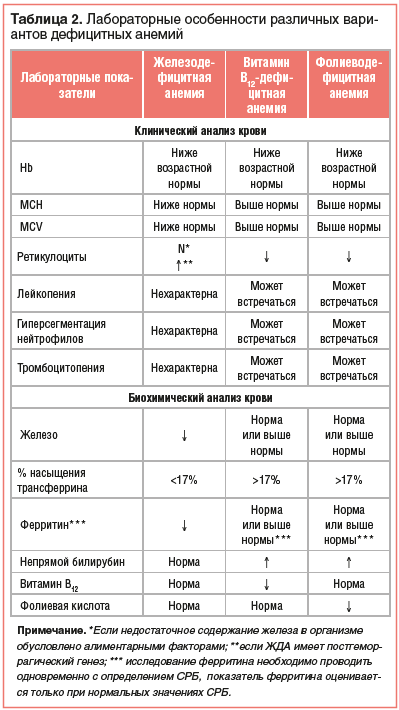
Так, для ЖДА типичными признаками являются: гипохромия и микроцитоз эритроцитов при нормальном уровне ретикулоцитов, если недостаточное содержание железа в организме обусловлено алиментарными факторами или синдромом мальабсорбции. В тех же случаях, когда ЖДА имеет постгеморрагический генез, гипохромия и микроцитоз эритроцитов будут сопровождаться ретикулоцитозом [1–4]. В свою очередь для анемий, обусловленных недостатком в организме как фолиевой кислоты, так и витамина В12, характерны гиперхромия и макроцитоз эритроцитов, а также ретикулоцитопения (табл. 2).
Кроме этого, при фолиево- и витамин В12-дефицитной анемиях могут встречаться лейко- и тромбоцитопения, гиперсегментация нейтрофилов. С учетом того, что в ряде случаев ДА имеет комбинированный генез, при котором дефицит железа сочетается с дефицитом фолиевой кислоты или витамина В12, типичные гематологические признаки могут не выявляться или быть разнонаправленными. Это определяет необходимость обязательного проведения биохимического анализа крови с определением, кроме общепринятых показателей, таких параметров, как железо, железосвязывающая способность, процент насыщения трансферрина, ферритин, фолиевая кислота и витамин В12 [6, 7]. Особо следует подчеркнуть, что ферритин должен определяться вместе с С-реактивным белком (СРБ). При этом оценивать уровень ферритина можно только в тех случаях, когда значения СРБ находятся в пределах нормативных. Это объясняется тем, что ферритин относится к протеинам воспаления и его уровень повышается при воспалительных процессах в организме. В связи с этим нормальный или высокий уровень ферритина при повышенных значениях СРБ может стать причиной ошибочного заключения об отсутствии железодефицитного состояния [2–4]. Особенности биохимического анализа крови при различных вариантах ДА представлены в таблице 2.
Лечение ДА у детей
Корректная трактовка клинико-анамнестических данных и результатов лабораторного обследования позволяет верифицировать причину ДА и своевременно назначить адекватную терапию. Принципиально важным при этом является положение о том, что компенсировать дефицитные состояния невозможно только за счет нормализации рациона питания. Основная роль в купировании дефицита железа, фолиевой кислоты и витамина В12 принадлежит заместительной фармакотерапии [1–7]. При этом для лечения ЖДА используются солевые препараты железа или препараты на основе железа гидроксид полимальтозата. Суточная доза препаратов зависит от массы тела и возраста ребенка, расчет при этом проводится по элементарному железу. Так, для солевых препаратов железа, назначаемых внутрь, используются следующие дозы (расчет по элементарному железу!): для детей до 3 лет — 3 мг/кг/сут, для детей старше 3 лет — 45–60 мг/сут, для подростков —
до 120 мг/сут. При использовании пероральных форм железа гидроксид полимальтозата рекомендованные дозы составляют 5 мг/кг/сут (расчет по элементарному железу!). Продолжительность терапии препаратами железа зависит от степени тяжести ЖДА. При легкой ЖДА курс лечения составляет 3 мес., при среднетяжелой форме — 4,5 мес., при тяжелой — до 6 мес. [3].
В случае диагностики фолиеводефицитной анемии заместительная терапия проводится препаратами фолиевой кислоты. Рекомендовано использовать следующие суточные дозы фолиевой кислоты: для детей до 1 года — 0,25–0,5 мг/сут, для детей старше 1 года — 1,0 мг/сут. При синдроме мальабсорбции доза может быть повышена до 5–15 мг фолиевой кислоты в сутки. Терапия проводится в указанных дозах ежедневно на протяжении 4–6 нед. Через 7 дней от начала лечения необходимо выполнить клинический анализ крови с обязательным подсчетом ретикулоцитов (рис. 1). Повышение уровня ретикулоцитов на фоне приема фолиевой кислоты указывает на правильно установленный диагноз и является обоснованием для продолжения терапии. Купирование анемии достигается через 4–6 нед. от начала лечения [6].
Для лечения витамин В12-дефицитной анемии используют препараты цианокобаламина для парентерального введения. При этом рекомендовано придерживаться следующего режима дозирования: для детей до 1 года — 5 мкг/кг/сут, для детей старше 1 года — 100 мкг/сут, для подростков — 200 мкг/сут. Препарат вводится внутримышечно 1 р./сут ежедневно. На 7–10-й день терапии проводят клинический анализ. Выявление ретикулоцитоза позволяет сделать вывод об эффективности проводимого лечения. Терапию следует продолжить в том же режиме дозирования еще в течение 3–4 нед. В дальнейшем, при достижении нормализации уровня гемоглобина, переходят на поддерживающее лечение: цианокобаламин вводят в терапевтической дозе 1 раз в 7 дней в течение 2 мес., а затем 1 раз в 14 дней в течение 6 мес. (рис. 2). Учитывая, что дефицит витамина В12, как правило, редко обусловлен алиментарными факторами, одновременно проводят поиск причин данного патологического состояния (болезнь Крона, целиакия, инвазия широким лентецом, наследственные нарушения всасывания и/или транспортировки витамина В12 и др.) [7]. В тех случаях, когда имеют место полидефицитные состояния с развитием анемического синдрома, оправданно комбинированное заместительное лечение. Чаще всего у детей встречается сочетанный дефицит железа и фолиевой кислоты, что требует одновременного назначения препаратов железа и фолиевой кислоты.
Заключение
Таким образом, выявление анемии у ребенка определяет необходимость обязательного уточнения причин указанного патологического состояния. Своевременная верификация этиологии анемии позволяет без промедления начать адекватную терапию, что определяет ее эффективность и улучшает качество жизни ребенка. Авторы выражают надежду, что информация, представленная в настоящей публикации, будет полезна практикующим врачам-педиатрам.
Комментарии
Опубликовано в журнале:
«Практика педиатра», октябрь 2011, с. 34-38
М.Н. Снегоцкая, О.Ю. Конопелько, ГБОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздравсоцразвития РФ
В организме новорожденного содержится около 0,5 г железа, а в организме взрослого человека – 5 г. Для того чтобы пополнить запасы в 4,5 г, организм ребенка должен усваивать ежедневно в среднем 0,8 мг микроэлемента в течение первых 15 лет жизни.
Помимо этих потребностей роста, необходимо дополнительное количество железа для того, чтобы компенсировать нормально экскретируемое его количество. Следовательно, для поддержания у ребенка адекватного положительного равновесия железа ежедневно оно должно всасываться в количестве 0,5–1,2 мг. Поскольку абсорбируется всего около 10% алиментарного железа, в диете, обеспечивающей оптимальное питание, его должно содержаться 5–12 мг [1, 2]. Всасывание железа происходит преимущественно в двенадцатиперстной кишке и проксимальных отделах тощей кишки. Степень абсорбции железа зависит как от его количества в потребляемой пище и биодоступности, так и от состояния желудочно-кишечного тракта.
Наиболее частой формой анемии, наблюдаемой в педиатрической практике, является железодефицитная анемия (80%). В отличие от большинства других анемий, железодефицитная анемия (ЖДА) не сопровождаются снижением количества эритроцитов. Эритроциты приобретают типичные морфологические признаки, характерные для железодефицитной анемии: микроцитоз, анизоцитоз, пойкилоцитоз [9]. Постепенно уменьшается насыщение эритроцитов гемоглобином, за счет чего их нормохромия сменяется гипохромией.
Согласно рекомендациям ВОЗ (1989) нижней границей нормы для гемоглобина капиллярной крови следует считать уровень 110 г/л у детей в возрасте до 6 лет и 120 г/л у детей старше 6 лет.
Причины железодефицитных состояний
В новорожденном периоде основной причиной является дефицит железа у матери во время беременности, также осложненное течение беременности, нарушение маточноплацентарного кровообращения, синдром фетальной трансфузии, многоплодная беременность. Интранатальными причинами дефицита железа являются: преждевременная перевязка пуповины, фетоплацентарная трансфузия, интранатальные кровотечения из-за травматичных акушерских пособий, аномалий развития плаценты или пуповины. Среди постнатальных причин следует отметить недостаточное поступление железа с пищей, повышенные потребности в железе у детей с ускоренными темпами роста (недоношенные, дети с большой массой тела при рождении, дети с лимфатическим типом конституции, дети второго полугодия и второго года жизни, дети пре- и пубертатного возраста) [8]. Также в эту группу следует отнести: заболевания желудочно-кишечного тракта; дефицит запасов железа при рождении; анатомические врожденные аномалии кишечника; употребление продуктов, ухудшающих абсорбцию железа [3].
При физиологическом течении беременности доношенный ребенок рождается с запасами железа около 300 мг, полученными внутриутробно от матери в основном в третьем триместре беременности. У недоношенного ребенка низкая масса тела при рождении, низкая концентрация гемоглобина в неонатальном периоде ведет к соответствующему оскудению и так недостаточных (100–200 мг) запасов железа. У недоношенных детей или близнецов резервы железа снижены прямо пропорционально массе при рождении: 75 мг железа на 1 кг массы тела [4].
К ЖДА предрасположены дети, находящиеся на раннем смешанном или искусственном вскармливании с использованием частично адаптированных смесей или неадаптированных молочных продуктов (цельное молоко, кефир), дети с синдромом мальабсорбции, часто болеющие, проживающие в экологически неблагополучных районах, из семей с низким социально-экономическим уровнем.
Патогенез ЖДА
В развитии заболевания определяются три основные звена: нарушение синтеза гемоглобина в результате уменьшения запасов железа, генерализованные нарушения пролиферации клеток и укорочение продолжительности жизни эритроцитов (последнее наблюдается преимущественно при тяжелом дефиците железа) [3, 4].
Уровень иммунной резистентности организма непосредственно зависит от адекватного содержания железа. Оно способствует полноценному функционированию факторов неспецифической защиты, факторов местного клеточного иммунитета, повышает содержание Т-лимфоцитов крови. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка, замедляется становление логического мышления, речи, затрудняется обучение. Установлено, что у детей, имевших в младенчестве железодефицитную анемию, в возрасте 3–4 лет определяются нарушения передачи нервных импульсов от центров головного мозга к органам слуха и зрения изза нарушения миелинизации нервов [10].
Клинические проявления
Один из главных и видимых признаков ЖДА – бледность кожных покровов, слизистых оболочек, конъюнктив глаз. При легко или умеренно выраженном дефиците гемоглобина (60–100 г/л) анемия проявляется весьма скудной симптоматикой. При достижении уровня гемоглобина ниже 50 г/л становятся выраженными раздражительность и анорексия. Появляется слабость, плаксивость, возбудимость детей, снижение общего тонуса организма, потливость, снижение аппетита; снижается острота зрения, нарастает утомляемость. Может наблюдаться регресс моторных навыков [2, 6, 7].
У детей старше года наблюдаются признаки поражения эпителиальной ткани – шершавость, сухость кожи, ангулярный стоматит, хейлит, глоссит или атрофия слизистой оболочки ротовой полости, ломкость и тусклость волос, их выпадение, матовость и ломкость ногтей, разрушение зубов (кариес). Также отмечается отставание в физическом и психомоторном развитии.
В зависимости от степени тяжести заболевания выявляются симптомы поражения органов и систем. Возникает тахикардия, увеличиваются размеры сердца, выслушиваются систолические шумы. Может увеличиваться селезенка. Нередко отмечается вздутие кишечника, диарея, запоры, извращение вкуса [2, 8, 10].
Диагностика
Диагноз ЖДА ставится на основании клинической картины и лабораторных показателей: снижается гемоглобин в крови, цветовой показатель становится ниже 0,8, выявляется гипохромия эритроцитов, микроцитоз и анизоцитоз эритроцитов; в биохимическом анализе крови уровень сывороточного железа уменьшается – 14,8 мкмоль/л и ниже, а общая железосвязывающая способность сыворотки (ОЖСС) увеличивается – 80 мкмоль/л и более; повышается уровнь трансферрина в сыворотке (более 30 мкг/л), при снижении его насыщения железом (менее 15%). Уровень ретикулоцитов в норме [6, 10].
В зависимости от уровня гемоглобина степень тяжести анемии может подразделяться на легкую (<110 г/л), средней тяжести (<100–90 г/л) и тяжелую (<70 г/л) [7].
Дифференциальную диагностику ЖДА проводят с талассемией, отравлением свинцом, анемией при хронических заболеваниях, врожденными нарушениями обмена железа (дефицит трансферрина, нарушение утилизации железа, нарушение реутилизации железа), гемосидерозом, в том числе синдромом Гудпасчера, дефицитом меди [8].
Терапия
ЖДА у детей раннего возраста должно быть комплексным. Важнейшим фактором профилактики дефицита железа является сбалансированное питание, и в первую очередь грудное вскармливание. Хотя содержание железа в грудном молоке невелико (1,5 мг/л), биодоступность его составляет до 60%. Этому способствует особая форма, в которой оно представлено, – железосодержащий белок лактоферрин.
К 5–6-му месяцу жизни антенатальные запасы железа истощаются и железа, поступающего из молока становится недостаточно, что требует своевременного введения блюд прикорма.
Из продуктов питания наибольшее количество железа содержится в говядине, яичном желтке, бобах, кунжуте, морской капусте, пшеничных отрубях, гречке, фисташках, персиках, овсяных хлопьях, шпинате, лесных орехах. Легче абсорбируется железо в составе гема (мясные продукты) – 9–22%. Данный факт объясняется тем, что процессы абсорбции гема в кишечнике не зависят от кислотности среды и ингибирующих пищевых факторов. Коэффициент абсорбции железа из фруктов – не более 2–3%. Продукты из мяса, рыбы увеличивают всасывание железа из овощей и фруктов при одновременном их применении. Всасывание негемового железа определяется диетой (снижают усвоение негемового железа соевый протеин, полифенолы, входящие в состав чая, кофе, орехов и бобовых), особенностями желудочно-кишечной секреции, приемом некоторых лекарств [8].
При дефиците железа восполнить его нормальный уровень диетой невозможно, поэтому основой терапии являются препараты железа. Препараты для лечения ЖДА должны содержать высокий уровень железа и хорошо всасываться. Довольно часто у детей 2–4-месячного возраста определяется гипохромная анемия, которая является запускающим механизмом в стимуляции эритропоэза, поэтому лечение должно быть назначено лишь в случае того, если врач уверен, что анемия сохраняется после 4–5 месяцев.
Длительность терапии должна быть не менее 3 месяцев для пополнения депо, несмотря на нормализацию гемоглобина в более ранние сроки. Предпочтение отдается пероральным препаратам железа, поскольку пероральный прием повышает уровень гемоглобина лишь на 2–4 дня позже, чем при парентеральном применении и крайне редко приводит к серьезным побочным эффектам, а также для парентерального введения должны быть показания (синдром нарушенного кишечного всасывания, состояние после обширной резекции тонкого кишечника, непереносимости, нарушении всасывания и пр.) [5]. Детям раннего возраста предпочтительно назначение железосодержащих препаратов, выпускаемых в жидкой форме (капли, сироп) [8].
Оценка эффективности проводимой терапии возможна к 10-му дню от начала лечения. Прирост показателя гемоглобина – не менее 1–5 г/л в сутки, а также выраженное повышение уровня ретикулоцитов в периферической крови свидетельствует о наличии терапевтического эффекта.
Нежелательные реакции и осложнения в процессе терапии обусловлены особенностями механизмов абсорбции железа и его ионных соединений. Биохимические свойства солей железа приводят к развитию ряда побочных эффектов: металлический вкус во рту, потемнение эмали зубов, десен, диспептические явления (тошнота, рвота, запор, диарея, боли в животе), аллергические реакции по типу крапивницы.
Следует отметить, что рекомендации широко использовать дополнительные витаминные комплексы неоправданны и могут приводить к ухудшению всасывания железа [8].
В настоящее время существует препарат железа в неионной форме – Мальтофер (ООО «Никомед Дистрибъюшн Сентэ»/«Вифор Интернэшнл Инк.»). Он представляет собой гидроксид-полимальтозный комплекс (ГПК) трехвалентного железа. По сравнению с ионными соединениями железа всасывание ГПК происходит активным физиологическим транспортным механизмом, предохраняющим организм от избытка свободных ионов. Железо в препарате Мальтофер не подвергается окислению. Благодаря этому сохраняются физиологические процессы саморегуляции – при насыщении организма железом его резорбция прекращается, подчиняясь принципу обратной связи, что полностью исключает возможность передозировки и отравления. Взаимодействия Мальтофера с компонентами пищи и лекарственными средствами не происходит, что позволяет использовать данный препарат, не нарушая режим питания и терапии сопутствующей патологии. Применение лекарственного средства с данным механизмом действия существенно снижает частоту развития побочных эффектов, обычно наблюдаемых при назначении ионных препаратов железа [7].
Кроме того, у детей раннего возраста большое значение имеет лекарственная форма препарата. Удобными в использовании являются капли и сиропы, что также обеспечивает возможность точного дозирования препаратов и не вызывает негативного отношения ребенка. Мальтофер существует в нескольких лекарственных формах: капли для приема внутрь (50 мг/мл), сироп (10 мг/мл), таблетки жевательные (100 мг), раствор для приема внутрь (20 мг/мл), раствор для внутримышечного введения (50 мг/мл). Данный препарат благодаря своей хорошей переносимости и удобным лекарственным формам может применяться с первых дней жизни. В ряде клинических исследований было установлено, что показатели ферритинового статуса и гемограммы у детей на фоне терапии Мальтофером нормализуются в сроки от 4 до 9 недель в зависимости от тяжести ЖДА.
При назначении препарата необходимо рассчитывать индивидуальную потребность в нем для каждого пациента исходя из того, что оптимальная суточная доза элементарного железа составляет 2–4 мг/кг. Среднесуточная доза железа при лечении ЖДА составляет 3 мг/кг. Применение более высоких доз не имеет смысла, поскольку объем всасывания железа не увеличивается.
Профилактика
В антенатальном периоде развития ребенка профилактика железодефицитных состояний заключается в назначении всем беременным женщинам пероральных ферро-препаратов или поливитаминов, обогащенных железом. К постнатальной профилактике железодефицитной анемии относятся: естественное вскармливание со своевременным введением продуктов прикорма, специально обогащенных железом, либо профилактическое назначение железосодержащих препаратов; соблюдение режима дня с достаточным пребыванием на свежем воздухе, предупреждение и своевременное лечение рахита, гипотрофии, острых респираторных заболеваний. Для адекватного поступления железа в организм детей, находящихся на грудном вскармливании, предусмотрено расширение диеты и введение в рацион с 6–7-месячного возраста мясного пюре. Дети, находящиеся на искусственном вскармливании, должны получать адаптированные смеси, содержащие железо. Однако следует помнить, что адсорбция железа из смесей, основанных на коровьем молоке, в 5 раз ниже, чем из женского молока. Детям, находящимся на искусственном вскармливании адаптированными заменителями грудного молока, не показано раннее (до 4 месячного возраста) назначение смесей, обогащенных железом. Недоношенным детям от многоплодной беременности, родившимся с крупной массой тела или имеющим бурные темпы массоростовой прибавки, с 3-го месяца жизни до конца первого полугодия рекомендуется профилактический прием препаратов железа в дозе равной 1/2–1/3 суточной терапевтической дозы (1,0–1,5 мг/кг/сут элементарного железа) с обязательным ежеквартальным гематологическим контролем [8].
Актуальность проблемы ЖДА у детей обусловлена ее большой распространенностью в популяции и частым возникновением при различных заболеваниях. Тем не менее на современном этапе развития медицины существует достаточно диагностических и лечебных возможностей для раннего выявления и своевременной коррекции сидеропенических состояний.
Список литературы:
- Алексеев И.Ф. Железодефицитные состояния. Серия «Интеллектуальные технологии» М.: Медицинская газета, 1996.
- Бисярина В.П., Казакова Л.М. Железодефицитные анемии у детей раннего возраста. М.: Медицина, 1976, 176 с.
- Идельсон М.И. Гипохромные анемии. М.: Медицина, 1981. 192 с.
- Коровина Н.А., Заплатников А.Л., Захарова И.Н. Железодефицитные анемии у детей. М., 2001, с. 23, 25, 27, 30, 37, 40–48, 54.
- Терапия железом, фолиевой кислотой и витамином В12. Ферро-Фольгамма.
- Коровина Н.А., Заплатников А.Л., Захарова И.Н. Железодефицитные состояния у детей. К., 1997, 31 с.
- Мосягина Е.Н. Анемии детского возраста. М.: Медицина, 1969, 299 с.
- American Academy of Pediatrics: Committe on Practice and Ambulatory Medicine Recommendation for preventive pediatric health care. Chicago, III, 1987.
- Joynson D.H.M. Defect of cell-mediated in patients with iron deficiency anemia / Lancet. 1972; 2: 1058–1059.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
