Ломкость костей при анемиях

Миелома костей — это не совсем верный термин. Так в народе называют множественную миелому — злокачественное заболевание, одним из симптомов которого является разрушение костной ткани, которое, соответственно, сопровождается возникновением сильных болей.
Заболевание начинает развиваться в костном мозге, который называют фабрикой по производству клеток крови. Одной из его популяций являются плазматические клетки — это зрелые В-лимфоциты, которые в норме должны продуцировать антитела, направленные на борьбу с инфекциями и опухолями. При злокачественном перерождении этих клеток развивается миелома костей, которая характеризуется следующими особенностями:
- Миеломные клетки начинают бесконтрольно размножаться и колонизировать костный мозг. Это приводит к вытеснению здоровых клеток, что сопровождается нарушением кроветворения со всеми вытекающими последствиями в виде анемий, иммунодефицитов и кровоточивости.
- Миеломные клетки продуцируют особый белок (М-белок), который системно действует на организм, приводя к поражению внутренних органов.
- Кроме того, миеломные клетки продуцируют вещества, которые способствуют локальному расплавлению кости и снижению плотности костной ткани.
Поражение костей при миеломе может быть представлено двумя вариантами:
- Единичные очаги остеолизиса. Такой вариант заболевания называется солитарная плазмоцитома.
- При множественной миеломе костей имеются множественные очаги остеодеструкции, количество которых постоянно увеличивается.
Симптомы множественной миеломы
Костные боли. На начальных этапах они не интенсивные, возникают при движениях и перемене положения тела. По мере развития миеломной болезни, боли становятся нестерпимыми и могут вызвать полную обездвиженность больного.
Из-за расплавления костей, в кровь поступает большое количество кальция, что приводит к явлениям интоксикации. Это сопровождается тошнотой, рвотой, кровотечениями, спутанностью сознания, вплоть до комы.
Из-за уменьшения плотности костей и очагов лизиса, возникают патологические переломы. Также по причине уменьшения плотности костей, происходит «проседание позвонков», что сопровождается неврологической симптоматикой — боли, парезы, параличи, чувство онемения и др.
При высоких показателях М-белка развивается синдром гипервязкости крови, для которого характерны кровотечения, нарушение зрения и сознания. Кроме того, такое состояние приводит к почечной недостаточности, которая характеризуется уменьшением количества выделяемой мочи, отеками. На терминальных стадиях происходит нарушение сознания.
Из-за нарушения кроветворения развиваются анемии, иммунодефициты и тромбоцитопении, что сопровождается инфекционными осложнениями, кровотечениями, слабостью и бледностью кожных покровов.
Классификация миеломы
Миелома — это разнородная группа заболеваний, часть из которых могут находиться годами в стабильном состоянии, другие — быстро прогрессируют.
- Плазмоцитома. Ей более всего подходит термин миелома костей. Она характеризуется единичными очагами остеодеструкции, хорошо поддается лечению и может существовать в стабильном состоянии в течение многих лет и даже десятилетий. Но у большинства больных она со временем диссеминирует по всему организму, трансформируясь во множественную миелому.
- Тлеющая миелома. При ней не обнаруживается поражение костей, но в костном мозге количество плазматических клеток превышает 10%, а в крови обнаруживается М-белок в значениях более 30 г/л. Такое состояние также может оставаться стабильным в течение нескольких лет.
- Симптоматическая миелома. Здесь уже имеется развернутая клиническая картина, заболевание характеризуется быстрым прогрессированием и неблагоприятным прогнозом.
Стадии миеломной болезни
1 стадия — характеризуется анемией легкой степени, кальций остается в пределах нормальных значений, М-протеин низкий, количество очагов поражения костей не более 5.

2 стадия. Анемия средней степени (гемоглобин в пределах 85-100 г/л), происходит увеличение кальция (до 3 ммоль/л) и М-белка. Также происходит увеличение количества очагов остеолизиса. Для второй стадии их количество не должно превышать 20.
3 стадию множественной миеломы выставляют, когда обнаруживается хотя бы 1 из следующих симптомов:
- Гемоглобин ниже 85 г/л, что соответствует тяжелой анемии.
- Превышение значения кальция более 3 ммоль/л.
- Уровень М-белка более 70г/л.
- Количество очагов поражения костей более 30.
Диагностика
Для постановки диагноза требуется комплексное обследование, включающее следующие процедуры.
Рентгенография скелета
Данное исследование позволяет определить очаги остеомаляции и, тем самым, уточнить диагноз и стадию развития заболевания. Солитарная плазмоцитома характеризуется единичными очагами остеолизиса. При множественной миеломе будут обнаруживаться множественные очаги остеодеструкции на фоне остеопении (снижения плотности костной массы). В рамках исследования выполняют снимки в двух проекциях, если они малоинформативны, прибегают к компьютерной томографии или МРТ.
Лабораторные исследования
- В общем анализе крови определяется анемия, при распространенных стадиях заболевания наблюдается снижение количества лейкоцитов (лейкопения) и тромбоцитов (тромбоцитопения). Одним из характерных, но неспецифических признаков является резкое увеличение СОЭ. У некоторых больных оно может превышать 100 мм/час.
- В анализе мочи обнаруживается протеинурия (высокое содержание белка), которая развивается из-за нарушения функции почек. При специальных исследованиях выявляются М-белок и белок Бенс-Джонса.
- Одним из специфических методов диагностики является исследование белковых фракций крови, при котором обнаруживаются парапротеинемии — при электрофорезе выявляется дополнительная фракция однородного (моноклонального) белка. Если его количество превышает 15%, это говорит в пользу миеломы.
- Миелограмма — исследование клеток костного мозга. При миеломе в миелограмме будет обнаружено увеличение количества плазматических клеток. В норме они составляют не более 5% от общей популяции, при миеломе их количество превышает 10%.
Лечение
Лечение миеломы костей будет зависеть от вида заболевания и его стадии. Основой лечения солитарной плазмоцитомы является лучевая терапия. Она дает хороший эффект, поскольку миеломные клетки очень чувствительны к облучению. Стандартом является суммарная очаговая доза в 40Гр. Если очаг остеодеструкции превышает 5 см, дозу могут увеличивать до 50 Гр. Эффективность терапии оценивается по склерозированию и реминерализации очага остеолизиса. Такая терапия позволяет стабилизировать заболевание на долгие годы и даже десятилетия, однако все равно сохраняется риск прогрессирования во множественную миелому.
К сожалению, радикальное лечение множественной миеломы на сегодняшний день невозможно. Все усилия направлены на достижение ремиссии и предотвращение развития рецидива или прогрессирования заболевания.
Основным методом лечения множественной миеломы является химиотерапия, и здесь есть несколько подходов, в зависимости от возраста и общего состояния больного. Ослабленным больным и пациентам старше 65 лет, которые не могут перенести интенсивную высокодозную химиотерапию, показано лечение с применением мелфалана, бортезомиба и преднизолона. Если имеется тяжелая почечная недостаточность, мелфалан отменяют. Также, чтобы снизить токсичность, могут быть снижены дозировки.
Пациентам младше 65 лет, а также пациентам в группе 65-70 лет с хорошим соматическим статусом и при отсутствии противопоказаний рекомендуется проводить высокодозную химиотерапию (ВХП) в миелоаблятивных режимах. Такое лечение отличается большей эффективностью даже в случае химиорезистентности к стандартным схемам ХТ, однако оно приводит к полному опустошению костного мозга с угнетением всех ростков кроветворения. Это очень опасно для здоровья, поскольку человек полностью лишается иммунной защиты, плюс возникают кровотечения из-за нехватки тромбоцитов. Чтобы восстановить кроветворение, необходима трансплантация гемопоэтических стволовых клеток (ТГСК). Стволовые клетки можно брать у самого больного, в этом случае говорят об аутотрансплантации, или пересаживать клетки от донора — аллогенная трансплантация.
Аллогенная трансплантация является палкой о двух концах. С одной стороны, пациент получает полноценный противоопухолевый иммунитет, поскольку донорские иммунные клетки будут атаковать клон злокачественных миелоцитов. С другой стороны, есть риск развития реакции трансплантат против хозяина, которая в тяжелых случаях может привести к летальному исходу. В настоящее время аллогенные трансплантации используются для лечения рецидивов после ВПХ.
Высокодозная полихимиотерапия
ВПХ проводится в несколько этапов:
- Индукционная терапия. Цель данного этапа является достижение ремиссии, которая в случае миеломы означает нормализацию количества плазматических клеток в костном мозге, исчезновение М-протеина в крови и моче, а также исчезновение очагов остеодеструкции. С этой целью назначаются 2-3 компонентные химиотерапевтические схемы первой линии. Если пациент хорошо ответил на терапию, и у него наступила полная ремиссия или очень хорошая ремиссия, он направляется на ТГСК. Если результаты неудовлетворительны, и опухоль резистентна к данным схемам, применяют более мощные схемы высокодозной полихимиотерапии в миелоаблятивных режимах, которые позволяют преодолеть опухолевую резистентность.
- Забор стволовых клеток. Для трансплантации используются мезенхимальные СК, которые в небольшом количестве присутствуют в крови. Чтобы увеличить их число, проводят мобилизацию, которая подразумевает применение препаратов, стимулирующих выход СК из костного мозга в кровь. Мобилизацию и сбор СК выполняют между 4 и 6 курсом индукционной терапии. Чтобы снизить опухолевую контаминацию полученного материала, может применяться его очистка с помощью моноклональных антител, но такая процедура все равно не влияет на вероятность развития рецидива.
- Этап кондиционирования. Его целью является максимально полное уничтожение опухолевых клеток. При множественной миеломе кондиционирование проводят с использованием высоких доз мелфалана. Этот этап должен выполняться не позднее, чем через 6 недель после сбора стволовых клеток.
- Трансплантация стволовых клеток. Материал вводится внутривенно с помощью инфузии. Внешне это выглядит как переливание крови. Для улучшения результатов лечения множественной миеломы у пациентов с высокими рисками рецидива и прогрессирования, может быть показана тандемная ТГСК. В этом случае через 3-6 месяцев после первой трансплантации проводят повторную, при этом могут быть использованы собственные или донорские стволовые клетки.
Далее идет поддерживающая терапия. Она назначается как после индукции ремиссии стандартной химиотерапией, так и после ТГСК. Ее целью является подавление роста остаточного клона миеломных клеток, продление ремиссии и предотвращение прогрессирования заболевания.
Прогноз
Прогноз определяется видом миеломы костей и ее стадией. При солитарной плазмоцитоме болезнь может быть стабильной годами. Продолжительность жизни при 1 стадии симптоматической миеломы составляет 6-7 лет, при второй — 3-4 года. Медиана выживаемости при 3 стадии не превышает 2 лет.
Железодефицитная анемия – одно из самых распространенных состояний, встречающихся в моей практике.
Зачастую выясняется, что диагноз был поставлен на основании только лишь клинического анализа крови (гемоглобина), что совершенно неверно. В результате, пациенты получают длительное лечение зря.
Давайте разберемся в проблеме по порядку.
Железодефицитная анемия или ЖДА
ЖДА — заболевание, связаное с дефицитом железа в организме из-за нарушения его поступления, усвоения или повышенных потерь.
Причины
К дефициту железа в организме может привести недостаточное его поступление с пищей, нарушение всасывания в желудочно-кишечном тракте, либо излишние потери организмом из-за хронической или острой кровопотери или беременности.
Чаще всего это:
- Строгие диеты;
- Перенесенные операции на органах ЖКТ — резекции желудка или кишечника;
- Болезни желудочно-кишечного тракта — язвенный колит, болезнь Крона, гастриты;
- Целиакия — нарушение пищеварения, связанное с непереносимостью глютена;
- Беременность и кормление грудью;
- Избыточные месячные;
- Скрытые кровотечения (язвы, эрозии, опухоли, полипы);
- Глистные инвазии.
Диагностика. Оценка симптомов
Первый пункт в диагностике железодефицитной анемии – оценка симптомов.
При лёгкой степени анемии редко что-то беспокоит, а вот при средних и тяжелых состояниях могут появляться:
- Головокружение, головная боль
- Слабость и быстрая утомляемость
- Учащенное сердцебиение — больше 80 в минуту
- Одышка
- Дискомфорт в области желудка
- Тошнота и снижение аппетита
- Сухость и шелушение кожи
- Появление «заедов» в уголках рта
- Эрозии в ротовой полости
- Изменение восприятия вкусов и запахов
Лабораторная диагностика
Для постановки диагноза “железодефицитная анемия” нам необходимы следующие данные:
- Общий анализ крови — смотрим гемоглобин, гематокрит, MCV- средний объём эритроцита;
- Биохимические показатели — сывороточное железо крови, ферритин, общая железосвязывающая способность сыворотки крови (ОЖСС).
Общий анализ крови
- гемоглобин (менее 110 г/л)
- небольшое снижение количества эритроцитов (менее 3,8 х 12/л),
- снижение цветового показателя (менее 0,85)
- сниженное или нормальное количество ретикулоцитов (норма 10—20%)
Дополнительно врач-лаборант описывает морфологические изменения эритроцитов — анизоцитоз и пойкилоцитоз
Биохимический анализ крови
- Сывороточное железо СЖ (менее 12,5 мкмоль/л)
- Повышение общей железосвязывающей способности сыворотки — ОЖСС (более 69 мкмоль/л)
- Снижение коэффициента насыщения трансферрина железом — НТЖ (менее 17%),
- Снижение концентрации сывороточного ферритина — СФ (менее 30 нг/мл или мкг/л).
Оценить результаты ваших анализов сможет только врач, поэтому, пожалуйста, не занимайтесь самодиагностикой и лечением.
Лечение
Первым делом ищем причину и по возможности устраняем её.
В любом случае принимаем препараты железа, в достаточной дозе и правильными курсом:
- Легкая анемия — 1,5 месяца;
- Средняя — 3 месяца;
- Тяжелая — 4,5 месяца.
Принимать препараты нужно не менее 4-х недель с периодическим контролем гемоглобина, сывороточного железа, ферритина.
Как выбрать препарат
На российском фармацевтическом рынке огромное количество препаратов железа, как выбрать правильный разберем в этом посте.
Классификация:
- Пероральные (внутрь) и парентеральные (инъекционные)
- Двухвалентные (Fe2+) и трехвалентные(Fe3+);
- По форме выпуска: таблетки, капсулы, сиропы, капли и растворы внутрь, растворы для инъекций;
- Комбинированные (с аскорбиновой кислотой, фолиевой, витамином В12 и С) и простые.
А теперь, подробнее о каждом из пунктов.
Инъекции VS таблетки
Препараты для приёма внутрь обладают меньшими побочными реакциями, но не походят пациентам с хроническими заболеваниями ЖКТ.
Препараты для инъекций показаны:
- При непереносимости лекарственных препаратов, принимаемых внутрь;
- При тяжелых анемиях — если гемоглобин менее 70 г/л;
- При заболеваниях ЖКТ: язвенная болезнь желудка и двенадцатиперсной кишки, перации на желудке и кишечнике, язвенные колиты, болезнь Крона, синдром нарушения свертываемости.
Важно строго соблюдать дозовый и курсовый режимы.
Дефицит железа рассчитывают по формуле.
Стоит избегать препаратов содержащих в составе декстран (Феркайл, КосмоФер), так как могут возникнуть более серьёзные аллергические реакции.
Fe2+ VS Fe3+
Fe2+ быстрее попадает в кровь, НО, возможна перегрузка железом, и большая часть препарата оказывается в несвязанном с белком состоянии, что ведет к усиленному окислительному процессу и повреждающему действия на клеточные мембраны (с появлением тошноты, рвоты).
Fe3+, всасывается медленнее, НО, нежелательные побочные реакции встречаются редко, отсутствует взаимодействие с пищей, нет риска отравления.
Таблетки, сиропы, капли могут раздражать ЖКТ (вызывая тошноту, рвоту, боли в животе) и окрашивать зубы, при приёме капсул эти симптомы отсутствуют, и нет повреждающего действия соляной кислоты желудка, тем самым усваивается лучше.
Комбинированные препараты
Комбинированные препараты с вспомогательными веществами обладают лучшей усвояемостью (аскорбиновая кислота, янтарная, фолиевая, фруктоза, В12).
Есть препараты и продукты уменьшающие всасываемость железа и совместный приём не желателен:
- Антациды — Альмагель, Ренни, Гевискон, Маалокс;
- Ингибиторы протонной помпы — Омепразол, Нольпаза и другие препараты этой группы;
- Антибиотики тетрациклинового ряда — Доксициклин, Тетрациклин;
- Молочные продукты.
Обзор препаратов
Идеальный препарат железа имеет трехвалентное железо (Fe3+) и содержит в составе вспомогательное вещество.
Сравнительная таблица популярных препаратов
Скрытый дефицит железа
Но что, если в общем анализе крови нет никаких признаков анемии — гемоглобин в норме, а вот в биохимических анализах — ферритин снижен и железосвязывающая способность (ОЖСС) повышена?
Это значит, что запасы железа начали истощаться, а организм ещё не отреагировал снижением гемоглобина. Такое состояние называется латентным дефицитом железа (ЛДЖ).
При этом уже могут беспокоить слабость, утомляемость, сонливость, учащенное сердцебиение, сухостью кожи, ломкость волос — все тоже самое, что при истинной анемии. Но зачастую они выражены незначительно.
При этом важно найти причину железодефицита.
Итак, подведём итог
У вас есть симптомы из перечисленных выше — идём к врачу.
В общем анализе крови все хорошо — смотрим биохимический анализ крови: ферритин снижен, ОЖСС повышена — диагноз: латентный дефицит железа.
Принимаем препараты железа, делаем контроль анализов. Параллельно ищем причину и устраняем ее.
Будьте здоровы!
5. КОСТНЫЕ ПОРАЖЕНИЯ ПРИ АНЕМИЯХ
Практический интерес для рентгенолога представляют лишь врожденные анемии, ибо только при некоторых формах врожденного малокровия костная система подвергается значительным изменениям, определяемым при помощи рентгеновых лучей. Эти рентгенологические проявления малокровия не часты, но будучи налицо, они довольно характерны и представляют дифференциально-диагностическую ценность в сложном комплексе заболеваний кровотворной системы. Патологические изменения в костном мозгу, которые имеют место при большинстве обычных форм анемий, рентгенологически не отображаются. Практически важны также костные изменения при так называемых вторичных анемиях, сопутствующих самым различным заболеваниям, только в раннем детском возрасте (Р. С. Левин). Костные изменения вторично-анемического характера у маленьких детей имеют неспецифическую дистрофическую природу. Их надо хорошо знать, чтобы не принимать ошибочно за проявления врожденного сифилиса, как мы это уже выше (см. стр. 268 и 275) подчеркнули (рис. 351).
Лучше всего изучена рентгенологическая картина костей при так называемой эритробластической (средиземноморской) анемии, или талассемии, представляющей собой редкую в СССР форму врожденной хронической гемолитической анемии детского возраста. Этот особый вид малокровия описан впервые в 1927 г. Кули (Cooley) и многими заграничными авторами и обозначается как болезнь Кули. В пораженных семьях дети обычно рано умирают не достигая зрелого возраста.
При этой болезни костный мозг в длинных трубчатых костях и особенно в diploe черепа значительно гиперплазирован, в печени, селезенке и костях рассеяны центры красного кровотворения, и в кровь выбрасывается огромное количество циркулирующих в ней красных кровяных телец с ядрами — эритробластов (отсюда и название
болезни). Характерны грязно-желтая окраска кожных покровов, лица, а также темная моча с высоким содержанием уробилина. Печень и селезенка прогрессивно увеличиваются, и поэтому эта разновидность анемии называется также эритробластической спленомегалической анемией.
В тяжелых случаях заболевания бывает отставание роста и развития, и среди всех видов анемии именно анемия Кули влечет за собой низкорослость и даже карликовость. Кеффи считает характерным некоторое недоразвитие нижней челюсти, вследствие чего развивается неправильность привкуса. Как правило, также выражено замедление развития воздухоносных придаточных полостей носа.
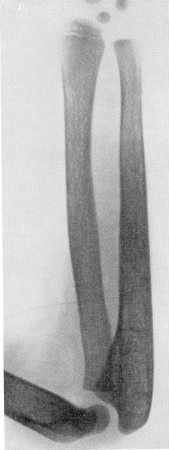
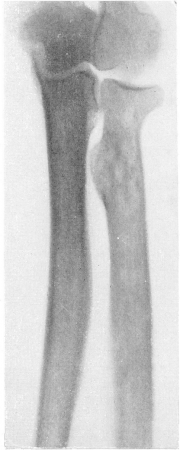
Рис. 352. Эритробластическая анемия Кули у девочки 5 лет 8 месяцев из Подмосковья из семьи, страдающей этой болезнью. Рентгенограмма предплечья.
Рентгенологически в качестве постоянного признака (рис. 352) отмечается расширение из-за увеличения объема костного мозга костномозговой полости трубчатых костей с истончением коркового слоя. Кости резко поротичны, прозрачны. Иногда в метафизах выступают своеобразные поперечные полосы. Такая же исчерченность, «трабекуляция», определяется и на снимках тазовых костей, лопаток, позвонков, ребер и ключиц. Для отличительного распознавания важно, что периост остается нормальным. Лишь в редких случаях у детей могут наблюдаться симметричные периостальные наслоения на поверхности больших трубчатых костей, например бедренных. Нормальны и суставы. Патологические переломы здесь не наблюдаются.
Но особенно характерно (рис. 353 и 354) соответственно анатомическому субстрату поражения diploe отодвигание внешней пластинки плоских костей свода черепа от внутренней, стекловидной пластинки (lamina vitrea), причем обе пластинки истончаются. Гиперостоз свода может достигать крайней степени, поперечник в 3—4 раза может превысить нормальную толщину плоских костей. В длительно протекающих тяжелых случаях, когда костный мозг прорастает соединительной тканью и последняя окостеневает, на рентгенограммах появляется исчерченность тангенциальной ленты черепного свода — картина „ёжика”, настолько характерная, что диагноз основного заболевания может быть поставлен на основании одного только этого рентгенологического признака. В начальных стадиях этой формы малокровия череп, наоборот, показывает лишь нехарактерную пористость, ноздреватость рисунка.
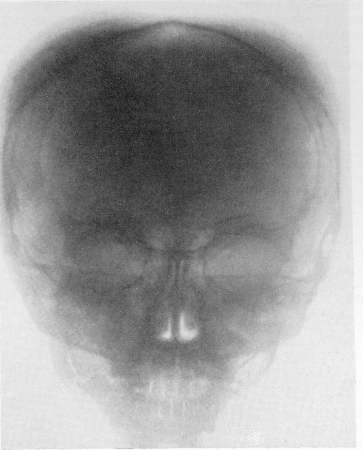
Рис. 353. Эритробластическая анемия Кули. Та же больная. Рентгенограмма черепа. Характерный гиперостоз покровных костей свода.
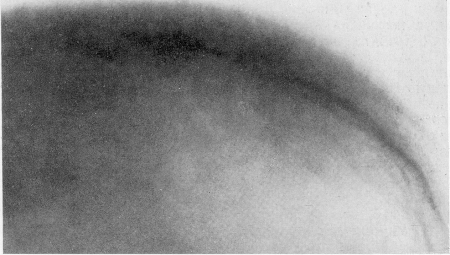
Рис. 354. Эритробластическая анемия Кули. Та же больная. Деталь рентгенограммы лобно-теменной области черепа. Типичная картина поперечной игольчатой исчерченности—картина „ежика”.
Много сходного с эритробластической анемией имеет другая, также хроническая гемолитическая, очень редкая у нас своеобразная форма врожденной анемии, а именно описанная впервые в 1910 г. Герриком (Herrick) серповидноклеточная анемия, обозначаемая также менискоцитарной или дрепаноцитарной анемией. Она наблюдается главным образом в Африке, в некоторых районах Индии, отчасти и в Греции.
Здесь красные кровяные тельца деформированы, они сплюснуты и изогнуты наподобие серпа и сильно удлинены, они теряют способность складываться в „монетные столбики”. По-видимому, серповидноклеточность вызывает затруднение при прохождении изуродованных эритроцитов через узкие капилляры, происходит процесс внутри-сосудистого разрушения эритроцитов, развиваются стазы, множественные тромбозы сосудов малого калибра, костномозговые инфаркты. В результате всего этого — характерные клинико-рентгенологические проявления серповидноклеточной анемии, а именно резкое увеличение размеров сердца, частые пневмонии, разнообразные костные изменения, болезненность костей. Вообще, клиническая симптоматология крайне многообразна, и эта болезнь приобретает выдающееся дифференциально-диагностическое значение. Это тем более, что общее предсказание при серповидноклеточной анемии лучше, нежели при анемии эритробластической, и довольно значительный процент больных наблюдается в молодом и даже зрелом возрасте.
Рентгенологическая картина при серповидноклеточной анемии складывается из двух групп симптомов. Первая группа симптомов выражает гиперплазию костного мозга, этого важного компенсаторного процесса при хроническом малокровии. Вторая группа объясняется тромбоэмболическими и некротическими явлениями. Первая локализуется главным образом в плоских и коротких костях, вторая — в трубчатых костях.
Рентгенологическая картина черепа новорожденных и грудных детей не отличается от таковой при эритробластической анемии, и дифференциальная рентгенодиагностика невозможна, она проста на основании гематологических столь различных и характерных данных. Длинные трубчатые кости в большинстве случаев не представляют у маленьких детей никаких изменений.
Зато у взрослых и рентгенологическая картина костей при серповидноклеточной анемии очень богата, многообразна, со значительным индивидуальным отпечатком в отдельных хронических случаях. Меняются почти все кости скелета, везде наблюдается глубокая структурная перестройка, осложняющаяся тут и там вторичными деформациями. Черепные кости не всегда утолщены, у взрослых исчерченность в виде щетки не обязательна. Бывают поражения не только мозговых, но и лицевых костей. Позвонки имеют вид рыбьих. Описаны компрессионные переломы, с превращением отдельных позвонков в уплощенные диски. Трубчатые кости, главным образом бедра и плечи, показывают полосатость и неправильную трабекуляцию, костномозговые каналы расширены, корковый слой истончен, бывают периостозы. Наблюдаются центральные некрозы костного мозга с последующим обызвествлением, наподобие хорошо нам известных при кессонной болезни. В патологический процесс вовлекаются из-за обширных периферических сосудистых изменений и эпифизарные концы костей, и мелкие губчатые косточки, развиваются асептические некрозы (например, головки бедренной кости), влекущие за собой артрозы типа обезображивающих.
Иногда асептические инфаркты всего диафиза или метадиафиза большой трубчатой кости, окруженные мощными периостальными разрастаниями и сидящие в „секвестральной коробке”, при серповидноклеточной анемии так напоминают истинные обширные секвестры при воспалительном заболевании, при остеомиелите, что на основании одних только рентгенологических данных нет возможности дифференцировать между этими столь различными болезнями, и необходимо бактериологическое исследование.
В этом свете представляет значительный интерес накапливающаяся в литературе казуистика об осложнении этой разновидности анемии подлинным остеомиелитом, вызванным салмонеллезом, т. е. возбудителями из группы паратифа. Имеются указания [например, Хьюз и Керролл (Hughes a. Carroll)], что серповидноклеточная анемия предрасполагает у малых детей к этой вторичной инфекции, возможно, вследствие наличия тромбозов в сосудах стенок кишечника и перехода в кровь возбудителей из просвета кишок. Подчас поражается одновременно или последовательно несколько костей.
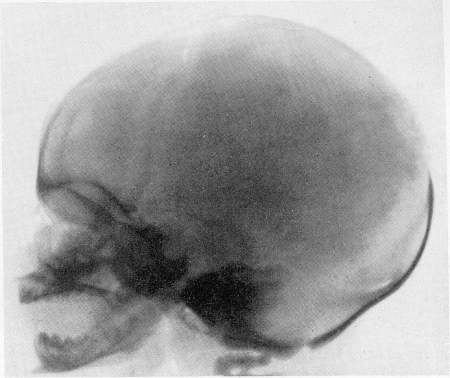
Рис. 355. Рентгенограмма черепа новорожденного ребенка с эритробластозом (гемолитической анемией и врожденной желтухой). В теменной кости — поперечно расположенные костные разрастания.
Далее, рентгенологические изменения скелета описаны и при некоторых других формах гемолитической анемии и атипичной гемолитической желтухе, которые возникают при резуснесовместимости матери и плода. В частности, в литературе имеются описания рентгенологических картин при так называемом эритробластозе плода (erythroblastosis foetalis). Для этой опасной болезни характерны тяжелое малокровие типа эритробластического, желтуха и отечность у в остальном хорошо развивающихся младенцев. Обычно смерть наступает внутриутробно (и может быть распознана рентгенологически) или же в первые дни жизни. Свод черепа нередко показывает на рентгенограммах совершенно такие же изменения, как при эритробластической и серповидноклеточной анемии (рис. 355). И вообще, если раньше характерная рентгенологическая картина черепа считалась специфической для эритробластической и серповидноклеточной форм анемии, то в последние годы все же выяснилось, что в редких случаях аналогичные изменения, пусть и в нерезко выраженной степени, могут появиться у недоношенных детей и у младенцев при анемии железодефицитной (с гепатоспленомегалией, бледностью покровов и т. д.). Нередко при эритробластозе плода наблюдаются поперечные зоны просветления губчатой костной ткани непосредственно под зонами предварительного окостенения в дистальных концах трубчатых костей, особенно предплечья, получающие некоторое дифференцальное диагностическое значение по отношению к сифилитическому оститу.
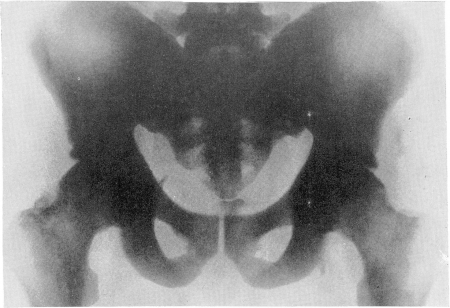
Рис. 356. Так называемая остеосклеротическая анемия (миелофиброз, миелосклероз) у 36-летней больной. Рентгенограмма таза. Картина мраморности костей в тяжело протекавшем случае заболевания. Секционное подтверждение диагноза.
Большой и возрастающий интерес для рентгенолога представляет еще одна не столь уж редкая разновидность малокровия, а именно так называемая остеосклеротическая анемия, или миелофиброз, или миелосклероз. Другие синонимы — лейкоэритробластическая, миелофтизическая анемия, алейкемический миелоз и т. д. А. В. Русаков называет эту болезнь „остеомиелопоэтической дисплазией”. В иностранной литературе в последнее время стали пропагандировать наименование «агногенная» (т. е. с неизвестным генезом) миелоидная метаплазия. Это только наиболее часто употребляемые синонимы. Все это красноречиво указывает на далеко идущие расхождения во мнениях об этиологии, патогенезе и самой природе этой разновидности анемии.
Остеосклеротическая анемия поражает любой возраст, главным образом зрелый, одинаково часто оба пола. Она протекает чаще всего хронически, но всегда кончается смертельным исходом, так как лечение по существу беспомощно. Остеосклеротическая анемия выражается в прогрессирующей слабости, увеличении печени и особенно селезенки, но главным образом в явлениях умеренной или тяжелой прогрессирующей анемии с весьма разнообразным в каждом отдельном случае морфологическим составом циркулирующей крови. Пациенты нередко жалуются на болезненность костей, главным образом в области поясницы и в нижних конечностях, иногда же скелет нечувствителен.
Основой остеосклеротической анемии являются системное замещение и вытеснение костного мозга волокнистой соединительной тканью — именно миелофиброз, миелосклероз, и образование в различных органах (больше всего в селезенке) гетеротопических очагов кровотворения. Кости меняются вторично, последовательно.
Поражаются главным образом кости туловища таз, позвоночный столб, ребра — и лишь в меньшей степени большие трубчатые кости, а именно их проксимальные отделы (рис. 356—361). Имеется глубокая перестройка костной структуры. Губчатая сеть вначале широкопетлиста, т. е. отдельные трабекулы расставлены далеко друг от друга, но отдельные балки вследствие метапластического костеобразования вокруг старых трабекул резко утолщаются.
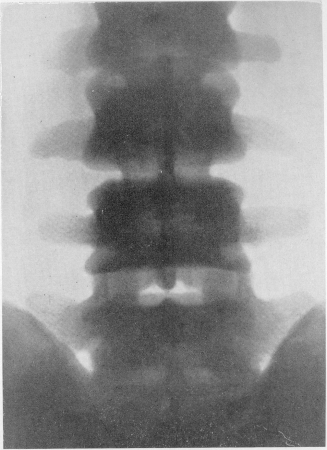
Рис. 357. Так называемая остеосклеротическая анемия (миелофиброз, миелосклероз). Та же больная. Деталь рентгенограммы позвоночника. Мраморность III—V поясничных позвонков.
Иногда губчатое вещество показывает слегка пятнистую перестройку, участки разрежения чередуются вперемежку со склеротическими очагами. В некоторых, особенно длительных, случаях прогрессирующее утолщение трабекулярной сети переходит в почти равномерный остеосклероз — в мраморность костей. Это особенно касается позвоночника, а также тазовых костей. Корковое вещество вначале расщеплено, так что местами поверхностные слои чуть приподняты, и это создает ложное впечатление периостальной реакции. Впрочем, некоторые исследователи описывают при остеосклеротической анемии и подлинные периостальные наслоения. Скелет кистей и стоп остается нетронутым. Черепные кости также либо нормальны, либо вовлекаются в патологический процесс в незначительной степени. Внешняя форма костей при остеосклеротической анемии не меняется. Патологические переломы не описаны.
