Механизм развития аутоиммунной гемолитической анемии
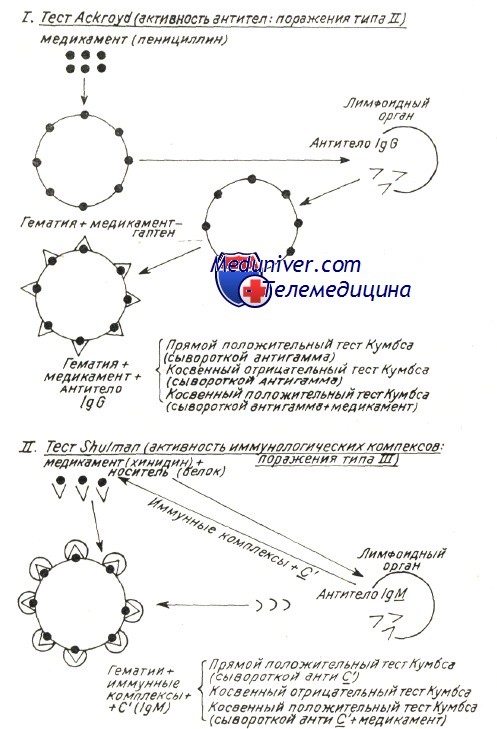
Механизмы развития аутоиммунной гемолитической анемии – патогенезВ механизме развития аутоиммунного гемолиза, независимо от вида антител, спорными представляются две проблемы: Начало аутоиммунного процесса общая проблема механизмов при всех аутоиммунных заболеваниях (Берчану), среди которых аутоиммунная гемолитическая анемия представляется как постоянная модель патогенетического исследования, применимая ряду аутоиммунных процессов. Существует ряд объяснений, в зависимости от вида аутоиммунной гемолитической анемии. Так, при вторичных формах после вирусной инфекции или сенсибилизации к медикаментозным препаратам происходит изменение антигенных структур оболочки эритроцита в результате собственно действия вируса или медикаментозного препарата. Прикрепление частиц вируса и химических антигенов к оболочке может создать новый иммуногенный комплекс, в котором инородные антигены выполняют роль сенсибилизирующего гаптена. Развивающиеся при этом антитела активны также в отношении антигенов эритроцитной оболочки и обусловливают расплавление крови. Таков механизм гемоцитолиза, описанный Ackroyd при гемоцитопении за счет сенсибилизации к медикаментозным препаратам. Поражение оболочки под воздействием вируса, медикаментозного препарата и прочих токсических веществ химической или инфекционной природы — среди широкого диапазона антигенов эритроцита — может «вскрыть» и его слабые антигены. Известно, что к последним иммуная переносимость небольшая, и что, под действием собственно острого, в частности хронического инфекционного процесса она нарушается, в результате чего развиваются аутоиммуные антиэритроцитные антитела, специфичные в отношении слабых антигенов. Проведенные в этом направлении исследования в условиях аутоиммунной гемолитической анемии доказали, что полные или неполные тепловые или холодовые антитела, выявляемые описанными выше способами в своем большинстве располагают групповой специфичностью, подобно изоантителам изоиммуной гемолитической анемии. Характеристика аутоантител при генуинной аутоиммунной гемолитической анемии в зависимости от иммунологических испытаний (видоизменение по Leddy) В таблице приведены не только физическая и биологическая характеристики антител, но и их групповая специфичность. Тепловые антитела вида IgG, выявляемые посредством прямой или косвенной реакции Кумбса с применением сыворотки антигамма и исследованные после их смыва с красных кровяных клеток, равно как и свободные антитела сыворотки специфично изоиммунные в отношении определенного резус-фенотипа. По данным Worlledge 38% тепловых антител антирезус, в то время как Weiner и Vos утверждают, что, с учетом форм резус с «делецией гена» эта пропорция равняется 70%. Доказать это удалось после пересмотра случаев, оказавшихся отрицательными к резус-специфичным антителам, но в которых, тем не менее, определяется наличие специфичности к более слабым резус-антигенам. Это антитела специфичные в отношении «нулевых» резус-гематий или тех, которые содержат лишь антигены ZW, рассматриваемые как D-like (Dacie и Worlledge, Eyster). Видимо они представляют собой антигенное вещество предшествующее антигенам резус-группы (Weiner и сотр.). Итак, иммунологические анализы доказали специфичность тепловых антител, при этом был уточнен ряд подгрупп Rr”, h’ в рамках Rh наряду с группами ZW, реже JK и К (Yokoyama). Резус и иммуноглобулиновая специфичности объясняют их закрепление на красных кровяных клетках, но без связывания комплемента; это последнее явление видимо можно проследить лишь в отдельных подклассах иммуноглобулинов. По Muller-Eberhard связывание комплемента наблюдается только на подгруппах IgG1…IgG3 (исключается IgG4). В связи с этим не дано объяснение тому факту, что тепловые антитела, в принципе относящиеся к подгруппе IgG1 с анти-резус специфичностью, либо не связывают комплемент, либо связывают его очень редко.
Холодовые антитела проявили специфичность также к слабым антигенам, таким как антиген 1, который, вопреки этой слабости выявляется в размере примерно 100% той или иной популяции, как отметили Weiner и Vos на 20 тыс. образцов отобранной сыворотки. Лишь небольшой процент располагает специфичностью к антигену i, как было обнаружено в редких случаях гемолитической анемии после инфекционного моно-нуклеоза (Walheim и сотр.). Итак, удалось определить, что располагающие групповой специфичностью анти-I антитела это связывающие комплемент IgM. Другой механизм развития аутоантител можно проследить при гемолитической анемии за счет злокачественной лимфопролиферации, когда происходит расстройство клеточной системы иммунитета (КСИ). Следует предполагать, что в процессе злокачественной эволюции лимфоцитов в условиях хронической лимфатической лейкемии, ЛС или даже ОЛЛ разрастанием охвачены также «клоны» клеток, которые, по теории Burnet, рассматриваются как «запрещенные ». Таковыми являются линии лимфоидных клеток, ответственных за переносимость к сельфу, но остающихся неактивными или «спящими» в период зародышевой «клональной селекции» (Burnet). Их злокачественная пролиферация видимо обусловливает и развитие специфических антител к сельф-антигенам эритроцита в результате активации последних. Однако злокачественная пролиферация может ограничиться активными лимфоидными клетками вида В, ускальзывающими от избирательного угнетающего контроля клеток Т, сохраняющих врожденную иммуную переносимость. Таким образом создается иммуная функциональная диссоциация, обусловливающая выработку аутоиммуных антител. Независимо от гипотезы клиническое наблюдение доказало, что развитие антител и гемолиз прекращаются лишь после уничтожения образующего аутоантитела злокачественного клонуса, посредством цитостатической терапии. Возможно, что механизм пролиферации «запрещенных» клонусов действует и при гемолитической анемии с холодовыми антителами как следствие вирусной инфекции, такой как вирусная пневмония. Известно, что у индивидов в норме титр антител — холодовых агглютининов — невелик, составляя примерно 1/8—1/16. Резкая пролиферация за счет вирусной инфекции обусловливает активацию отдельных латентных лимфоидных клонусов, которые, возможно, ответственны за образование холодовых агглютининов (Van Loghem). В таких случаях, когда, по истечении определенного периода, расплавление крови не прекращается, показанная при гемолитической анемии с Холодовыми антителами цитостатическая терапия может оказать угнетающее действие на эти разросшиеся и образующие аутоантитела клонусы, подобно тому как наблюдается при злокачественной лимфопролиферации. Поскольку присутствие гемолитических аутоантител наблюдается и при некоторых реактивных процессах пролиферации во многих аутоиммунных и иммунодефицитных заболеваниях (Берчану) принято считать, что у подобных больных происходит более сложное нарушение иммунитета, неустойчивость гомеостатической системы иммунитета. В связи с этим, у страдающих иммунодефицитом к нонсельфу возможны отклонения иммунитета с понижением переносимости к сельфу. В механизме развития аутоиммунных заболеваний выявлено определенное отношение между иммунодефицитами к нонсельфу, состояниями гиперсенсибилизации, обусловливающими иммуные комплексы путем хронических неконтролируемых инфекций и развитием аутоиммуной болезни (Берчану). Тот факт, что аутоиммунные процессы, такие как аутоиммунная гемолитическая анемия при заболеваниях за счет отсутствия антител, улучшаются или даже исцеляются правильным назначением иммуноглобулина, подтверждает наличие нарушенного равновесия и лабильности иммунитета. И наконец, принято считать, что при определенных вирусных или микробных инфекциях, в частности отдельных новообразованиях — яичниковых и желудочных (Van Loghem) — в организме появляются антигены, структура которых близка к структуре антигенов отдельных эритроцитных групп. Эти перекрестнореагирующие антигены определяют развитие перекрестнореагирующих антител гемолитического действия и в отношении эритроцитов.
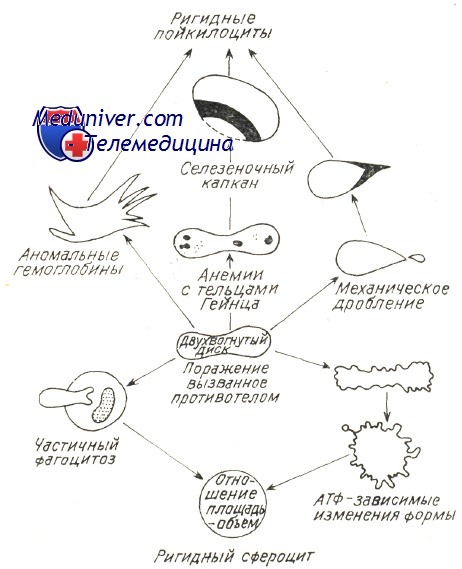
Во всех отмеченных стимулирующих иммунитет механизмах в патологических условиях (злокачественная лимфопролиферация, хроническое заболевание с чрезмерной нагрузкой на иммуную систему, заболевать за счет иммунодефицита), особенно когда аутоиммуная гемолитическая болезнь носит многолетний затяжной характер, следует предполагать нарушение врожденной иммуной переносимости с образованием гемолитических аутоантител, равно как и прочие аутоиммуные расстройства (Берчану). В принципе нарушается наиболее слабая иммуная переносимость к антигенам невысокой иммуногенной способности — Rh, I, i, Т. Реже встречаются случаи нарушения переносимости к крепким антигенам группы АВО, причем они редки в условиях злокачественной лимфопролиферации, когда развиваются «панагглютинины», расплавляющие эритроциты всех групп и переливание крови становится весьма опасным. По новым гипотезам о развитии аутоиммуных заболеваний предполагается наличие нарушения сотрудничества систем Th и Т8; дефицит Ts способствует дерепрессии «запрещенных » клонов В и выделению аутоантител (Берчану). Разрушение красных кровяных клеток в условиях аутоиммуного гемолиза подвергалось основательным исследованиям, в частности изучением реакций в пробирке между антителами и эритроцитами; при этом наблюдалось и действие комплемента в условиях гемолиза за счет холодовых антител, в частности при пароксизмальной холодовой анемии (Rosse и Dovramashkin). Электронномикроскопическое исследование оболочки эритроцита в условиях острого гемолиза при пароксизмальной гемоглобинурии показало, что, под воздействием связывающих комплемент холодовых антител на оболочке образуются «поры ». В связи с этим нарушается обмен катионов после проникновения воды в гематии и развивается острое внутрисосудистое расплавление крови. Поскольку существуют не расплавляющиеся гематии, со связанным на их оболочке комплементом, равно как и находящиеся в процессе расплавления гематии, на которых закрепляются лишь антитела (IgG), принято считать, что антитела необходимы для развертывания приоцесса гемолиза, который, следовательно, прижизненно не представляется возможным лишь под воздействием комплемента (Evans и сотр.). Фракции связанного комплемента видимо направляют механизм расплавления. Фракция С3 играет первостепенную роль в процессе гемолиза с холодовыми антителами. Issit установил роль фракции С3b, как при внутрисосудистом, так и печеночном внутриклеточном расплавлении крови. Явление пожирания красных кровяных клеток периферическими моноцитоидными макрофагами, неизменно наблюдаемое при гемолизе в условиях пароксизмальной гемоглобинурии, равно как и гистопатологическое исследование оперированной селезенки (Jandl) уже давно уточнили этот механизм. Недавно проведенные исследования выявили, что, в концентратах периферических лейкоцитов, несущие на себе Иг и комплемент эритроциты пожираются моноцитами. В зависимости от концентрации иммунных комплексов на эритроцитах увеличивается процент эритрофагоцитоза и наблюдается явление расположения розеткой гематий вокруг макрофагов (Abramson и сотр., Huber, и сотр.). В условиях аутоиммуной гемолитической болезни доказано наличие ряда механизмов внутриклеточного патологического расплавления крови, сокращающего продолжительность жизни красных кровяных телец. Возможно неполные антитела типа IgG или закрепленный на оболочке комплемент изменяют функциональную структуру эритроцита в отношении его подвижности в синусоидных органах, печени и селезенке, затем, посредством явления «секвестрации», его захватывает и разрушает макрофаг. Недавно уточнилось, что в селезенке, секвестрация осуществляется макрофаговыми рецепторами на несущий эритроцитом IgG. Макрофаги печени располагают рецепторами на С, вот почему несущие этот иммуноглобулин эритроциты разрушаются преимущественно в печени (Brown, Гологан и Берчану, Берчану). Этим объясняется положительный результат удаления селезенки лишь при гемолитической анемии с тепловыми антителами типа IgG (Бутояну и Берчану). В последние годы определилось, что в любом гемолитическом процессе, в том числе за счет ауто- или изоиммунных антител, происходит нарушение отношения объема и площади красной юровяной клетки, в связи с чем уменьшаются ее пластичность и элластичность (Weed). В главах, рассматривающих нормальное расплавление крови, говорилось о том, что элластичность гематий способствует их прохождению через поры синусовидиых эндотелиев, диаметром меньше 3 и. При этом эритроциты, располагающие большой степенью эластичности приспосабливают свою форму к размеру пересекаемого отверстия. Исследования в пробирке, при помощи оболочек с порами определенных размеров, уточнили условия прохождения в зависимости от «показателя элластичности», соответствующего показателю «фильтрации» (Jandl, Teitel). При иммуном патологическом гемолизе закрепленные на оболочке антитела или комплемент вызывают ее частичный разрыв и тем самым сокращение площади. Гематии приобретают вид сфероцита, как это отмечается в основном при приступах острого расплавления крови за счет тепловых или холодовых антител. После изменения отношения объем/площадь красные кровяные тельца становятся жесткими, пластичность понижается и прижизненно они более не проходят через поры эндотелия, а в пробирке — через поры циркуляционной мембраны. Итак наблюдается секвестрация гематий, «сенсибилизированных» гуморальными иммунными факторами, обусловливающими этим путем резкое пожирание красных кровяных клеток. Weed предложил схему, объясняющую механизм внутрисосудистого расплавления крови при любом гемолитическом эндоили экзоэритроцитном заболевании. Изменение эластичности, жесткость гематий предшествуют внутриклеточному гемолизу, обусловленному изменением количественного отношения площадь/объем и набуханием гематий в связи с изменением проницаемости или осаждением патологического гемоглобина. – Также рекомендуем “Лечение аутоиммунной гемолитической анемии – схема” Оглавление темы “Гемолитические анемии”:
|
Источник
Содержание
- Гемолитическая анемия
- Классификация гемолитических анемий
- Причины гемолитических анемий
- Симптомы гемолитических анемий
- Наследственные мембранопатии, ферментопении и гемоглобинопатии
- Приобретенные гемолитические анемии
- Диагностика гемолитических анемий
- Лечение гемолитических анемий
Гемолитическая анемия – патология эритроцитов, отличительным признаком которой является ускоренное разрушение красных кровяных телец с высвобождением повышенного количества непрямого билирубина. Для гемолитических анемий типично сочетание анемического синдрома, желтухи и увеличения размеров селезенки. В процессе диагностики исследуется общий анализ крови, уровень билирубина, анализ кала и мочи, УЗИ органов брюшной полости; проводится биопсия костного мозга, иммунологические исследования. В качестве методов лечения гемолитической анемии используется медикаментозная, гемотрансфузионная терапия; при гиперспленизме показана спленэктомия.
Гемолитическая анемия
Гемолитическая анемия — анемия, обусловленная нарушением жизненного цикла эритроцитов, а именно преобладанием процессов их разрушения (эритроцитолиза) над образованием и созреванием (эритропоэзом). Группа гемолитических анемий очень обширна. Их распространенность неодинакова в различных географических широтах и возрастных группах; в среднем патология встречается у 1% населения. Среди прочих видов анемий на долю гемолитических приходится 11%. При гемолитической анемии жизненный цикл эритроцитов укорочен и их распад (гемолиз) происходит раньше времени (через 14-21 день вместо 100-120 суток в норме). При этом разрушение эритроцитов может происходить непосредственно в сосудистом русле (внутрисосудистый гемолиз) или в селезенке, печени, костном мозге (внесосудистый гемолиз).
Классификация гемолитических анемий
В гематологии гемолитические анемии подразделяются на две большие группы: врожденные (наследственные) и приобретенные.
Наследственные гемолитические анемии включают следующие формы:
- эритроцитарные мембранопатии (микросфероцитоз – болезнь Минковского-Шоффара, овалоцитоз, акантоцитоз) – гемолитические анемии, обусловлены структурными аномалиями мембран эритроцитов
- ферментопении (энзимопении) – гемолитические анемии, вызванные дефицитом тех или иных ферментов (глюкозо-6-фосфатдегидрогеназы, пируваткиназы и др.)
- гемоглобинопатии — гемолитические анемии, связанные с качественными нарушениями структуры гемоглобина или изменением соотношения его нормальных форм (талассемия, серповидно-клеточная анемия).
Приобретенные гемолитические анемии подразделяются на:
- мембранопатии приобретенные (пароксизмальная ночная гемоглобинурия – б-нь Маркиафавы-Микели, шпороклеточная анемия)
- иммунные (ауто- и изоиммунные анемии) – обусловлены воздействием антител
- токсические – гемолитические анемии, обусловленные воздействием химических веществ, биологических ядов, бактериальных токсинов
- гемолитические анемии, вызванные механическим повреждением структуры эритроцитов (тромбоцитопеническая пурпура, маршевая гемоглобинурия)
Причины гемолитических анемий
Патогенетическую основу наследственных гемолитических анемий составляют генетические дефекты мембран эритроцитов, их ферментных систем либо структуры гемоглобина. Данные предпосылки обусловливают морфо-функциональную неполноценность эритроцитов и их повышенное разрушение. Гемолиз эритроцитов при приобретенных анемиях наступает под влиянием внутренних факторов или факторов окружающей среды.
Развитию иммунных гемолитических анемий могут способствовать посттрансфузионные реакции, профилактическая вакцинация, гемолитическая болезнь плода, прием определенных лекарств (противомалярийных препаратов, сульфаниламидов, производных нитрофуранового ряда, анальгетиков). Аутоиммунные реакции с образованием антител, агглютинирующих эритроциты, возможны при гемобластозах (остром лейкозе, хроническом лимфолейкозе, лимфогранулематозе, миеломной болезни), аутоиммунной патологии (СКВ, неспецифическом язвенном колите), инфекционных заболеваниях (инфекционном мононуклеозе, токсоплазмозе, сифилисе, вирусной пневмонии).
В ряде случаев острому внутрисосудистому гемолизу предшествует отравление мышьяковистыми соединениями, тяжелыми металлами, уксусной кислотой, грибными ядами, алкоголем и др. Механическое повреждение и гемолиз эритроцитов может наблюдаться при тяжелых физических нагрузках (длительной ходьбе, беге, лыжном переходе), при ДВС-синдроме, малярии, злокачественной артериальной гипертензии, протезировании клапанов сердца и сосудов, проведении гипербарической оксигенации, сепсисе, обширных ожогах. В этих случаях под действием тех или иных факторов происходит травматизация и разрыв мембран изначально полноценных эритроцитов.
Центральным звеном патогенеза гемолитических анемий является повышенное разрушение эритроцитов в органах ретикулоэндотелиальной системы (селезенке, печени, костном мозге, лимфатических узлах) или непосредственно в сосудистом русле. Эти процессы сопровождаются развитием анемического и желтушного синдромов (так называемой «бледной желтухой»). Возможно интенсивное окрашивание кала и мочи, увеличение селезенки и печени.
Симптомы гемолитических анемий
Наследственные мембранопатии, ферментопении и гемоглобинопатии
Наиболее распространенной формой данной группы гемолитических анемий является микросфероцитоз, или болезнь Минковского-Шоффара. Наследуется по аутосомно-доминантному типу; обычно прослеживается у нескольких представителей семьи. Дефектность эритроцитов обусловлена дефицитом в мембране актомиозиноподобного белка и липидов, что приводит к изменению формы и диаметра эритроцитов, их массивному и преждевременному гемолизу в селезенке.
Манифестация микросфероцитарной гемолитической анемии возможна в любом возрасте (в младенчестве, юношестве, старости), однако обычно проявления возникают у детей старшего возраста и подростков. Тяжесть заболевания варьирует от субклинического течения до тяжелых форм, характеризующихся часто повторяющимися гемолитическими кризами. В момент криза нарастает температура тела, головокружение, слабость; возникают боли в животе и рвота.
Основным признаком микросфероцитарной гемолитической анемии служит желтуха различной степени интенсивности. Вследствие высокого содержания стеркобилина кал становится интенсивно окрашенным в темно-коричневый цвет. У пациентов с болезнь Минковского-Шоффара наблюдается склонность к образованию камней в желчном пузыре, поэтому часто развиваются признаки обострения калькулезного холецистита, возникают приступы желчной колики, а при закупорке холедоха конкрементом — обтурационная желтуха. При микросфероцитарной гемолитической анемии во всех случаях увеличена селезенка, а у половины пациентов – еще и печень.
Кроме наследственной микросфероцитарной гемолитической анемии, у детей часто встречаются другие врожденные дисплазии: башенный череп, косоглазие, седловидная деформация носа, аномалии прикуса, готическое нёбо, полидактилия или брадидактилия и пр. Пациенты среднего и пожилого возраста страдают трофическими язвами голени, которые возникают в результате гемолиза эритроцитов в капиллярах конечностей и плохо поддаются лечению.
Энзимопенические гемолитические анемии связаны с недостатком определенных ферментов эритроцитов (чаще — Г-6-ФД, глутатион-зависимых ферментов, пируваткиназы и др). Гемолитическая анемия может впервые заявлять о себе после перенесенного интеркуррентного заболевания или приема медикаментов (салицилатов, сульфаниламидов, нитрофуранов). Обычно заболевание имеет ровное течение; типична «бледная желтуха», умеренная гепатоспленомегалия, сердечные шумы. В тяжелых случаях развивается ярко выраженная картина гемолитического криза (слабость, рвота, одышка, сердцебиение, коллаптоидное состояние). В связи с внутрисосудистым гемолизом эритроцитов и выделением гемосидерина с мочой последняя приобретает темный (иногда черный) цвет.
Особенностям клинического течения гемоглобинопатий — талассемии и серповидно-клеточной анемии посвящены самостоятельные обзоры.
Приобретенные гемолитические анемии
Среди различных вариантов приобретенных гемолитических анемий чаще других встречаются аутоиммунные анемии. Для них общим пусковым фактором выступает образование антител к антигенам собственных эритроцитов. Гемолиз эритроцитов может носить как внутрисосудистый, так и внутриклеточный характер.
Гемолитический криз при аутоиммунной анемии развивается остро и внезапно. Он протекает с лихорадкой, резкой слабостью, головокружением, сердцебиением, одышкой, болями в эпигастрии и пояснице. Иногда острым проявлениям предшествуют предвестники в виде субфебрилитета и артралгий. В период криза стремительно нарастает желтуха, не сопровождающаяся кожным зудом, увеличивается печень и селезенка.
При некоторых формах аутоиммунных гемолитических анемий больные плохо переносят холод; в условиях низких температур у них может развиваться синдром Рейно, крапивница, гемоглобинурия. Вследствие недостаточности кровообращения в мелких сосудах возможны осложнения в виде гангрены пальцев ног и рук.
Токсические гемолитические анемии протекают с прогрессирующей слабостью, болями в правом подреберье и поясничной области, рвотой, гемоглобинурией, высокой температурой тела. Со 2-3 суток присоединяется желтуха и билирубинемия; на 3-5 сутки возникает печеночная и почечная недостаточность, признаками которых служат гепатомегалия, ферментемия, азотемия, анурия.
Отдельные виды приобретенных гемолитических анемий рассмотрены в соответствующих статьях: «Гемоглобинурия» и «Тромбоцитопеническая пурпура», «Гемолитическая болезнь плода».
Диагностика гемолитических анемий
Определение формы гемолитической анемии на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Сплено- и гепатомегалия подтверждается при проведении УЗИ печени и селезенки.
Изменения в гемограмме характеризуются нормо- или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. При аутоиммунных гемолитических анемиях большое диагностическое значение имеет положительная проба Кумбса. В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина. Исследование пунктата костного мозга обнаруживает гиперплазию эритроидного ростка.
В процессе дифференциальной диагностики исключаются гепатиты, цирроз печени, портальная гипертензия, гепатолиенальный синдром, гемобластозы.
Лечение гемолитических анемий
Различные формы гемолитической анемии имеют свои особенности и подходы к лечению. При всех формах приобретенной гемолитической анемии необходимо позаботиться об устранении влияния гемолизирующих факторов. Во время гемолитических кризов больным необходимы инфузии растворов, плазмы крови; витаминотерапия, по необходимости – гормоно- и антибиотикотерапия. При микросфероцитозе единственно эффективным методом, приводящим к 100 % прекращению гемолиза, является спленэктомия.
При аутоиммунной гемолитической анемии показана терапия глюкокортикоидными гормонами (преднизолоном), сокращающая или прекращающая гемолиз. В некоторых случаях требуемый эффект достигается назначением иммунодепрессантов (азатиоприна, 6-меркаптопурина, хлорамбуцила), противомалярийных препаратов (хлорохина). При резистентных к медикаментозной терапии формах аутоиммунной гемолитической анемии выполняется спленэктомия.
Лечение гемоглобинурии предполагает переливание отмытых эритроцитов, плазмозаменителей, назначение антикоагулянтов и антиагрегантов. Развитие токсической гемолитической анемии диктует необходимость проведения интенсивной терапии: дезинтоксикации, форсированного диуреза, гемодиализа, по показаниям – введение антидотов. При развитии почечной недостаточности прогноз неблагоприятен.
Источник