Механизм развития серповидноклеточной анемии
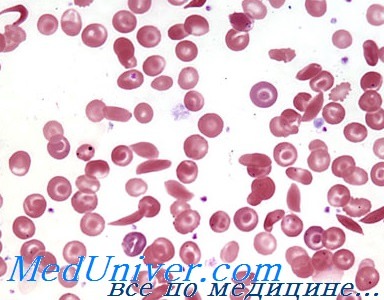
Серповидноклеточная анемия — это наследственная гемоглобинопатия, связанная с таким нарушением строения белка гемоглобина, при котором он приобретает особое кристаллическое строение. Форма гемоглобина больных — так называемый гемоглобин S. Эритроциты, несущие гемоглобин S вместо нормального гемоглобина А, под микроскопом имеют характерную серпообразную форму (форму серпа), за что эта форма гемоглобинопатии и получила название серповидноклеточной анемии.
Этиология и патогенез[править | править код]
Заболевание связано с мутацией гена HBB, кодирующего β-цепь основной разновидности взрослого гемоглобина, гемоглобина А (HbA), вследствие чего синтезируется аномальный гемоглобин S, в молекуле которого вместо глутаминовой кислоты в шестом положении β-цепи находится валин. В условиях гипоксии гемоглобин S полимеризуется и образует длинные тяжи, в результате чего эритроциты приобретают серповидную форму.
Серповидноклеточная анемия наследуется по аутосомно-рецессивному типу (с неполным доминированием на уровне фенотипа). У носителей, гетерозиготных ( AS) по гену серповидноклеточной анемии, в эритроцитах присутствуют примерно в равных количествах гемоглобин S и гемоглобин А, то есть наблюдается кодоминирование. При этом в нормальных условиях у носителей симптомы практически никогда не возникают, и серповидные эритроциты выявляются случайно при лабораторном исследовании крови. Симптомы у носителей могут появиться при гипоксии (например, при подъёме в горы) или тяжёлой дегидратации организма. У гомозигот (SS) по гену серповидноклеточной анемии в крови имеются только эритроциты, несущие гемоглобин S, и болезнь протекает тяжело.
Эритроциты, несущие гемоглобин S, обладают пониженной стойкостью к лизису и пониженной способностью к переносу кислорода, поэтому у больных с серповидноклеточной анемией повышено разрушение эритроцитов в селезёнке, укорочен срок их жизни, повышен гемолиз и часто имеются признаки хронической гипоксии (кислородной недостаточности) или хронического «перераздражения» эритроцитарного ростка костного мозга.
Эпидемиология[править | править код]
Серповидноклеточная анемия весьма распространена в регионах мира, эндемичных по малярии, причём больные серповидноклеточной анемией обладают повышенной (хотя и не абсолютной) врождённой устойчивостью к заражению различными штаммами малярийного плазмодия. Серповидные эритроциты этих больных также не поддаются заражению малярийным плазмодием в пробирке.
Повышенной устойчивостью к малярии обладают и гетерозиготы-носители, которые анемией не болеют (преимущество гетерозигот), что объясняет высокую частоту этого вредного аллеля в африканских популяциях.
Распространение аллеля серповидноклеточной анемии (более тёмная окраска – большая частота встречаемости, наибольшая частота – около 15%)
Симптомы[править | править код]
- Усталость и анемия
- Приступы боли
- Отек и воспаление пальцев рук и/или ног и артрит
- Бактериальные инфекции
- Тромбоз крови в селезёнке и печени
- Лёгочные и сердечные травмы
- Язвы на ногах
- Асептический некроз
- Повреждение глаз
Симптомы серповидноклеточной анемии делятся на две основные категории. Из-за хрупкости красных клеток крови всегда наблюдается анемия, которая может привести к потере сознания, делает больного физически менее выносливым и может вызвать желтуху (связанную с чрезмерным распадом гемоглобина).
Кроме этого, периодическая закупорка мелких капилляров в любой части тела может привести к широкому спектру различных симптомов.
Почти невозможно описать «типичного пациента», страдающего серповидноклеточной анемией, поскольку симптомы и их тяжесть широко варьируют. Некоторые характерные особенности являются общими почти для всех пациентов с серповидноклеточной анемией.
В периоды гемолитических кризисов отмечается резкое падение уровня гемоглобина, которое сопровождается высокой температурой и чёрным цветом мочи.
У больных серповидной анемией меняется и внешний вид: отмечается высокий рост, худоба, удлиненность туловища, искривление позвоночника, башенный череп и изменённые зубы.
Обычно новорождённые вполне здоровы, имеют нормальный вес и нормально развиваются, никаких симптомов у них не проявляется до 3-месячного возраста. Первыми признаками серповидноклеточной анемии у младенца обычно являются опухание и болезненность кистей рук или стоп, слабость и искривление конечностей и иногда, несколько позднее, отказ от ходьбы. Этот симптом является результатом закупорки эритроцитами капилляров мелких костей кистей и стоп и нарушения кровотока. Эритроциты выпадают из жидкой части крови и откладываются в капиллярах в виде осадка. Скопление эритроцитов постепенно рассасывается само по себе, но до тех пор, пока этого не произойдет, требуется помощь врача, чтобы смягчить боль и обнаружить возможные сопутствующие заболевания. Ребёнок с серповидноклеточной анемией обычно выглядит бледным, возможно, слегка желтушным, но в остальных отношениях, как правило, здоров.
Единственным очень серьёзным осложнением серповидноклеточной анемии у ребёнка до 5-летнего возраста является инфекция. Скопление эритроцитов и закупорка капилляров в селезёнке, органе, который в норме отфильтровывает бактерии из кровотока, происходит в течение первых лет жизни, что делает ребёнка особенно восприимчивым к смертельному заражению крови — сепсису. Поэтому родителей маленьких детей, страдающих серповидноклеточной анемией, предупреждают, чтобы они были внимательны и не пропустили ранних симптомов инфекции, таких как раздражительность, нервозность, повышенная температура и плохой аппетит. Родители должны немедленно обращаться за медицинской помощью, если у ребёнка наблюдается какой-либо из этих симптомов. Если при заражении крови достаточно рано начинать применять антибиотики, фатальных осложнений можно избежать. После 5-летнего возраста, когда у ребёнка уже выработались соответствующие естественные антитела к такого рода бактериям, вероятность смертельной бактериальной инфекции существенно снижается.
Проблемой детей школьного возраста с серповидноклеточной анемией обычно является эпизодическая закупорка эритроцитами капилляров больших костей. В большинстве случаев эти эпизоды протекают относительно легко, наблюдаются лишь слабые ноющие боли в костях.
С возрастом процесс закупорки капилляров может затрагивать и другие органы. Если это произойдет, например, в лёгких, развивается серьёзное респираторное заболевание. Очень редкое осложнение, которое бывает меньше чем у 10% больных с серповидноклеточной анемией — закупорка сосудов мозга, приводящая к инсульту.
Подростки с серповидноклеточной анемией испытывают беспокойство и озабоченность из-за того, что их физическое развитие обычно задерживается на 2—3 года. Такие подростки обычно меньше ростом, чем их одноклассники, их часто дразнят за запаздывание в сексуальном развитии. Однако со временем половая зрелость все же наступает, и исследования показывают, что женщины с серповидноклеточной анемией имеют нормальную возможность к деторождению. Женщины с серповидноклеточной анемией, безусловно, способны вынашивать и рожать нормальных детей, но во время беременности у них повышается риск осложнений, которые могут привести к выкидышу, преждевременным родам или усилению анемии у матери. Такие беременные женщины должны находиться под наблюдением гинеколога, имеющего специальный опыт по беременности с повышенным риском. В течение беременности таким женщинам может потребоваться переливание крови.
У взрослых с серповидноклеточной анемией могут обнаруживаться симптомы хронической (постоянной или длительной) закупорки капилляров легких и почек, и может развиться хроническая легочная или почечная недостаточность. Эти два осложнения приводят к ранней смерти некоторых пациентов с серповидноклеточной анемией.
У других больных может происходить закупорка капилляров сетчатки глаза, что в конечном итоге может привести к слепоте.
Хотя все эти осложнения (почечная и лёгочная недостаточность, слепота, серьёзная инфекция и повторяющиеся костные кризы) характерны для страдающих серповидноклеточной анемией, крайне редко бывает так, чтобы все они наблюдались у одного пациента.
Лечение[править | править код]
Препараты для лечения[2]: вокселотор, кризанлизумаб.
Синонимы[править | править код]
Русские[править | править код]
- Дрепаноцитарная анемия
- Серповидноклеточная гемолитическая анемия
- Африканская анемия
- Дрепаноцитоз
- Менискоцитоз
- Анемия Херрика (Геррика)
- болезнь (синдром) Херрика (Геррика)
Английские[править | править код]
- Hemoglobin S disease
- ( Hb S disease)
- Herrick’s anemia
- Herrick disease (syndrome)
- Sickle-cell anemia
Примечания[править | править код]
- ↑ 1 2 3 Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ New insights into the pathophysiology and development of novel therapies for sickle cell disease (англ.) // Ochsner J. : journal. — 2018. — doi:10.31486/toj.18.0076. — PMID 30559624. PMC 6292457
Ссылки[править | править код]
- [da-med.ru/diseases/cat-60/d-99/ Da-med.ru ::: Серповидноклеточная анемия]
Некоторые внешние ссылки в этой статье ведут на сайты, занесённые в спам-лист. Эти сайты могут нарушать авторские права, быть признаны неавторитетными источниками или по другим причинам быть запрещены в Википедии. Редакторам следует заменить такие ссылки ссылками на соответствующие правилам сайты или библиографическими ссылками на печатные источники либо удалить их (возможно, вместе с подтверждаемым ими содержимым). Список проблемных ссылок
|
Серповидноклеточная анемия: причины, диагностика, лечениеЭтиология и встречаемость серповидноклеточной анемии. Серповидноклеточная анемия (MIM № 603903) — аутосомно-рецессивное заболевание гемоглобина, вызванное миссенс-мутацией гена бета-субъединицы, заменяющей валин на глутаминовую кислоту в 6 положении. Болезнь чаще вызвана гомозиготностью по мутации серповидноклеточности, хотя серповидноклеточную анемию также может вызывать компаундная (составная) гетерозиготность по аллелю серповидноклеточности и аллелям HbC или бета-талассемии. Распространение серповидноклеточной анемии широко изменяется среди популяций в соответствии с прошлым и настоящим распространением малярии. Мутация серповидноклеточности, как оказалось, несколько повышает сопротивляемость малярии, таким образом, давая преимущество выживания гетерозиготным носителям мутации. Патогенез серповидноклеточной анемииГемоглобин формируется из четырех субъединиц: двух а-субъединиц, кодируемых геном ЯВА в хромосоме 16, и двух бета-субъединиц, кодируемых геном ЯВВ в хромосоме 11. Мутация Glu6Val в бета-субъединице уменьшает растворимость ненасыщенного кислородом гемоглобина и вызывает формирование сети жестких волокнистых полимеров, искажающих строение эритроцита, придавая ему форму серпа. Серповидные эритроциты закупоривают капилляры и вызывают инфаркты. Первоначально обогащение кислородом заставляет полимер гемоглобина растворяться, и эритроциты восстанавливают нормальную форму; тем не менее, регулярное нарушение формы приводит к необратимому переходу клеток в серповидную форму, впоследствии такие эритроциты удаляются из кровотока в селезенке. Скорость удаления эритроцитов из кровотока превышает возможность их синтеза в костном мозге, что приводит к гемолитической анемии. Аллельная гетерогенность часто встречается при большинстве менделирующих заболеваний, особенно когда мутантные аллели вызывают снижение функции. Серповидноклеточная анемия — важное исключение из этого правила, поскольку в данном случае единственная специфическая мутация ответственна за уникальные новые свойства HbS. HbC тоже менее растворим, чем HbA, и тоже стремится кристаллизоваться в эритроцитах, уменьшая их деформируемость в капиллярах и вызывая легкий гемолиз, но HbC не формирует полимерные волокна, как HbS. Неудивительно, что другие мутации с новыми функциями, например, мутации в гене FGFR3, вызывающие ахондроплазию, часто имеют аналогичное снижение аллельной гетерогенности, когда фенотип зависит от специфического, уникального изменения функции белка.
Фенотип и развитие серповидноклеточной анемииКлиническая картина у больных серповидноклеточной анемией обычно проявляется в течение первых двух лет жизни анемией, задержкой развития, спленомегалией, регулярными инфекциями и дактилитами (болезненными припухлостями кистей или стоп, вызванными закупоркой капилляров в небольших костях, обнаруженных у приведенной в примере пациентки). Инфаркты вследствие закупорки сосудов происходят во многих тканях, вызывая инсульты мозга, острый кардиальный синдром, почечный папиллярный некроз, инфаркты селезенки, язвы ног, приапизм, асептический некроз костей и снижение зрения. Окклюзия сосудов костей вызывает приступы болей, при отсутствии лечения эти болезненные эпизоды могут продолжаться в течение нескольких дней и даже недель. Функциональная аспления вследствие инфарктов и других недостаточно ясных факторов, предрасполагает к бактериальным инфекциям, например, пневомококковому или сальмонеллезному сепсису и остеомиелиту. Инфекция — основная причина смерти во всех возрастных группах, хотя прогрессирующая почечная и дыхательная недостаточность также нередкие причины смерти на четвертом и пятом десятилетиях жизни. Пациенты также имеют высокий риск развития угрожающей жизни апластической анемии после парвовирусной инфекции, поскольку парвовирусы вызывают временное прекращение образования эритроцитов. Гетерозиготные носители мутации («признака» серповидноклеточности) не имеют анемии и обычно клинически здоровы. Однако в условиях серьезной гипоксии, например, при восхождении в горы, эритроциты пациентов с «признаком» серповидноклеточности могут принимать форму серпа, вызывая симптомы, подобные наблюдаемым при серповидноклеточной анемии. Особенности фенотипических проявлений серповидноклеточной анемии: Лечение серповидноклеточной анемииКонкретному больному серповидноклеточной анемией дать точный прогноз тяжести течения болезни невозможно. Хотя молекулярная основа болезни стала известной раньше других моногенных заболеваний, лечение остается только симптоматическим. Никакой специфический терапии, предохраняющей от процесса образования серповидных эритроцитов, не найдено. Существенно снижает тяжесть болезни персистенция HbE Исследуется несколько фармакологических препаратов, нацеленных на увеличение концентрации HbF, в этих целях одобрено использование гидрокси-мочевины. Хотя генотерапия имеет шанс улучшить или излечить эту болезнь, эффективная пересадка гена b-глобина не достигнута. Пересадка костного мозга остается единственным доступным в настоящее время лечением, способным помочь при серповидноклеточной анемии. Из-за 11% смертности, вызванной сепсисом в первые 6 мес жизни, большинство штатов в США проводит неонатальный скрининг на серповидноклеточную анемию с целью проведения профилактики антибиотиками, продолжающейся до 5-летнего возраста. Риски наследования серповидноклеточной анемииПоскольку серповидноклеточная анемия — аутосомно-рецессивное заболевание, будущие сибсы больного ребенка имеют 25% риск серповидноклеточной анемии и 50% риск носительства серповидноклеточности. Используя ДНК плода, полученную при БВХ или амниоцентезе, можно провести пренатальную диагностику обнаружением мутации. Пример серповидноклеточной анемии. Второй раз за полгода семейная пара карибского происхождения обратилась со своей 24-месячной дочерью в отделение неотложной помощи, поскольку девочка не может стоять. В анамнезе отсутствуют повышение температуры, инфекция или травма, и в остальном медицинская история ничем не примечательна; данные предыдущих осмотров соответствовали норме, за исключением низкого уровня гемоглобина и слегка увеличенной селезенки. При текущем осмотре патологии не найдено, за исключением пальпируемого края селезенки и отека стоп. Стопы болезненны при пальпации, и девочка не хотела вставать на ноги. Оба родителя имели сибсов, умерших в детстве от инфекций, и других сибсов, вероятно, имевших серповидноклеточную анемию. С учетом анамнеза и повторного болезненного увеличения стоп врач проверил ребенка на наличие серповидноклеточной анемии методом электрофореза гемоглобина. Результат этого теста подтвердил наличие HbS. – Также рекомендуем “Болезнь Тея-Сакса: причины, диагностика, лечение” Оглавление темы “Врожденные болезни”:
|
Серповидно-клеточная анемия представляет собой довольно частую наследственную гемоглобинопатию, возникающую в основном у лиц с темным цветом кожи. Известно несколько сотен различных гемоглобинопатий, обусловленных мутациями генов глобина, но заслуживают обсуждения лишь те, которые ассоциируются с серповидно-клеточной анемией. Напомним, что гемоглобин (Hb) является тетрамерным белком, состоящим из двух пар цепей глобина, каждая из которых имеет свою группу гема.
Нормальные зрелые эритроциты содержат главным образом гемоглобин А (HbA; а2b2), а также некоторое количество гемоглобина А2 (HbА2; a2δ2) и фетального гемоглобина (HbF; а2γ2). Серповидно-клеточная анемия возникает в результате точечной мутации в кодоне 6 гена b-глобина, приводящей к замене остатка глутамата остатком валина. За развитие заболевания ответственны измененные физико-химические свойства образующегося гемоглобина S (HbS; a2bs2).
Около 8-10% лиц с темным цветом кожи гетерозиготны по HbS (в США 2 млн человек). Это в основном бессимптомное состояние, известное как признак серповидно-клеточности. Дети двух гетерозигот имеют шанс 1 : 4 родиться гомозиготами по данной мутации, т.е. с симптоматической серповидно-клеточной анемией. У таких индивидов почти весь гемоглобин в эритроцитах является HbS. В США насчитывают 70 тыс. лиц с серповидно-клеточной анемией. В некоторых популяциях в Африке число гетерозигот достигает 30%. Вероятно, столь высокие цифры являются следствием защиты, создаваемой HbS от малярии, вызываемой Р. falciparum.
а) Патогенез. Молекулы HbS полимеризуются при деоксигенации. По мере образования агрегатов HbS цитозоль эритроцитов сначала превращается из свободно текущей жидкости в вязкий гель. При продолжающейся деоксигенации агрегаты HbS формируют в эритроцитах длинные, похожие на иглы волокна, вследствие чего образуются серповидные или похожие на листья падуба (остролиста) эритроциты.
Присутствие HbS лежит в основе главных патологических проявлений серповидно-клеточной анемии:
(1) хронического гемолиза;
(2) окклюзии микрососудов;
(3) повреждения тканей.
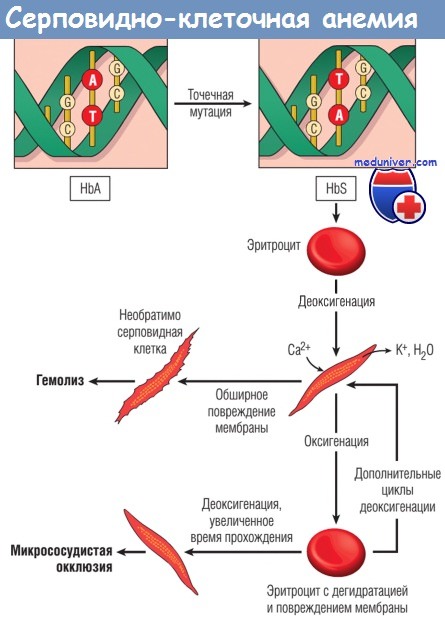
На скорость развития и тяжесть заболевания влияют различные факторы:
– взаимодействие HbS с другими типами гемоглобина в эритроците. У гетерозигот с признаком серповидно-клеточности « 40% гемоглобина представлено HbS, а оставшаяся часть — HbA, который препятствует полимеризации HbS. В результате эритроциты у гетерозигот не являются серповидными, исключая состояние глубокой гипоксии. HbF ингибирует полимеризацию HbS в еще большей степени, чем HbА, поэтому у детей симптомы не наблюдаются до возраста 5-6 мес, когда наступает естественное падение уровня HbF. Однако у некоторых индивидов уровень экспрессии HbF остается достаточно высоким — состояние, известное как наследственная персистенция HbF.
У таких пациентов серповидно-клеточная анемия гораздо менее тяжелая. Существует и другой вариант гемоглобина — HbС, у которого лизин замещен глутамином в позиции 6 аминокислотной последовательности гена b-глобина. В эритроцитах с HbSC содержание HbS составляет 50% по сравнению с 40% HbS в эритроцитах с HbAS. Кроме того, эритроциты с HbSC имеют тенденцию утрачивать соли и воду и становиться дегидратированными, что повышает внутриклеточную концентрацию HbS. Оба эти фактора усиливают тенденцию к полимеризации HbS. Вследствие этого у лиц с HbSC развивается симптоматическое серповидно-клеточное расстройство (гемоглобинопатия HbSC), менее тяжелое, чем серповидно-клеточная анемия. Примерно 1 из 1250 человек имеет гемоглобинопатию HbSC. Около 2-3% лиц с темным цветом кожи гетерозиготны по HbС и не имеют симптомов;
– средняя концентрация гемоглобина в эритроците. Более высокие концентрации HbS повышают вероятность агрегации и полимеризации во время деоксигенации. Так, дегидратация, увеличивающая среднюю концентрацию гемоглобина в эритроците, облегчает образование серповидных эритроцитов. И наоборот, условия, снижающие среднюю концентрацию гемоглобина в эритроците, уменьшают тяжесть заболевания. Это происходит, когда индивид гомозиготен по HbS, но также одновременно присутствует а-талассемия, снижающая синтез Hb, что приводит к более мягкому течению серповидно-клеточной анемии;
– внутриклеточный pH. Снижение pH уменьшает аффинность гемоглобина к кислороду, тем самым увеличивая фракцию деоксигенированного HbS при любом уровне напряжения кислорода и усиливая тенденцию к образованию серповидных форм;
– время перехода эритроцитов по микрососудам. Как будет указано далее, значительная часть патологических явлений при серповидно-клеточной анемии обусловлена микрососудистой окклюзией, вызванной серповидными эритроцитами. Время перемещения клеток в нормальных микрососудах слишком мало для значительной агрегации деоксигенированного HbS, поэтому образование серповидных форм идет там, где переход совершается медленно, — в нормальной селезенке и костном мозге (которые в результате этого существенно повреждаются при серповидно-клеточной анемии), а также в сосудистом ложе на фоне воспаления. Ток крови через воспаленные ткани замедляется вследствие адгезии эритроцитов и лейкоцитов к активированным эндотелиальным клеткам и выхода жидкости через сосуды с повышенной проницаемостью в результате воспаления. Вследствие этого сосудистое ложе склонно к формированию серповидных форм и окклюзии. Серповидные эритроциты могут усиленно экспрессировать некоторые молекулы адгезии, участвующие в связывании с эндотелиальными клетками.
Есть также данные о том, что серповидные эритроциты способны в определенной степени активировать эндотелий, что может содействовать адгезии эритроцитов и гранулоцитов, гипоксии, индуцированной окклюзией сосудов, и другим изменениям.
Образование серповидных форм обусловлено кумулятивным повреждением эритроцитов разными механизмами. По мере усиления полимеризации HbS выпячиваются через скелет мембраны из клетки, покрытой только липидным бислоем. Это серьезное нарушение скелета мембраны вызывает приток Са2+, индуцирующих перекрестное связывание мембранных белков и активирующих ионные каналы, через которые происходит отток К+ и воды. В случае повторных эпизодов болезни эритроциты становятся все более дегидратированными, плотными и ригидными. В итоге наиболее поврежденные клетки превращаются в необратимо серповидные эритроциты (сохраняющие серповидную форму даже при полной оксигенации). Тяжесть гемолиза коррелирует с процентом необратимо серповидных эритроцитов, которые быстро секвестрируются и удаляются мононуклеарными фагоцитами (внесосудистый гемолиз). Серповидные эритроциты также нестойки при механических воздействиях, что приводит к внутрисосудистому гемолизу определенной степени.
Патогенез микрососудистой окклюзии, ответственной за наиболее серьезные клинические проявления, менее изучен. Микрососудистая окклюзия не связана с количеством необратимо серповидных эритроцитов в крови, а может зависеть от ультраструктурных повреждений мембраны эритроцитов и других факторов, в частности воспаления, замедляющего или останавливающего перемещение эритроцитов через микрососудистое ложе. Как указано ранее, серповидные эритроциты экспрессируют более высокий, чем в норме, уровень молекул адгезии и обладают адгезивными свойствами. Медиаторы, высвобождаемые гранулоцитами в ходе воспалительной реакции, повышают экспрессию молекул адгезии эндотелиальными клетками и еще больше усиливают тенденцию эритроцитов задерживаться во время перехода по микрососудам. О возможной роли воспалительных клеток свидетельствует тот факт, что количество лейкоцитов коррелирует с частотой вазоокклюзионных кризов и других проявлений повреждений тканей. Застой эритроцитов в воспаленном сосудистом ложе приводит к длительному снижению напряжения кислорода, образованию серповидных форм и микрососудистой окклюзии.
Начинается цепь событий, создающих порочный круг: образование серповидных эритроцитов, обструкция, гипоксия и дальнейшее формирование серповидных эритроцитов.
Снижение уровня оксида азота (NO) также играет определенную роль в сосудистой окклюзии. Свободный гемоглобин, высвобождаемый из лизированных серповидных эритроцитов, может связывать и инактивировать NO, обладающий свойствами сильного вазодилататора и ингибитора агрегации тромбоцитов. Снижение уровня NO повышает сосудистый тонус (происходит сужение сосудов) и усиливает агрегацию тромбоцитов. Оба эффекта способствуют стазу, формированию серповидных эритроцитов и тромбозу (в некоторых случаях).
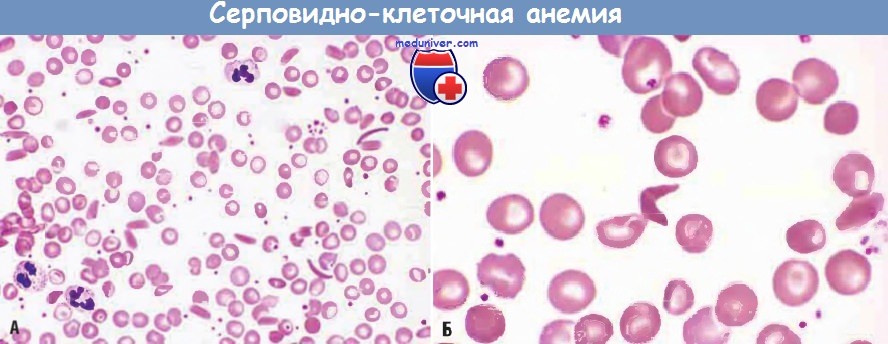
Серповидно-клеточная анемия (мазок периферической крови):
(А) При малом увеличении видны серповидные клетки, анизоцитоз и пойкилоцитоз.
(Б) При большом увеличении можно видеть в центре необратимо серповидную клетку.
б) Морфология. При полностью развившейся серповидно-клеточной анемии в периферической крови обнаруживаются значительное количество серповидных клеток, ретикулоцитоз и клетки-мишени (названные так потому, что гемоглобин скапливается в центре клеток), образующиеся в результате дегидратации эритроцитов. В некоторых эритроцитах также присутствуют тельца Хауэлла-Жолли (мелкие темные остатки ядра) вследствие асплении. Костный мозг гиперпластичный в результате компенсаторной эритроидной гиперплазии. Экспансия костного мозга приводит к костной резорбции и вторичному остеогенезу, что проявляется деформациями костей черепа. Также возможен экстрамедуллярный гемопоэз. Повышенное расщепление гемоглобина способно вызвать образование пигментных желчных камней и гипербилирубинемию.
В раннем детстве селезенка увеличивается до 500 г вследствие застоя крови в красной пульпе, обусловленного накоплением серповидных эритроцитов в тяжах и синусоидах. Однако со временем хронический стаз эритроцитов приводит к инфарктам селезенки, фиброзу и прогрессирующему сморщиванию органа, и уже в подростковом возрасте или у молодых взрослых от селезенки остается лишь незначительное количество фиброзной ткани. Этот процесс носит название аутоспленэктомии. Инфаркты, обусловленные сосудистыми окклюзиями, могут происходит во многих других тканях, включая кости, головной мозг, почки, печень, сетчатку глаза и сосуды легких (в последнем случае иногда развивается легочное сердце). У взрослых пациентов застой крови в сосудах подкожно-жировой ткани часто приводит к образованию язв нижних конечностей, у детей это осложнение наблюдается очень редко.
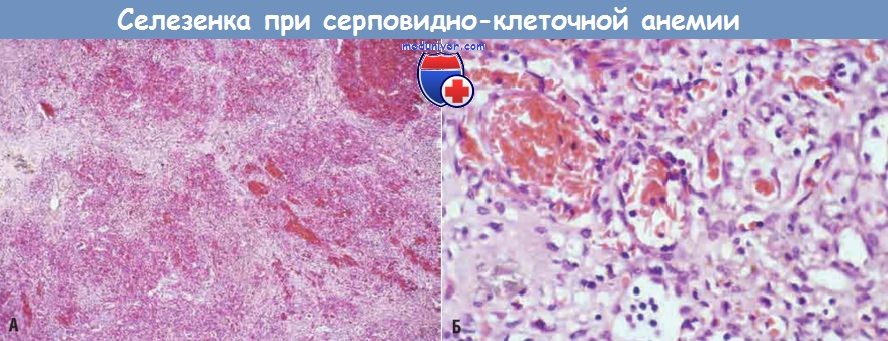
(А) Селезенка при серповидно-клеточной анемии (малое увеличение).
Тяжи красной пульпы и синусоиды заметно застойны; между районами застоя видны светлые участки фиброза, возникшего в результате ишемического повреждения.
(Б) При большом увеличении видны расширенные селезеночные синусоиды, заполненные серповидными эритроцитами.
в) Клинические признаки. Серповидно-клеточная анемия вызывает умеренно тяжелую гемолитическую анемию (уровень гематокрита 18-30%), ассоциированную с ретикулоцитозом, гипербилирубинемией и присутствием серповидных эритроцитов. Течение заболевания прерывается разнообразными вазоокклюзионными кризами {болевыми кризами), которые представляют собой эпизоды гипоксического повреждения и некроза, вызывающие сильную боль в пораженной области. Пусковым стимулом могут быть инфекция, дегидратация и ацидоз (все эти факторы способствуют образованию серповидных эритроцитов), однако в большинстве случаев причину установить не удается. Объектом поражения в основном служат кости, легкие, печень, головной мозг, селезенка и пенис. У детей очень часто отмечаются костные вазоокклюзионные кризы, которые нередко трудно отличить от проявлений острого остеомиелита. Поражение часто проявляется в виде синдрома «кисть-стопа» (дактилит костей стоп и/или кистей). Острый грудной синдром — особенно опасный тип вазоокклюзионного криза, поражающего легкие. Обычно отмечаются лихорадка, кашель и легочные инфильтраты.
Воспаление замедляет кровоток в ткани легких, что приводит к образованию серповидных эритроцитов и сосудистой окклюзии. Функция легких нарушается, и создается потенциально фатальный порочный круг: усиление легочной и системной гипоксемии ведет к образованию серповидных эритроцитов, что, в свою очередь, усиливает гипоксемию. Другие формы сосудистой окклюзии, особенно инсульт, также могут стать жизнеугрожающими состояниями. Предрасполагающими факторами служат адгезия серповидных эритроцитов к эндотелию артерий и вазоконстрикция, обусловленная связыванием NO свободным гемоглобином. Вазоокклюзионные кризы представляют собой наиболее частую причину смерти пациентов, но течение заболевания осложняют и другие острые процессы.
Секвестрационные кризы наблюдаются у детей с интактной селезенкой. Значительное накопление серповидных эритроцитов приводит к быстрому увеличению селезенки, гиповолемии, иногда к шоку. В некоторых случаях эти осложнения могут привести к летальному исходу. При секвестрационном кризе и остром грудном синдроме необходима экстренная обменная гемотрансфузия.
Апластические кризы происходят в результате инфицирования клеток-предшественников эритроцитов парвовирусом В19, вызывающим временное прекращение эритропоэза, в результате которого анемия утяжеляется.
Помимо неблагоприятного воздействия кризов отрицательное влияние, хотя и не сразу замечаемое, оказывает хроническая системная гипоксия. Она ответственна за нарушение роста и развития организма, а также повреждение органов, включая селезенку, сердце, почки и легкие. Образование серповидных эритроцитов на фоне повышенного давления в мозговом веществе почек вызывает повреждения, приводящие со временем к гипостенурии (неспособности концентрировать мочу), которая создает условия для дегидратации с присущим ей риском.
Другой опасностью является повышенная восприимчивость к инфекциям, вызываемым капсульными микроорганизмами. В значительной степени это связано с изменением функций селезенки в результате застоя и замедления кровотока (у детей) или инфарктов (у взрослых). Дефекты неизвестной этиологии альтернативного пути активации системы комплемента также нарушают процесс опсонизации бактерий. Частоту септицемии и менингита, вызываемых Р. pneumoniae и Н. influenzae и являющихся частой причиной смерти (особенно детей), можно снизить с помощью вакцинации и профилактического применения антибиотиков.
Следует подчеркнуть, что существуют различные клинические проявления серповидно-клеточной анемии. Некоторые пациенты страдают от повторных вазоокклюзионных кризов, тогда как у других отмечаются лишь незначительные симптомы. Причины такой широкой вариабельности заболевания неизвестны.
Диагноз ставят на основании клинических признаков и присутствия необратимо серповидных эритроцитов. Подтверждают диагноз различными тестами, с помощью которых выявляют HbS. Образцы крови смешивают с реагентами, потребляющими кислород (например, метабисульфитом), которые в случае присутствия HbS индуцируют образование серповидных эритроцитов. Используют также метод электрофореза, чтобы установить присутствие HbS и исключить серповидно-клеточные гемоглобинопатии, например гемоглобинопатию HbSC. Возможна пренатальная диагностика с помощью анализа фетальной ДНК, получаемой путем амниоцентеза или биопсии хориона.
Прогноз для пациентов с серповидно-клеточной анемией в последние 10-20 лет стал значительно лучше. Около 90% пациентов доживают до 20 лет, а 50% живут дольше 40 лет. Терапия заключается в назначении гидроксимочевины, ингибитора синтеза ДНК. Благоприятные эффекты гидроксимочевины: (1) повышение уровня HbF (механизм неизвестен); (2) противовоспалительный эффект вследствие ингибирования продукции лейкоцитов. Предполагают, что благодаря этим совместным эффектам (а возможно, и другим) вазоокклюзионные кризы удается купировать.
Аутоспленэктомия при серповидно-клеточной анемии.
– Рекомендуем ознакомиться со следующей статьей “Механизмы развития (патогенез) бета-талассемии”
Оглавление темы “Патогенез анемий”:
- Механизмы развития (патогенез) серповидно-клеточной анемии
- Механизмы развития (патогенез) бета-талассемии
- Механизмы развития (патогенез) альфа-талассемии
- Механизмы развития (патогенез) пароксизмальной ночной гемоглобинурии
- Механизмы развития (патогенез) иммуногемолитической анемии
- Механизмы развития (патогенез) мегалобластной анемии
- Механизмы развития (патогенез) пернициозной анемии
- Механизмы развития (патогенез) анемии при дефиците фолиевой кислоты
- Механизмы развития (патогенез) железодефицитной анемии
- Механизмы развития (патогенез) анемии из-за хронического заболевания
