Механизмы анемии при лейкозе
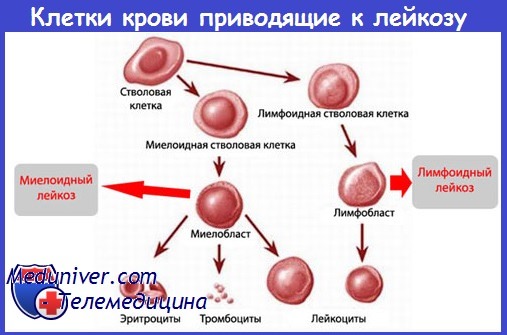
Механизмы развития острого лейкоза – патогенез
Острые лейкозы возникают вследствие клональной неопластической пролиферации бластных клеток, которые характеризуются блокадой дифференцировки в более зрелые клетки крови и способностью к практически неограниченному делению. При остром лейкозе опухоль представляет собой клон — потомство одной злокачественной клетки. Накапливаясь в костном мозге, лейкозные бласты вытесняют клетки нормального гемопоэза, что, в конечном счете, приводит к появлению симптомов заболевания.
При лабораторных исследованиях острого лейкоза в организме больного обнаруживается около 1011 бластных клеток, при развитии клинической симптоматики — 1012 бластов (приблизительно один килограмм).
Лейкозные клетки циркулируют в крови и могут вызывать поражение других органов и тканей (частота и характер поражения зависят от варианта острого лейкоза). В отличие от хронических лейкозов, имеющих фенотипические и биологические характеристики более зрелых клеток, острый лейкоз развиваются и биологически сходны с примитивными гемопоэтическими клетками-предшественницами. Фенотипическая гетерогенность лейкозных клеток свидетельствует, что острые лейкозы (ОЛ) могут возникать на различных стадиях дифференцировки.

Наиболее существенные моменты патогенеза:
1. В большинстве случаев острого лейкоза (ОЛ) развиваются из клеток, коммитированных в направлении миело- или лимфопоэза, реже вовлекается несколько клеточных линий. Это объясняет разнообразие клинического течения и ответа на терапию при различных типах бластных клеток, составляющих опухолевый клон.
2. Для острого лейкоза характерна опухолевая прогрессия: по мере развития заболевания появляются клоны лейкозных клеток с новыми свойствами (морфологическими, цитохимическими, иммунологическими и т. д.), что объясняет развитие резистентности к ранее эффективному лечению.
3. Развитие большинства клинических проявлений и данных лабораторных исследований (анемия, геморрагический синдром, лихорадка) обусловлено «вытеснением» нормальной гемопоэтической ткани лейкозным клоном.
4. По мере прогрессирования острого лейкоза (реже — с начала заболевания) происходит метастазирование бластных клеток за пределы органов кроветворения. Это приводит к развитию специфической (бластной) инфильтрации внутренних органов, лимфатической ткани, кожи, слизистых оболочек и может сопровождаться функциональной недостаточностью различных внутренних органов, органомегалией, лимфоаденопатией, гиперпластическим гингивитом, лейкемидами кожи и т. д.
В ряде случаев при остром лейкозе (чаще — остром лимфобластном лейкозе (ОЛЛ)) бластные клетки метастазируют в центральную нервную систему, что приводит к развитию нейролейкоза.
5. Пролиферация бластных клеток и их гибель сопровождаются развитием интоксикационного синдрома и метаболических нарушений, которые возникают у большинства пациентов.
– Также рекомендуем “Клиника острого лейкоза – симптомы”
Оглавление темы “Острые лейкозы”:
- Острые лейкозы – история изучения, причины
- Механизмы развития острого лейкоза – патогенез
- Клиника острого лейкоза – симптомы
- Лабораторная диагностика острого лейкоза – анализы
- Дифференциальная диагностика острого лейкоза
- Классификация острых лейкозов
- Морфология и цитохимия острых лейкозов – цитохимические реакции
- Иммунофенотипирование острых лейкозов – цели, задачи
- Цитогенетические исследования при остром лейкозе – кариотипы
- Принципы химиотерапии острых лейкозов – основы лечения
Лейкоз – системное опухолевое заболевание кроветворной ткани, характеризующееся бесконтрольной пролиферацией клеток и нарушением их дифференцировки.
Этиология:
I. Вирусная теория (выделены онковирусы, вирус гепатита В – рак печени.)
II. Теория химических канцерогенов (экзогенные химические канцерогены – гл.14 Зайко, эндогенные химические канцерогены образуются в ходе обмена в-в – холестерина и его производных, триптофана, эстрогенов).
Общие свойства канцерогенов:
- способность проникать через мембраны клеток,
- способность влиять на геном,
- дозированность эффектов,
- органотропность,
- синканцерогенез – способность канцерогенов усиливать действие друг друга.
III. Теория физического воздействия – действие радиации.
Условия превращения нормальных клеток в опухолевые:
- Наследственная предрасположенность.
- Конституция человека.
- Особенности питания (мало молока, много пищи содержащей холестерин и жирные кислоты).
- Гиповитаминоз (А, Е, С).
- Возрастные особенности нервной, эндокринной, и кроветворной систем.
Патогенез опухолевого роста:
Основное звено – образование мутантной клетки.
Сначала она латентная, затем превращается в опухолевую.
Механизмы превращения:
1. Геномный (мутация)
2. Эпигеномный (нарушение регуляции геномов, в результате чего происходит репрессирование генов, регулирующих клеточное размножение).
Развитие лейкозов характеризуются стадийностью:
- Стадия трансформации (инициации) – образование мутантной клетки носит обратимый характер.
- Стадия активации (промоции) – из мутантной клетки образуется опухолевая клетка.
- Стадия опухолевой прогрессии.
Ведущие факторы патогенеза:
- Неэффективность иммунного надзора.
- Нарушение регуляции и саморегуляции клетки.
При лейкозах изменения происходят на следующих уровнях:
- молекулярном,
- клеточном,
- тканевом,
- органном,
- системном,
- организменном.
В результате нарушения саморегуляции формируются основные свойства опухолевой клетки: изменение белкового синтеза (антигенного и рецепторного аппарата), активация гликолиза и перекисного окисления (образуются свободные радикалы и она становится вооруженной по отношению к другим клеткам), способность бесконтрольной пролиферации и автономность, образование клеткой токсичных веществ, способность к метастазированию, способность с помощью ферментов раздвигать соседние ткани и осуществлять инфильтративный рост.
Признаки опухолевой прогрессии при лейкозах:
- Утрата ферментативной специфичности.
- Морфологические и структурные изменения в клетках (нарушение соотношения ядра и протоплазмы в сторону увеличения ядра).
- Способность клеток выходить за пределы кроветворного аппарата и размножаться в различных органах и тканях (вытеснение опухолевым ростком других ростков кроветворения).
- Увеличение числа клеток в крови (развитие лейкоцитоза и гиперлейкоцитоза, если увеличено количество бластных клеток – бластный криз).
- Постепенный или скачкообразный выход клеток из под контроля цитостатиков.
Гематологические изменения со стороны белой крови и других ростков:
- Анемия
- Тромбоцитопения
- Резкое ↑ СОЭ
Общие:
- Геморрагический синдром
- Лихорадка
- Нарушение функции ЖКТ, печени, селезенки вследствие их лейкозного поражения.
Классификация лейкозов:
I. В зависимости от степени дифференцировки клеток и скорости течения:
a. острые
b. хронические
II. По характеру пораженного ростка:
a. миелоидные
b. лимфоидные
c. недифференцированные
d. ретикулезы
III. По количеству клеток в крови:
a. лейкемические (выше 50*109/л)
b. сублейкемические (10-50*109/л)
c. алейкемические (норма или до 10*109/л)
d. лейкопенические (меньше 4*109/л )
Механизмы развития анемии при лейкозах:
- Вытеснение эритроидного ростка опухолевым.
- Угнетение эритропоэза токсинами лейкоз.клеток.
- Нарушение всасывания витамина В12 и железа в результате повреждения ЖКТ лейкозными инфильтратами, уменьшение секреции желудочного сока → дисэритропоэтическая анемия.
- Снижение РОЭ (снижение устойчивости эритроцита к гемолизу) → гемолитическая анемия.
- Кровотечения в результате геморрагического синдрома → постгеморрагическая анемия.
По патогенезу анемии при лейкозах смешанные!
(постгеморрагическая, гемолитическая, дисэритропоэтическая).
Механизмы развития геморрагического синдрома анемии при лейкозах:
- Вытеснение мегакариоцитарного ростка опухолевым.
- Токсическое повреждение его опухолевыми клетками.
- Токсические васкулиты.
- Инфильтративные васкулиты (лейкозная инфильтрация сосудистой стенки).
- Коагулопатия потребления из-за увеличения расхода прокоагулянтов в результате ДВС-синдрома.
- Нарушение синтеза факторов свертывания крови в печени в результате её лейкозного поражения.
Картина крови при отдельных видах лейкоза:
- Острый миелолейкоз:
- Лейкоцитоз с наличием миелобластов.
- Наличие лейкемического провала (отсутствие промежуточных форм клеток между зрелыми клетками и бластами).
- Базофильно-эозинофильная диссоциация – 0-БФ, ↑-ЭФ.
- Хронический миелолейкоз:
- Лейкоцитоз (без миелобластов, без терминальных стадий).
- Отсутствие лейкемического провала.
- БФ-ЭФ ассоциация – ↑-БФ, ↑-ЭФ.
- Хронический лимфолейкоз:
- Лейкоцитоз лимфоцитарный.
- Качественные изменения клеток: наличие в мазке клеток Боткина-Гумпрехта, веретенообразных и голоядерных лимфоцитов.
- Острый лимфолейкоз
- Лейкоцитоз с наличием лимфобластов (клетки средних размеров, ядро округлой формы, занимает большую часть цитоплазмы, зернистости нет).
Принципы лечения лейкозов:
- Цитостатики.
- Химиотерапия.
- Гормонотерапия (преднизолон).
- Лучевая терапия.
- Антиоксиданты.
- Оксиданты.
- Симптоматическое лечение.
Факторы риска в развитии лейкозов:
- Лейкопении, лейкоцитозы непонятной этиологии.
- Радиационное воздействие (внутриутробный период).
- Различные вирусные заболевания.
Замещение кроветворной ткани опухолевыми клетками (при лейкозах, метастазах рака в костный мозг) приводит к развитию метапластической анемии. При воздействии на костный мозг указанных выше факторов повреждаются и гибнут стволовые клетки, подавляются процессы деления и созревания кроветворных клеток, сокращается объем кроветворной ткани, что ведет к опустошению (аплазии) костного мозга. Отмечается прогрессирующее падение эритропоэза. Количество эритроцитов падает до 1,103/мкл и даже ниже, резко снижается содержание в крови гемоглобина, цветовой показатель остается в пределах нормы. Как правило, анемия сочетается с лейкопенией и тромбоцитопенией.
Все это сочетается с падением продукции тромбоцитов, что сопровождается кровоизлияниями в жизненноважные органы и кровотечениями из носа, десен, кишечника (геморрагический синдром), что еще больше усугубляет анемию.
При голодании происходит исчерпание запасов доступных углеводов, сопряженное с мобилизацией свободных жирных кислот. Увеличение их концентрации в крови, а также нарастающий энергодефицит, вызванный низким содержанием глюкозы в крови, стимулируют усиленный кетогенез в печени. В результате быстрого окисления свободных жирных кислот образуются значительные количества ацетоацетата и D(-)-3-гидроксибутирата, которые диффундируют в кровь. Однако в отличие от диабетического кетоацидоза при СД I такого грозного последствия как кома здесь не возникает, т.к. для этого необходим также высокий уровень глюкозы в крови и возникающая в результате этого (и ряда других факторов) дегидратация Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. В 2 Т. – М.: «Мир», 1993. с. 289. .
Кардиальные адаптационно-компенсаторные механизмы имеют большое патогенетическое значение при хронической сердечной недостаточности. Под влиянием нейрогуморальных (нейрогормональных) воздействий, а также нередко вследствие влияния самого этиологического фактора (например, препятствия для выброса крови из левого желудочка при аортальном стенозе и т. д.) развивается концентрическая или эксцентрическая гипертрофия миокарда. Длительное существование увеличенной постнагрузки приводит к развитию концентрической гипертрофии миокарда — то есть к утолщению мышечной стенки без расширения полости желудочка. Увеличение толщины миокарда при концентрической гипертрофии позволяет развивать достаточное внутрижелудочковое давление в систолу и преодолеть значительно увеличенную постнагрузку и обеспечить адекватную перфузию органов и тканей. При увеличении преднагрузки постепенно развивается эксцентрическая гипертрофия, то есть умеренная гипертрофия миокарда, сопровождающаяся тоногенной дилатацией полости желудочка.
При миокардиальной недостаточности, то есть при хронической сердечной недостаточности, обусловленной поражением самого миокарда также развивается гипертрофия сердечной мышцы с тоногенной дилатацией левого желудочка различной степени выраженности.
Гипертрофия миокарда и умеренная тоногенная дилатация левого желудочка в течение определенного времени обеспечивают сохранение достаточной величины сердечного выброса, что происходит в соответствии с законом Старлинга. Как известно, имеется зависимость силы сокращения от исходной длины мышечного волокна, и эта зависимость является решающим фактором, определяющим функцию миокарда. Увеличение исходной длины мышечного волокна сопровождается возрастанием максимальной развиваемой силы сокращения (Braunwald и соавт., 1976). В соответствии с законом Стерлинга увеличение исходного конечного диастолического объема желудочка приводит к усилению его сокращения, что позволяет преодолеть увеличенную преднагрузку и постнагрузку.
Таким образом, с помощью гипертрофии миокарда, умеренной тоногенной дилатации желудочков и в соответствии с законом Стар-линга сердцу удается в течение определенного времени сохранять должную величину сердечного выброса и минутного объема и обеспечивать адекватное кровоснабжение органов и тканей. Однако с течением времени в условиях продолжающейся гемодинамической перегрузки или непосредственного повреждения миокарда компенсаторная реакция сердца становится недостаточной, эффективность механизма Стерлинга резко уменьшается при повышении конечного диастолического давления в левом желудочке выше 18– 20 мм рт. ст., сердечный выброс снижается. Уменьшение насосной функции сердца запускает процессы ремоделирования сердца, которые происходят под влиянием всех вышеуказанных патогенетических механизмов сердечной недостаточности, прежде всего высокой активности нейрогормональных систем, активности провос-палительных цитокинов, индукции апоптоза.
Согласно определению Pfeffer (1985), ремоделирование — это структурно-геометрические изменения левого желудочка, включающие в себя процессы гипертрофии миокарда и дилатации сердца, приводящие к изменению его геометрии и нарушению систолической и диастолической функции.
Основные компоненты ремоделирования левого желудочка представлены в табл. 40 и включают изменения на уровне отдельных кардиомиоцитов, изменения на уровне миокарда левого желудочка и изменения геометрии левого желудочка Окороков А.Н. Диагностика болезней внутренних органов. Т. 9. – М.: Медицинская литература, 2005. – с. 342-343..

Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
Patologia_krovi.doc
Скачиваний:
77
Добавлен:
20.05.2015
Размер:
228.35 Кб
Скачать
Утрата ферментативной специфичности.
Морфологические и структурные изменения
в клетках (нарушение соотношения ядра
и протоплазмы в сторону увеличения
ядра).Способность клеток выходить за пределы
кроветворного аппарата и размножаться
в различных органах и тканях (вытеснение
опухолевым ростком других ростков
кроветворения).Увеличение числа клеток в крови (развитие
лейкоцитоза и гиперлейкоцитоза, если
увеличено количество бластных клеток
– бластный криз).Постепенный или скачкообразный выход
клеток из под контроля цитостатиков.
Гематологические изменения со стороны
белой крови и других ростков:
Анемия
Тромбоцитопения
Резкое ↑ СОЭ
Общие:
Геморрагический синдром
Лихорадка
Нарушение функции ЖКТ, печени, селезенки
вследствие их лейкозного поражения.
Классификация лейкозов:
В зависимости от степени дифференцировки
клеток и скорости течения:острые
хронические
По характеру пораженного ростка:
миелоидные
лимфоидные
недифференцированные
ретикулезы
По количеству клеток в крови:
лейкемические (выше 50*109/л)
сублейкемические (10-50*109/л)
алейкемические (норма или до 10*109/л)
лейкопенические (меньше 4*109/л )
Механизмы развития анемии при лейкозах:
Вытеснение эритроидного ростка
опухолевым.Угнетение эритропоэза токсинами
лейкоз.клеток.Нарушение всасывания витамина В12и железа в результате повреждения ЖКТ
лейкозными инфильтратами, уменьшение
секреции желудочного сока →
дисэритропоэтическая анемия.Снижение РОЭ (снижение устойчивости
эритроцита к гемолизу) → гемолитическая
анемия.Кровотечения в результате геморрагического
синдрома → постгеморрагическая анемия.
По патогенезу анемии при лейкозах
смешанные!
(постгеморрагическая, гемолитическая,
дисэритропоэтическая).
Механизмы развития геморрагического синдрома анемии при лейкозах:
Вытеснение мегакариоцитарного ростка
опухолевым.Токсическое повреждение его опухолевыми
клетками.Токсические васкулиты.
Инфильтративные васкулиты (лейкозная
инфильтрация сосудистой стенки).Коагулопатия потребления из-за увеличения
расхода прокоагулянтов в результате
ДВС-синдрома.Нарушение синтеза факторов свертывания
крови в печени в результате её лейкозного
поражения.
Картина крови при отдельных видах лейкоза:
Острый миелолейкоз:
Лейкоцитоз с наличием миелобластов.
Наличие лейкемического провала
(отсутствие промежуточных форм клеток
между зрелыми клетками и бластами).Базофильно-эозинофильная диссоциация
– 0-БФ, ↑-ЭФ.
Хронический миелолейкоз:
Лейкоцитоз (без миелобластов, без
терминальных стадий).
Отсутствие лейкемического провала.
БФ-ЭФ ассоциация – ↑-БФ, ↑-ЭФ.
Хронический лимфолейкоз:
Лейкоцитоз лимфоцитарный.
Качественные изменения клеток: наличие
в мазке клеток Боткина-Гумпрехта,
веретенообразных и голоядерных
лимфоцитов.
Острый лимфолейкоз
Лейкоцитоз с наличием лимфобластов
(клетки средних размеров, ядро округлой
формы, занимает большую часть цитоплазмы,
зернистости нет).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
20.05.201516.58 Mб13Pediatria_Tyazhkaya_2011_na_russkom_2.pdf
