Микроангиопатическая гемолитическая анемия у детей
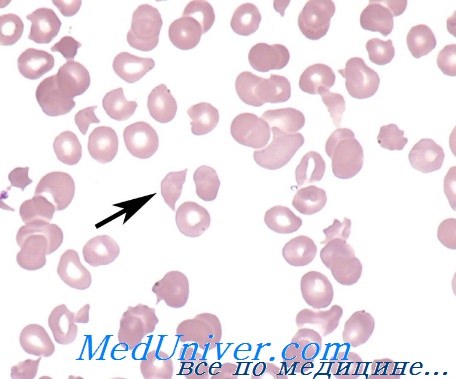
Микроангиопатическая гемолитическая анемия – история изучения, причиныМикроангиопатическая гемолитическая анемия (МГА) относится к группе приобретенных гемолитических анемий по внеэритоцитным причинам, точнее — к подгруппе механических гемолитических анемий. Микроангиопатическая гемолитическая анемия представляет собой частную форму гемолитической анемии, характеризующуся наличием раздробленных эритроцитов («шлемообразные », треугольные, зубчатые, микросфероциты) на мазках крови и признаками внутрисосудистого расплавления крови. Часто тромбоцитопения и расстройство свертывания (Brain) сопровождают микроангиопатическую гемолитическую анемию. Подобно иным видам анемии, микроангиопатическая гемолитическая анемия не составляет самостоятельную единицу, а лишь синдром, развивающийся при ином заболевании или синдроме. Болезни, при которых была описана микроангиопатическая гемолитическая анемия носят общий характер — патологическое изменение небольших сосудов, артериол и капилляров (микроаигиопатия). В 1891 г. Ehrlich впервые отметил наличие раздробленных эритроцитов («шистоциты») на мазке страдающего анемией. В 1949 Schwartz и Motto описали присутствие 0,1—0,5% «надрезанных» (“burr cells”) эритроцитов в мазках крови больных уремией, раком желудка и пептической геморрагической язвой. В 1954 г. Monroe и Strauss сообщили о выявлении раздробленных эритроцитов на срезах отдельных кровеносных сосудов больного, погибшего от тромботической тромбогемолитической пурпуры. Они выдвинули гипотезу, по которой раздробление эритроцитов якобы происходит в ненормальных кровеносных сосудах. В 1962 Brain, Dacie и Hourihane впервые использовали термин «микроангионатическая гемолитическая анемия». В период с 1962 по 1972 гг. Brain и Dacie, в сотрудничестве с другими исследователями, поставили эксперимент микроангиопатической гемолитической анемии на животных, изучили механизм дробления эритроцитов в пробирке, описали процесс внутрисосудистого свертывания у страдающих микроангиопатической гемолитической анемией, реакцию на лечение гепарином и сочетание микроангиопатической гемолитической анемии с метастатическим раком. Понятие микроангиопатической гемолитической анемии общепринято и подтверждено другими авторами. С 1961 г. в литературе был опубликован ряд сообщений о гемолитической анемии, в условиях которой, после хирургического вмешательства на сердце по поводу клапанопластики, протезирования синтетическими клапанами и исправления внутрисердечных дефектов. Гемолитическая анемия с дроблением эритроцитов описана у больных, страдающих тяжелой недостаточностью клапанов (в частности сужение аорты) и коарктацией аорты.
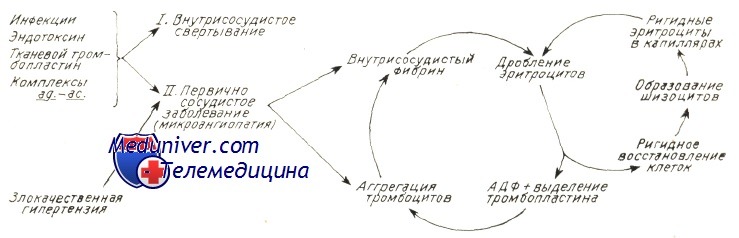
Причины (этиология) микроангиопатической гемолитической анемииМикроангиопатическая гемолитическая анемия описана в сочетании с рядом иных заболеваний. Наличие процесса расплавления крови с последующим дроблением эритроцитов предполагает следующие патогенетические механизмы: В патологии человека микроангиопатическая гемолитическая анемия описана в сочетании с сосудистыми заболеваниями, обусловленными обоими механизмами. В случае первичного сосудистого нарушения или вызванного процессом внутрисосудистого свертывания тромбы фибрина и тромбоциты частично закупоривают просвет мелких сосудов. Волоски фибрина действуют на движущиеся эритроциты подобно «гильотине » и тем самым обусловливают их дробление. Те фрагменты эритроцитов, у которых поверхностная оболочка меньше соответствующего объема, быстро захватываются макрофагами селезенки. Другие же, у которых отношение площадь/ объем превышает норму (за счет перехода гемоглобина в плазму или в результате дробления) подвергаются процессу рубцевания («повторному запечатыванию») оболочки и остаются в кровообращении, представляя собой «ключ» к постановке диагноза основного заболевания. В результате этого процесса рубцевания оболочки появляются жесткие эритроциты — сфероциты, “шлемообразные” эритроциты, которые подвергаются повторному дроблению при переходе через капилляры. Дробление эритроцитов сопровождается выделением АДФ и фосфолипидного прокоагулянта, что снова ведет к аггрегации тромбоцитов и отложению фибрина в мелких сосудах, тем самым усиливая процесс внутрисосудистого свертывания. На рисунке приводится модель патогенеза микроангиопатической гемолитической анемии. Необходимо отметить, что не у всех больных с рассеянным внутрисосудистым свертыванием наблюдается микроангиопатическая гемолитическая анемия. Для ее развития важно, чтобы фибрин удержался в кровообращении достаточный период времени. Сохранение запасов фибрина в мелких сосудах зависит от ритма дефибринизации, клиренса макрофаговой системы и местного фибринолиза.
Болезни, сопутствующие микроангиопатической гемолитической анемии (МГА)1. Тромбогемолитическая тромботическая пурпура (РТТ) 2. Уремический гемолитический синдром При микроангиопатической гемолитической анемии, встречающейся в заболеваниях метастазом рака, эритроциты разрушаются механическим путем в малых сосудах, измененных: – Также рекомендуем “Диагностика микроангиопатической гемолитической анемии – дифференциация” Оглавление темы “Гемолитические анемии”:
|
Термин «микроангиопатическая
гемолитическая анемия» (МАГА), предложенный
Симмерсом в 1952 году, используется для
обозначения гемолитического синдрома,
в основе которого лежит фрагментация
эритроцитов во время их циркуляции по
измененным мелким сосудам.
Наиболее часто МАГА наблюдается
иммунокомпетентной патологии и синдроме
диссеминированного внутрисосудистого
свертывания (ДВС), обусловливающих
развитие:
гемолитико-уремического синдрома;
тромботической тромбоцитопенической
пурпуры;синдрома острой дефибринации при
преждевременной отслойке плаценты,
эмболии околоплодными водами и других
заболеваниях.
Этиология и патогенез.
Поражение мелких сосудов (в основном
артериол) при иммунокомплексной патологии
и ДВС состоит в нарушении целостности
сосудистого эндотелия и внутрисосудистом
отложении фибрина. Эритроциты, проходя
через небольшие отверстия между нитями
фибрина или контактируя с отростками
клеток поврежденного эндотелия,
травмируются, в результате чего они
распадаются на отдельные фрагменты
(шистоциты) или теряют часть оболочки,
принимая форму микросфероцитов.
Интенсивность фрагментации эритроцитов
зависит от распространенности
микроангиопатии и скорости тока
эритроцитов через пораженные сосуды.
Последняя во многом определяется
величиной артериального давления,
которое при многих заболеваниях,
сопровождающихся иммунокомплексной
патологией и синдромом ДВС, оказывается
повышенным.
Клиника.
Течение МАГА во многом зависит от
основного заболевания.
При гемолитико-уремическом синдроме,
наблюдающемся в основном у детей после
инфекционных заболеваний и вакцинаций,
симптомы гемолитической анемии (слабость,
повышенная утомляемость, бледность и
желтушность кожных покровов) сочетаются
с признаками быстро нарастающей почечной
недостаточности (отсутствие аппетита,
рвота, боли в поясничной области, олигурия
и анурия).
При тромботической тромбоцитопенической
пурпуре, которая чаще встречается в
возрасте 30-40 лет и характеризуется более
распространенными сосудистыми
поражениями, в клинической картине
преобладает геморрагический синдром,
являющийся следствием глубокой
тромбоцитопении, и неврологические
нарушения: потеря сознания, делирий,
афазия, атаксия и др.
При острой дефибринации, развивающейся
при сепсисе, преждевременной отслойке
плаценты, эмболии околоплодными водами
и некоторой другой акушерской патологии,
в клинике доминируют профузные
кровотечения, обусловленные полной
потерей способности крови к свертыванию.
Поскольку гемолиз при МАГА, сопровождающей
эти состояния происходит в основном
внутрисосудистого, селезенка и печень,
как правило, не увеличены.
Лабораторные данные.
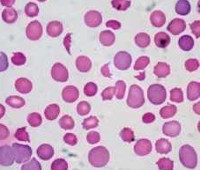
Выраженность анемии при МАГА зависит
от распространенности сосудистых
поражений. При просмотре мазка крови
обращает на себя внимание присутствие
большого количества фрагментов
эритроцитов (шистоцитоз). Отмечается
также микросфероцитоз, наличие
нормобластов, полихромазия и умеренный
ретикулоцитоз. Число лейкоцитов увеличено
за счет нейтрофилов. В большинстве
случаев наблюдается тромбоцитопения
вследствие потребления кровяных
пластинок в процессе ДВС.
Наиболее выраженная тромбоцитопения
наблюдается при тромботической
тромбоцитопенической пурпуре и острой
дефибринации.
Проба Кумбса отрицательная, продолжительность
жизни эритроцитов укорочена.
В костном мозге – эритроидная гиперплазия
и некоторое увеличение числа мегакариоцитов
за счет молодых форм.
Увеличение уровня свободного гемоглобина
сыворотки, низкая концентрация
гаптоглобина и умеренная гипербилирубинемия
свидетельствуют о внутрисосудистом
характере гемолиза.
При развитии почечной недостаточности
в плазме повышается содержание остаточного
азота, азота, мочевины и креатинина. При
острой дефибринации наблюдается
удлинение протромбинового и тромбинового
времени, снижение концентрации факторов
V,VIII,
фибриногена и повышение содержания
продуктов деградации фибрина (ПДФ).
При хроническом ДВС, который наблюдается
при гемолитико-уремическом синдроме и
тромботической тромбоцитопенической
пурпуре, концентрация в крови свертывающих
факторов, включая фибриноген, может
быть нормальной или даже повышенной.
Однако, содержание ПДФ, как правило,
увеличено, а уровень антитромбина IIIснижен.
Диагностика.
В диагностике МАГА ведущее значение
имеет обнаружение шистоцитоза в мазках
крови и признаков ДВС: прогрессирующей
тромбоцитопении, фибриногенопении,
повышенного содержания ПДФ, наличия
активированных факторов X,XIIи снижения уровня
антитромбинаIII.
Лечение.
Лечение МАГА включает:
Терапию основного заболевания, вызвавшего
развитие ДВС,Терапию ДВС с помощью гепарина в дозе
25-30 ед/кг/ч, переливаний плазмы (источник
антитромбина III), альбумина,
реополиглюкина и введения
антифибринолитических препаратов
(контрикал, трасилол и др.),Обменные переливания крови и плазмаферез,
При значительной анемизации –
заместительные гемотрансфузии.
Прогноз.
Прогноз при МАГА целиком зависит от
основного заболевания. Так, если при
гемолитико-уремическом синдроме погибают
5% больных, то при тромботической
тромбоцитопенической пурпуре смертность
в первые три месяца достигает 80%, а менее
10% больных живут более одного года.
ПРИЛОЖЕНИЕ I.
Нормальные гематологические показатели
здорового человека.
Показатель | Пол | Пределы нормальных | Единицы измерения |
Гемоглобин (Hb) | Мужчины | 133-177 | г/л |
Женщины | 117-157 | ||
Эритроциты (RBC) | Мужчины | 4,6-6,5 | х1012/л |
Женщины | 3,8-5,8 | ||
Гематокрит (HCT) | Мужчины | 0,4-0,54 | % |
Женщины | 0,37-0,49 | ||
Средний объем | 80-100 | фл* | |
Среднее содержание | 27-32 | пг* | |
Средняя концентрация | 310-370 | г/л | |
Ретикулоциты | 2-10 | ‰ | |
Лейкоциты (WBC) | 4,0-8,0 | х109/л | |
| 1-6 | % | |
0,04-0,3 | х109/л | ||
| 45-70 | % | |
2,0-5,5 | х109/л | ||
| 20-45 | % | |
1,5-4,0 | х109/л | ||
| 2-9 | % | |
0,08-0,60 | х109/л | ||
| 1-6 | % | |
0,04-0,4 | х109/л | ||
| <1 | % | |
<0,1 | х109/л | ||
Тромбоциты (PLT) | 150-400 | х109/л | |
Сывороточное железо | мужчины | 9-28 | ммоль/л |
женщины | 7-26 | ||
Общая железосвязывающая | 45-70 | мкмоль/л | |
Ферритин сыворотки | мужчины | ||
женщины | |||
Шиллинг-тест | >10% дозы, выделенной | ||
Фолаты сыворотки | 2,5-20,0 | мкг/л | |
Фолаты эритроцитов | 160,0-640,0 | мкг/л | |
Скорость оседания | < 10 мм в течение | мм/ч | |
Масса циркулирующих | мужчины | 25-35 | мл/кг |
женщины | 20-30 | мл/кг | |
Объем плазмы | 40-50 | мл/кг | |
Период полураспада | 25-30 дней | ||
Гемоглобин А2 | 1,5-3,2 | % общего Hb | |
Гемоглобин F | 0,5-0,8 | % общего Hb | |
*Примечание: пг – пикограмм (10-12г) фл – фентолитр | |||
Оглавление.
Глава |
Эритропоэз. |
Гемоглобин. |
Железо, |
Иммунология |
Морфофизиология |
Глава |
Глава |
Апластические |
Миелодиспластический |
Хроническая |
Мегалобластные |
Глава |
Мембранопатии. |
Наследственные мембранопатии. |
Пароксизмальная ночная гемоглобинурия |
Энзимопатии. |
Гемолитическая анемия вследствие |
Гемоглобинопатии. |
Качественные (структурные) |
Серповидно-клеточная анемия |
Гемоглобинопатия С |
Гемоглобинопатия SC |
Гемоглобинопатия D |
Гемоглобинопатия E |
Количественные гемоглобинопатии. |
β-талассемии. |
α-талассемии. |
H-гемоглобинопатия. |
Аутоиммунные |
АИГА с неполными тепловыми агглютининами. |
АИГА с полными холодовыми агглютининами. |
АИГА с двухфазными гемолизинами |
Глава |
Приложение. |
в соответствующих главах учебного
пособия приводятся подробные классификации
анемий этих типов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Гемолитические анемии у детей – это группа разных по патогенезу заболеваний, главным признаком которых является уменьшение продолжительности жизни эритроцитов, развитие их гемолиза. Клиническая картина имеет общие симптомы: возникновение желтухи, спленомегалии, реже гепатомегалии, тёмное окрашивание мочи. Для лабораторных исследований характерно снижение гемоглобина, ретикулоцитоз, повышение уровня билирубина (в основном за счет непрямой фракции), повышение ЛДГ, уробилиногена мочи. Метод лечения зависит от этиологии анемии: возможна медикаментозная терапия, проведение гемотрансфузий, спленэктомия при гиперспленизме.
Общие сведения
Гемолитические анемии – это эритроцитопатии, при которых имеет место стойкое или массированное преобладание разрушения эритроцитов над их образованием. Среди всех анемий у детей встречаются в 11,5% случаев, в 5,3% ‒ от общего числа заболеваний крови. В числе больных незначительно преобладают лица мужского пола. Чаще диагностируются наследственные формы (76,6%) и особенно – наследственная сфероцитарная гемолитическая анемия (56,4%). Некоторые формы связывают с этнической принадлежностью: талассемия характерна для азиатов, жителей Кавказский республик, побережья Средиземного моря; серповидноклеточная анемия – для лиц негроидной расы, дефицит Г-6-ФД – для представителей еврейской национальности. Гемолитическая болезнь плода на территории РФ встречается у 0,6% новорожденных.

Гемолитическая анемия у детей
Причины
Этиология у наследственных и приобретенных гемолитических анемий различна. При наследственных анемиях патологии в строении эритроцитов запрограммированы на генетическом уровне: известно 16 вариантов с аутосомно-доминантным типом наследования, 29 – с рецессивным, 7 разновидностей – с Х-сцепленным. Все причины, которые приводят к гемолизу, разделяются на внеклеточные и внутриклеточные.
Внеклеточные причины типичны для анемий приобретенного характера. В этом случае эритроциты дефектов не имеют, а разрушаются под воздействием внешних факторов: ретикулоэндотелиальной гиперактивности (гиперспленизм), механических и химических нарушений целостности эритроцитов, иммунологических отклонений (под воздействием антител), паразитарной инвазии, витаминодефицита, некоторых инфекций. Внутриклеточные причины гемолиза – это нарушение структуры и функций эритроцитов, такие как дефекты эритроцитарного метаболизма, строения гемоглобина, мембран клеток.
Патогенез
В патогенезе наследственных гемолитические анемии главную роль играет внесосудистый гемолиз – разрушение эритроцитов происходит в клетках ретикулоэндотелиальной системы. Высвобождаемый гем распадается до несвязанного билирубина. В печени такое количество билирубина не может полностью связаться с глюкуроновой кислотой, развивается гипербилирубинемия. Клинически проявляется нарастанием желтухи, формированием у детей в раннем возрасте камней желчного пузыря, содержащих билирубинат кальция. В кишечнике билирубин метаболизируется в уробилин, избыток которого окрашивает мочу в темный цвет. Гиперактивность селезенки приводит к увеличению ее размеров с развитием гиперспленизма.
Внутрисосудистый гемолиз возникает при приобретенных гемолитических анемиях. Происходит распад эритроцитов в кровотоке, высвободившееся количество гемоглобина не связывается полностью с гаптоглобином в плазме, вследствие чего развивается гемоглобинурия. Избыток гемосидерина, который образуется в селезенке, почках, печени, способствует развитию гемосидероза данных органов и нарушению их функции. Компенсаторное усиление эритропоэза вызывает ретикулоцитоз. Гиперплазия костного мозга ведет к деформации черепа и скелета у детей.
Классификация
Общепринятая классификация гемолитических анемии у детей предложена Идельсоном Л.И. в 1975 году. Согласно ей выделяются две основные группы: наследственные и приобретенные, в каждой из которых обозначаются этиопатогенетические формы. Наследственные анемии классифицируются по локализации генетической аномалии, которая приводит к неполноценности эритроцитов. К ним относятся:
- Мембранопатии. Гемолитические анемии связаны с дефектами белковых и липидных комплексов мембран эритроцитов: врожденная эритропоэтическая порфирия, наследственные эллиптоцитоз и сфероцитоз – болезнь Минковского-Шоффара.
- Ферментопатии. Гемолиз обусловлен дефицитом эритроцитарных ферментов, которые обеспечивают пентозо-фосфатный цикл, гликолиз, синтез АТФ и порфиринов, обмен нуклеотидов и глютатиона.
- Гемоглобинопатии. Патологические состояния, вызванные структурными нарушениями гемоглобина и изменением синтеза его цепей: талассемия, серповидноклеточная анемия, эритропорфирия.
Приобретенные гемолитические анемии связаны с влиянием различных факторов, которые способствуют гемолизу в сосудистом русле и в органах ретикулоэндотелиальной системы. Среди них выделяют:
- Иммунные формы. Причиной гибели эритроцитов является выработка к ним антител. При изоиммунном варианте в организм проникают антиэритроцитарные антитела (гемолитическая болезнь новорожденных) или попадают красные кровяные клетки, к которым у больного есть сенсибилизация (посттрансфузионные анемии). Для гетероиммунных форм характерна фиксация на эритроцитах медикаментозных препаратов (пенициллины, сульфаниламиды, хинидин) или вирусов, что делает их антигеном. Аутоиммунные анемии вызваны образованием антител к собственным нормальным эритроцитам при онкологических заболеваниях, лимфолейкозе, миеломной болезни, системной красной волчанке, а также выработкой тепловых и холодовых антител.
- Механические формы. Гемолиз вызван механическим разрушением эритроцитов. Прямое повреждение возможно искусственными сердечными клапанами, паразитарной инвазией (малярийный плазмодий, токсоплазма), бактериальными токсинами (β-гемолитический стрептококк, менингококк), ядами змей, насекомых. При маршевой гемоглобинурии и анемии спортсменов после длительной интенсивной нагрузки гемолиз происходит в капиллярах нижних конечностей. Гиперспленизм является причиной разрушения нормальных эритроцитов в селезенке.
Симптомы
Клиническая картина, развивающаяся при разных типах гемолиза, имеет общие черты. Для приобретенных гемолитических анемий характерно острое нарастание симптоматики. Большинство наследственных анемий протекает хронически с периодическими гемолитическими кризами. Для развития криза необходимо воздействие триггера: переохлаждения, употребления токсичных препаратов, инфекционного заболевания. Первыми симптомами являются общая слабость, лихорадка, диспепсические расстройства, головная боль. В дальнейшем нарастают признаки билирубиновой интоксикации: иктеричность слизистых оболочек и желтушность кожи; появляются тяжесть, дискомфорт в верхних отделах живота из-за гепато- и спленомегалии, потемнение мочи – от розового до почти черного цвета. На фоне анемизации нарастает бледность с восковидным оттенком, появляются ощущения сердцебиения и перебоев в работе сердца. В тяжелых случаях развивается олигурия (уменьшение количества выделяемой мочи) и анурия, вплоть до шока.
Для наследственных форм характерно выявление стигм дизэмбриогенеза: челюстных и зубных деформаций, гиперхромии радужки, «башенного» черепа, западения переносицы, «готического» нёба; в анамнезе есть указания на гемолитические состояния у родственников, отягощена наследственность по желчнокаменной болезни. Клиническая картина изоиммунных анемий при конфликте «мать-плод» зависит от причины конфликта (резус-фактор, группа крови и другие). Высокий титр антител и их непосредственное влияние на плод на 20-29 неделе гестации приводят к водянке плода, попадание к плоду антител антенатально (после 29 недели) или в момент родов – к развитию гемолитической болезни.
Осложнения
При разных гемолитических анемиях возможны типичные только для них осложнения. Новорожденные с тяжелой гипербилирубинемией, вызванной наследственными формами, угрожаемы по развитию ядерной желтухи. К трем-четырем годам есть риск возникновения холестаза, хронического гепатита, цирроза печени. Большое количество гемотрансфузий у лиц с тяжелым течением способствует гемосидерозу селезенки, костного мозга, печени. Инфицирование парвовирусом В19 больных талассемией, серповидно-клеточной анемией ведет к фатальным последствиям – развитию арегенераторного криза. Для всех гемолитических состояний грозными осложнениями являются диссеминированное внутрисосудистое свертывание, острая сердечная и почечная недостаточность, анемическая кома.
Диагностика
Диагностика гемолитических анемий в педиатрии имеет некоторые особенности. После 12 месяцев в крови ребенка исчезают черты, характерные для неонатального типа кроветворения: макроцитоз, фетальный гемоглобин, пониженная минимальная осмотическая стойкость эритроцитов, нестабильность уровня ретикулоцитов. Поэтому точное типирование гемолитической анемии возможно только после этого возраста. В диагностике принимают участие педиатр и детский гематолог. В план обследования должны быть включены:
- Сбор анамнеза и общий осмотр. Выясняется этническая принадлежность, наличие у родственников гемолитических анемий, желчнокаменной болезни, история беременности и родов матери, группа крови, резус-фактор родителей. Педиатр осматривает ребенка на предмет выявления желтухи, типичной бледности, стигм дизэмбриогенеза; проводит пальпацию живота для выявления гепато-, спленомегалии, аускультацию сердца с целью выслушивания систолического шума на верхушке сердца, учащения сердцебиения.
- Клинические анализы. Общий анализ крови проводится с определением морфологии эритроцитов, лейкоцитов и тромбоцитов. При исследовании выявляются снижение гемоглобина, атипичные формы эритроцитов (при мембранопатиях и гемоглобинопатиях), наличие ретикулоцитов (как признака напряжения эритропоэза), тельца Гейнца-Эрлиха (при дефиците Г6ФД), повышение СОЭ. В общем анализе мочи отмечается повышение уробилина, гемоглобинурия.
- Биохимия крови. Для биохимического анализа типичны гипербилирубинемия, повышение ЛДГ, при внутрисосудистом гемолизе – гипергемоглобинемия, гипогаптоглобинемия. Прямая проба Кумбса (прямой антиглобулиновый тест) положительна при наличии аутоантител к поверхности эритроцитов, характерных для иммунных гемолитических анемий. Но при массивном гемолизе, а также при холодовых и гемолизиновых формах АИГА, вызванных IgА или IgM- аутоантителами, проба может быть отрицательной.
- Инструментальные методы. УЗИ либо КТ органов брюшной полости с высокой точностью определяют увеличения размер печени, селезенки, их структуру, состояние желчевыводящей системы. Трепанобиопсия костного мозга проводится с целью определения типа эритропоэза (нормо-, мегало- или сидеробластный), а также исключения патологии со стороны костного мозга (апластическая анемия, лейкоз, метастатическое поражение при злокачественных образованиях).
Специфические методы исследования. Определение длительности жизни эритроцитов может проводиться методами дифференциальной агглютинации, продукции угарного газа, проточной цитометрией (клеточное биотинилирование и др.), прямыми радиоизотопическими исследованиями. Генетические исследования и определение мутаций уточняют причины наследственного гемолиза.
Лечение
Лечение гемолитической анемии проводится в стационарных условиях, под наблюдением педиатра, гематолога, при переливаниях крови – трансфузиолога. Лечебный подход зависит от тяжести состояния пациента, периода заболевания (гемолитический криз или ремиссия), причины возникновения гемолиза. Методы терапии можно объединить в следующие группы:
- Медикаментозная терапия. Назначается как этиотропно, так и симптоматически. При увеличении селезенки и гепатомегалии применяют глюкокортикоидные гормоны. Аутоиммунные анемии требуют назначения цитостатиков, эритропоэтина. При дефиците фолатов назначают цианокобаламин и фолиевую кислоту. Гемолитический криз требует инфузионной терапии, снятия симптомов интоксикации. Для выведения избытка железа больным проводятся курсы хелаторной терапии (десферал). Во многих случаях с профилактической целью используются желчегонные средства.
- Гемотрансфузии. Переливание компонентов крови проводят в стационарных условиях при выраженной анемии по жизненным показаниям. Трансфузия эритроцитарной массы осуществляется строго по индивидуальному подбору, предпочтительно использовать отмытые и размороженные эритроциты. Длительная гемотрансфузионная терапия может осложниться избыточным отложением железа в тканях.
- Хирургическое лечение. Спленэктомия – хирургическое удаление селезенки – используется при спленомегалии, если лекарственная терапия не имеет эффекта. Метод особенно эффективен при гиперспленизме, когда секвестрация эритроцитов происходит в селезенке. При гемолитических анемиях часто развивается холелитиаз, который требует оперативного удаления желчного пузыря (холецистэктомии) или экстракции конкремента из желчных путей.
Прогноз и профилактика
Прогноз при гемолитических анемиях у детей зависит от этиологического фактора. Приобретенные формы и большинство наследственных имеют благоприятный исход при своевременно начатом лечении и соблюдении мер профилактики. В качестве системы питания используется диета №5 по Певзнеру, предназначенная для снижения нагрузки на билиарный тракт. Необходим охранительный режим: избегание перегрева и переохлаждений; исключение контактов с инфекционными больными; ознакомление со списком препаратов и веществ, которые могут вызвать гемолиз (хинин, сульфаниламиды, левомицетин, аспирин, нитрофураны и прочие); определение показаний и строгих противопоказаний к вакцинации (при дефиците глюкозо-6фосватдегидрогеназы, аутоиммунных анемиях иммунизация запрещена, при сфероцитозе – рекомендована).