Микросфероцитарная анемия клинические рекомендации
Наследственный микросфероцитоз – это гемолитическая анемия, обусловленная генетическим дефектом мембран эритроцитов и характеризующаяся постоянным гемолизом. Клинические признаки включают бледность, желтушность кожи, слизистых, боли в левой части живота за счет увеличения селезенки, а также деформацию скелета. В раннем возрасте развивается желчнокаменная болезнь. Диагностика осуществляется с помощью общего анализа крови, определения осмотической резистентности эритроцитов. Иногда требуется проведение электрофореза мембранных белков. Основным лечением является удаление селезенки (спленэктомия).
Общие сведения
Наследственный микросфероцитоз (НМС, болезнь Минковского-Шоффара) – врожденное гематологическое заболевание из группы мембранопатий. Впервые болезнь подробно была описана немецким терапевтом Оскаром Минковским в 1900 г., спустя 7 лет французский терапевт Анатоль Шоффар установил снижение осмотической резистентности красных кровяных телец при НМС. Распространенность данной патологии в среднем составляет 1: 2500 человек, несколько чаще она встречается в Японии, странах Африки, Северной Европы. Клиническая манифестация может произойти в любом возрасте, но чаще наступает в юношеском или зрелом возрасте. Больше страдают лица мужского пола.

Наследственный микросфероцитоз
Причины
В основе наследственного микросфероцитоза лежит мутация гена, кодирующего синтез одного из белков цитоскелета мембраны эритроцитов. В разных семьях обнаруживаются мутации различных генов. Ген альфа-цепи спектрина расположен на 1 хромосоме (локус Iq21), ген бета-цепи – на 14 хромосоме (локус q22-q23), а ген анкирина – на 8 хромосоме (локус 8p 11.2). Болезнь характеризуется аутосомно-доминантным типом наследования.
К предрасполагающим факторам можно отнести наличие среди близких родственников больного наследственным микросфероцитозом или бессимптомного носителя мутантных генов. Спровоцировать резкое обострение (гемолитический криз) или первое проявление НМС у лиц с легкой формой могут инфекционные патологии, вакцинация, сильный стресс. У женщин обострения нередко возникают при наступлении беременности.
Патогенез
В результате подавления выработки мембранного протеина повышается проницаемость клеточной стенки эритроцитов для ионов натрия, что приводит к набуханию, накоплению в них воды. Красные кровяные тельца меняют свою форму с двояковогнутой на сферическую, уменьшаются в размерах. Продолжительность их жизни сокращается до 8-10 дней (в норме от 90 до 120). Из-за потери эластичности и неспособности деформироваться микросфероциты значительно подвержены внутриклеточному гемолизу. Они не могут пройти через суженные участки синусоидов селезенки и подвергаются разрушению макрофагами.
Вследствие постоянной деструкции красных клеток компенсаторно усиливаются процессы костномозгового кроветворения. Из-за хронического гемолиза высвобождается большое количество неконъюгированного билирубина, который направляется в печень для секреции в желчь. Поэтому желчный пузырь начинает заполняться пигментными камнями. При патологоанатомическом исследовании обнаруживают гиперплазию эритроидного ростка костного мозга трубчатых, плоских костей. Кровенаполнение пульпы резко выражено. Также нередко отмечается гемосидероз внутренних органов.
Классификация
Яркость клинической картины зависит от того, дефицит какого белка наблюдается у пациента, и является он гетерозиготным или гомозиготным носителем мутантных генов. По этим критериям различают следующие степени тяжести наследственного микросфероцитоза:
- Легкая. Небольшой гемолиз, развивающийся у взрослых людей под влиянием провоцирующих факторов. Селезенка увеличена незначительно. Уровень гемоглобина 100-120 г/л.
- Средняя. Умеренный гемолиз и спленомегалия. Кожа желтушной окраски. Уровень гемоглобина 80-100 г/л.
- Тяжелая. Редкая форма. Выраженный гемолиз, большие размеры селезенки, скелет деформирован. Характерно кризовое течение с большим количеством осложнений и вероятностью летального исхода. Уровень гемоглобина 60-80 г/л. Имеется потребность в постоянных гемотрансфузиях.
- Бессимптомная (латентная). При этой разновидности человек даже не подозревает, что болен. Данная форма характерна для гетерозиготных лиц. Единственным признаком может быть наличие небольшого количества микросфероцитов, высокий ретикулоцитоз. Истинная частота распространенности неизвестна.
Симптомы наследственного микросфероцитоза
Начало заболевания обычно постепенное. При латентной и легкой форме усиленное костномозговое кроветворение компенсирует постоянное разрушение эритроцитов, что позволяет поддерживать уровень гемоглобина на должном уровне. Тяжесть клинической картины определяется степенью гемолиза. На первый план обычно выступает желтушность кожных покровов, склер, слизистой оболочки рта с лимонно-шафрановым оттенком. Долгое время желтуха может быть единственным признаком наследственного микросфероцитоза.
Анемичный синдром проявляется бледностью кожи, слизистых, симптомами пониженного артериального давления (слабостью, головокружением, тахикардией). Практически всегда увеличена селезенка, из-за чего больной испытывает тянущую или ноющую боль в левом подреберье. Желтуха, спленомегалия, анемия составляют гемолитическую триаду. Нередко увеличена печень, но не так сильно, как селезенка, поэтому тяжесть и боль в правом подреберье незначительны.
Если заболевание манифестирует с раннего детского возраста, то развивается деформация костного скелета (стигмы дизэмбриогенеза) – башенный череп, укорочение мизинцев, широкая переносица и т. д. У взрослых больных с тяжелой формой НМС, которым не была проведена спленэктомия, иногда наблюдаются трофические язвы нижних конечностей (область голени, лодыжек), что обусловлено ухудшением микроциркуляции.
Особо яркую клинику имеет гемолитический криз, возникающий под влиянием различных провоцирующих факторов. Вследствие массивного гемолиза у больного повышается температура тела, нарастает интенсивность желтухи. Присоединяются симптомы билирубиновой интоксикации (потеря аппетита, рвота, боли в мышцах, суставах). Из-за резкого увеличения селезенки боли усиливаются, приобретают распирающий характер. Уровень гемоглобина падает до критических значений, пациент может потерять сознание.

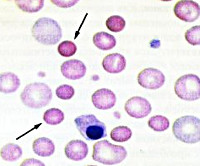
Увеличенная селезенка у 9-летнего ребенка с наследственным микросфероцитозом
Осложнения
Наиболее частыми осложнениями (50%) считаются желчнокаменная болезнь и калькулезный холецистит, возникающие по причине высвобождения из разрушенных эритроцитов большого количества билирубина, секретирующегося в желчь. Длительные переливания крови могут привести к перегрузке железом, вторичному гемохроматозу (цирроз печени, кардиомиопатия, сахарный диабет 2 типа). Трофические язвы ног в редких случаях способствуют развитию бактериальных воспалительных процессов в подкожной, межмышечной клетчатке (флегмона, некротизирующий фасциит).
Самое опасное состояние, которое возникает при наследственном микросфероцитозе, – апластический криз, вызванный инфицированием парвовирусом В19. В костном мозге прекращаются процессы кроветворения, резко снижается содержание в крови всех форменных элементов (эритроцитов, лейкоцитов, тромбоцитов). Появляются кровотечения, глубокая анемия, высокая чувствительность к инфекционным агентам.
Диагностика
Пациенты с болезнью Минковского-Шоффара подлежат обследованию у врача-гематолога. При осмотре пациента учитывается степень выраженности гемолитической триады, наличие деформации лицевого скелета. Уточняется, есть ли данное заболевание у кого-либо из близких родственников. С целью подтверждения диагноза назначается дополнительное обследование, которое включает:
- Анализы крови. В общем анализе крови обнаруживаются снижение уровня эритроцитов, гемоглобина, увеличение ретикулоцитов (до 20%). Размер эритроцитов уменьшен (меньше 7 мкм). При морфологической оценке мазка крови выявляются микросфероциты. Биохимический анализ крови показывает признаки гемолиза – высокую концентрацию непрямого билирубина, лактатдегидрогеназы.
- Верифицирующие тесты. Выявляется уменьшение осмотической устойчивости эритроцитов в виде повышенной чувствительности к лизису в гипотонических растворах NaCl (0,4-0,6%). Также характерна слабая способность красных клеток крови к фиксации флуоресцентного красителя эозин-5-малеимида при ЭМА-тесте. Электрофорез мембранных белков эритроцитов позволяет точно определить дефицит конкретного протеина (спектрин, анкирин).
- Инструментальные исследования. При УЗИ органов брюшной полости у пациента с любой формой наследственного микросфероцитоза обнаруживается увеличение селезенки, а иногда и печени. Часто находят камни в желчном пузыре. На рентгенографии костей черепа, трубчатых костей видны признаки разрастания костного мозга – расширение костномозгового канала, участки остеопороза, истончение кортикального слоя.
Спектр исключаемых патологий при болезни Минковского-Шоффара довольно широк. Наиболее часто приходится дифференцировать НМС от аутоиммунных гемолитических анемий. С этой целью для исключения иммунной природы гемолиза проводят антиглобулиновый тест (реакцию Кумбса). При НМС результат отрицательный. Легкие формы, сопровождающиеся лишь желтухой и небольшой спленомегалией, нужно отличать от доброкачественных гипербилирубинемий (синдрома Жильбера). Перегрузку железом дифференцируют с первичным (наследственным) гемохроматозом.

Наследственный микросфероцитоз
Лечение наследственного микросфероцитоза
Пациенты с легкой и бессимптомной формой не нуждаются в лечении. Им необходимо лишь регулярно посещать врача, сдавать клинический анализ крови. Больные средне-тяжелым и тяжелым НМС должны проходить лечение в отделении гематологии. Развитие гемолитического, апластического кризов из-за большого риска летального исхода являются показанием для перевода в отделение реанимации и интенсивной терапии.
Консервативная терапия
При уровне гемоглобина ниже 70 г/л производится переливание эритроцитарной массы, взвеси или отмытых эритроцитов. При гемоглобине меньше 50 г/л прибегают к переливанию цельной крови. Гемотрансфузию стоит выполнять медленно во избежание гемолитических реакций. При длительных гемотрансфузиях с целью выведения избытка железа обязательно используется хелатирующая терапия – дефероксамин, аскорбиновая кислота.
Для поддержания ремиссии (предотвращения кризов) больным тяжелым и средне-тяжелым НМС назначается постоянный прием профилактической дозы фолиевой кислоты. При апластическом кризе требуется дополнительное введение тромботического концентрата, стимуляторов лейкопоэза (филграстим), антибиотиков широкого спектра действия (цефтриаксон). Трофические язвы обрабатываются антисептическими растворами (фурацилин), мазями, содержащими антибиотики.
Хирургическое лечение
Основной радикальный вид лечения, обеспечивающий выздоровление больного, – тотальная спленэктомия (полное удаление селезенки). Она показана пациентам с частыми гемолитическими кризами, глубокой анемией, выраженной гипербилирубинемией и спленомегалией. Оптимальный возраст для операции – 6 лет. Предпочтение отдается лапароскопическому вмешательству как менее травматичному. Субтотальная резекция и эмболизация селезеночной артерии не рекомендуются, так как ассоциированы с высокой частотой рецидивов. При желчнокаменной болезни показана холецистэктомия.
Профилактика и прогноз
В целом наследственный микросфероцитоз является доброкачественным заболеванием. Подавляющее число пациентов имеет легкую или бессимптомную форму с незначительной спленомегалией и компенсированным гемолизом. Летальные исходы крайне редки (1-2%) и связаны с кризами (гемолитическими и апластическими). После спленэктомии продолжительность жизни не отличается от таковой у общей популяции. Первичная профилактика не разработана.
Отсутствие селезенки увеличивает риск инфицирования инкапсулированными микроорганизмами. Поэтому перед операцией (за 2-3 недели) обязательно проведение вакцинации против пневмококка, менингококка и гемофильной палочки. Дети до 6 лет должны получать профилактические дозы пенициллиновых антибиотиков (амоксициллин). Также с целью предотвращения постспленэктомического тромбоза назначаются антикоагулянты (низкомолекулярные гепарины).
Источник
Год утверждения 2015
Профессиональные ассоциации:
НОДГО
Оглавление
1. Краткая информация
2. Диагностика
3. Лечение
4. Реабилитация
5. Профилактика
6. Дополнительная информация
1. Краткая информация
1.1 Определение
Анемия хронических болезней (АХБ) или анемия воспаления – вторая по распространенности, наблюдается у пациентов с активацией иммунной системы вследствие различных заболеваний.
1.2 Этиология и патогенез
Мультифакторный патогенез АХБ:
- образование белка гепцидина, блокирующего всасывание железа в кишечнике и реутилизацию железа из депо, что способствует железодефицитному эритропоэзу;
- неадекватно низкая выработка эритропоэтина (ЭПО) из-за избыточной продукции провоспалительных цитокинов;
- угнетение провоспалительными цитокинами костномозгового кроветворения;
- снижение продолжительности жизни эритроцитов.
1.3 Эпидемиология
АХБ возможна при хронических и острых воспалительных заболеваниях.
Снижение уровня гемоглобина (Hb) выявляется менее чем через 2 недели от начала болезни: умеренная, микроцитарная анемия с Hb 90-130 г/л и гематокритом 30-40%, у 20% больных гематокрит – до 25%.
При хроническом течении анемия гипохромная, при острой инфекции – часто нормохромная.
Ассоциируемые с АХБ заболевания (частота):
- Все инфекции 18 – 95%
- ЗНО, гемобластозы 30 – 77%
- Аутоиммунные реакции, системные заболевания, ревматоидный артрит, саркоидоз, заболевания кишечника 8 – 71%
- Хроническая реакция трансплантат против хозяина 8 – 70%
- Хронические заболевания почек 23 – 50%
1.4 Кодирование по МКБ-10
D63.8 – Анемия при хронических болезнях, классифицированных в других рубриках
1.5 Классификация
По степени тяжести анемии:
- Легкая – Hb выше 90 г/л;
- Средняя – Hb 90-70 г/л;
- Тяжелая – Hb менее 70 г/л.
2. Диагностика
2.1 Жалобы и анамнез
АХБ высоко вероятна, если анемия развилась на фоне острых или хронических заболеваний инфекционно-воспалительного характера.
Следует предположить АХБ, если рутинная 4-недельная пероральная ферротерапия не привела к повышению Нb>10 г/л.
Другие причины анемии:
- кровотечения (острые и хронические);
- интеркуррентные заболевания (инфекционно-воспалительные, глистные инвазии, аутоиммунные, болезни почек);
- дефицит железа, фолатов, витамина В12 (алиментарный фактор, нарушенная абсорбция).
Симптомы анемии:
- сердцебиение;
- одышка, усиливающаяся при физической нагрузке;
- головокружение, шум в ушах;
- слабость, повышенная утомляемость.
2.2 Физикальное обследование
Визуальные признаки анемии:
- бледность кожи и слизистых (желтушность кожи и слизистых при гемолизе);
- тахикардия, тахипноэ;
- приглушенность сердечных тонов, систолический шум на верхушке и над крупными сосудами;
- вялость.
На неспецифические признаки анемии накладываются симптомы основного заболевания и побочные эффекты терапии.
2.3 Лабораторная диагностика
В клинике часто проводится дифференциальный диагноз между ЖДА, АХБ и ЖДА+АХБ.
Предварительный диагноз – анализ эритроцитарных индексов (ЭИ) при исследовании на автоматическом анализаторе.
Для АХБ характерны:
- нормальные значения основных ЭИ,
- MCV может быть пониженным.
Для ЖДА характерны:
- пониженный MCV,
- пониженный MCH,
- пониженный MCHC,
- повышенный RDW,
- HYPO>5%,
- Hb-Ret
Для диффдиагностики с ЖДА – определение биохимических показателей обмена железа с расчетом коэффициента насыщения трансферрина железом (НТЖ) и концентрации сывороточного ферритина (СФ) – «золотого стандарта».
Независимо от возраста СФ
При ЖДА уровень СФ обычно меньше 12 мкг/л, но выше чувствительность и специфичность критерия дефицита железа (ДЖ) СФ
При повышении СРБ дефицит железа верифицируется при СФ
При АХБ уровень СФ нормальный или повышенный.
При ЖДА+АХБ, как правило, СФ нормальный или повышен, для выявления ДЖ используют коэффициент НТЖ.
У пациентов с АХБ в сочетании с дефицитом железа НТЖ меньше возрастного уровня:
НТЖ % = [железо сыворотки (ЖС)/ общая железосвязывающая способность сыворотки (ОЖСС)] × 100%
- 1–2 года – <9%;
- 3–5 лет – <13%;
- 6–15 лет – <14%;
- старше 15 лет- <16%.
Особенности АХБ:
- микро- нормоцитарные,
- нормохромные,
- нормо- или гипорегенераторные.
Дифференциальная диагностика АХБ с другими анемиями:
- ЖДА,
- талассемии,
- сидеробластная анемия,
- анемия при отравлении свинцом.
Не используются в рутинной практике высоко специфичные при АХБ:
- уровень сывороточного трансферринового рецептора – 1 (сТФР-1) – нормальный;
- концентрация гепцидина – высокая.
Уровень с-ЭПО – индикатор неадекватно низкой продукции ЭПО и предиктор эффективного ответа на рчЭПО-терапию.
Костномозговая пункция не требуется из-за достаточной информативности морфологических и биохимических показателей, за исключением подозрения на сидеробластную анемию.
Наследственные формы анемии вероятны:
- при хронической и резистентной к ферротерапии анемии,
- стойком снижении трансферрина, ОЖСС и β-глобулиновой фракции при атрансферринемии,
- повышение уровня гепцидина при отсутствии других маркеров воспаления при железорефрактерной ЖДА.
3. Лечение
3.1 Консервативное лечение
Наиболее эффективна комбинация ЭСП и внутривенных препаратов железа.
Адекватное лечение основного заболевания – наиболее эффективный способ лечения АХБ.
Лечение АХБ необходимо при всех хронических, трудно поддающихся терапии заболеваниях, поскольку анемия негативно влияет на качество жизни, ухудшает прогноз и исходы.
Повышение гепцидина снижает всасывание железа в кишечнике, поэтому пероральные препараты железа малоэффективны.
Частичный эффект от пероральной ферротерапии возможен при АХБ, развившейся на фоне ДЖ.
Монотерапия внутривенным железом показана только при доказанном дефиците железа с НТЖ<20% или СФ
Высокая резистентность к монотерапии обусловлена характерной для АХБ неадекватно низкой продукцией ЭПО.
Использование пероральных препаратов железа вместо внутривенной ферротерапии допустимо, но может снижать ответ на рчЭПО терапию.
Протокол применения рекомбинантного человеческого эритропоэтина для лечения АХБ у детей и подростков
Показания:
- Hb менее 100 г/л
Противопоказания:
- гематокрит свыше 0.6;
- лейкоцитоз свыше 40×109/л;
- тромбоцитоз свыше 700×109/л;
- индивидуальная непереносимость препарата.
Срок лечения: до 12 недель.
Режим: 150-300 МЕ/кг 3 раза/нед подкожно или 600 МЕ/кг 1 раз/нед внутривенно.
Терапевтический режим: стартовая доза 150 МЕ/кг рчЭПО;
Дополнительно для профилактики функционального дефицита железа внутрь или внутривенно препараты железа в суточной дозе не более 5 мг/кг.
Лабораторный контроль – общий анализ крови (с тромб) перед началом терапии и каждые 7-10 дней.
Требования к результатам лечения – целевой Hb – 110 г/л, старше 12 лет – 120 г/л.
Коррекция дозы рчЭПО:
разовая доза увеличивается на 50 МЕ/кг при отсутствии полного терапевтического ответа (повышение Hb на ≥ 10 г/л от исходного) после 2 недель 150 МЕ/кг рчЭПО;
последующее увеличение дозы рчЭПО на 50 МЕ/кг каждые 2 недели до max 300 МЕ/кг при недостаточной скорости прироста – Hb
при отсутствии эффекта на 300 МЕ/кг дальнейшее повышение нецелесообразно.
Прекращение введения рчЭПО:
- чрезмерно быстрый рост Hb – еженедельно более 20 г/л;
- концентрация Hb превышает 120 г/л.
4. Реабилитация
Специфических реабилитационных мероприятий не разработано.
Мониторинг эффективности лечения индивидуален ввиду различия тяжести АХБ и ответа на лечение.
После нормализации уровня Hb необходимо динамическое наблюдение.
5. Профилактика и диспансерное наблюдение
Специфических профилактических мероприятий не разработано.
Адекватная терапия основного заболевания, направленная на купирование синдрома системного воспалительного ответа, способствует меньшему риску развития АХБ.
6. Дополнительная информация, влияющая на течение и исход заболевания
6.1 Причины и признаки декомпенсации хронической анемии
АХБ обычно легкой или средней степени тяжести.
Декомпенсация АХБ требует срочной госпитализации ребёнка из-за высокой вероятности смерти от кислородного голодания.
Причины декомпенсации АХБ:
- повышенная потребность в кислороде при инфекции, боли, лихорадке;
- снижение снабжения тканей кислородом при острой кровопотере, пневмонии;
- сопутствующий дефицит железа.
Ранние признаки декомпенсации:
- затрудненное и быстрое дыхание – респираторный дистресс;
- усиленное использование мышц живота для дыхания;
- раздувание крыльев носа.
Признаки острой декомпенсации:
- форсированный (“стонущий”) выдох (респираторный дистресс);
- изменение психического состояния;
- ослабление периферического пульса;
- застойная сердечная недостаточность;
- гепатомегалия;
- плохая периферическая перфузия (больше 2 сек).
6.2 Влияние анемии на качество жизни детей
На клиническом уровне связь между анемией и утомляемостью считается обоснованной.
Источник
