Молекула гемоглобина имеет структуру четвертичную
ТЕМА БЕЛКИ
Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
Строение аминокислоты:
В левой части молекулы расположены группаH2N–, которая обладает свойствами основания; справа – группа –COOH– кислотная, характерная для всех органических кислот. Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае – пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация. Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура). Это вторичная структура белка. Но и ее часто недостаточно для приобретения характерной биологической активности.
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу. Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка. Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин. Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты. Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы:
А – первичная;
Б – вторичная;
В – третичная;
Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
1. Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
2. Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
3. Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
Источник

Синтез гемоглобина происходит в костном мозге. Он образуется из гема и глобина. Гем – это соединение порфирина и железа, а глобин представлен двумя цепочками аминокислот: 2 альфа и 2 бета.
Один гем и глобин называются субъединицей, в гемоглобине их 4. Каждая может присоединять из воздуха и отдавать клетке кислород, а в обратном направлении переносится углекислый газ. При недостатке железа развивается железодефицитная анемия, так как железо удерживает части гема, обеспечивает соединение гема и глобина.
При нарушении образования цепей глобина развивается талассемия со склонностью к тромбозу и серповидно-клеточная анемия с поражением печени, селезенки, накоплением железа. Если есть врожденный дефект синтеза порфирина, то возникают порфирии, их типичный признак – это красная моча. Печеночная порфирия также появляется при злоупотреблении снотворными группы барбитуратов.
Синтез гемоглобина: пояснение простыми словами
Синтез гемоглобина проходит в клетках-предшественниках эритроцитов – эритробластах и ретикулоцитах костного мозга. Для его образования нужны порфирины, глобин (белок) и ионы железа. Порфирин – это аморфное (некристаллическое) вещество, при пропускании через него света появляется красное окрашивание. Источниками для его синтеза является аминокислота, глицин и коэнзим А (производное янтарной кислоты).
Из порфирина и железа образуется гем. Биохимия этого процесса включает ряд последовательных реакций с появлением порфобилиногена. Потом требуется его 4 молекулы для формирования комплекса уропорфириногена, превращающегося в протопорфирин. Именно последний и соединяется с железом. Одновременно и в том же количестве образуется белок глобин из аминокислот. При соединении гема и глобина появляется гемоглобин.
Для нормального образования гема требуется витамин В6, В12, фолиевая кислота, ионы меди и кобальта. Поэтому при однообразном питании с дефицитом мяса, овощей, ягод и круп уменьшается синтез гемоглобина. Также причиной нарушений бывают и врожденные болезни с нарушением усвоения витаминов и минералов. Так развиваются дефицитные анемии. Наиболее известная и распространенная форма – это железодефицитная, но возможны и фолиеводефицитная, В12-дефицитная.
Какую структуру имеет молекула гемоглобина
Молекула гемоглобина в структуре содержит белковую часть – глобин и пигментный комплекс с железом (гем). У взрослого человека белок имеет 2 альфа и 2 бета цепи, они состоят из 141 и 146 аминокислот соответственно. Нормальный гемоглобин имеет обозначение HbA1. Следовые количества представлены HbA2, в нем вместо бета-цепей есть дельта-цепи. Такой комплекс прочно удерживает кислород и с трудом его отдает тканям.
В крови у плода есть два вида гемоглобина – эмбриональный и фетальный. Они имеют другую первичную структуру. У новорожденного 80% составляет фетальный, а к концу первого месяца молекула приобретает вид обычного, характерного для взрослого.
Число гемов в составе молекулы
Молекула гемоглобина состоит из четырех гемов. Каждый гем внутри содержит железо и окружен глобином, образующим гемовый «карман». Такое расположение обеспечивает растворимость и возможность соединения с кислородом. Каждая субъединица может связывать одну молекулу кислорода.
Поэтому на каждый гемоглобин эритроцита приходится 4 молекулы кислорода. После того, как доставка кислородных молекул завершена, гемоглобин забирает из тканей углекислоту, и в легких она выделяется в воздух при выдохе.
Роль железа в синтезе гемоглобина
Железо является необходимым компонентом для синтеза гемоглобина, так как оно обеспечивает связи ядер порфирина, аминокислот глобина, то есть оно удерживает весь комплекс. Биологическая роль железа состоит также в:
- связывании кислорода в легких;
- транспортировке кислорода к тканям и внутриклеточном переносе к митохондриям;
- использовании кислородных ионов для образования энергии;
- обезвреживании токсичных соединений.
Источниками минерала является пища и ионы, образовавшиеся при распаде гемоглобина (повторное использование). Усиление всасывания железа из кишечника происходит при снижении его запасов. Хранится микроэлемент в виде ферритина.
Болезни с нарушением синтеза гемоглобина
Снижение синтеза гемоглобина происходит при дефицитных анемиях, но есть и более редкие формы нарушений – образование неправильных цепей глобина (гемоглобинозы) и дефекты порфирина (порфирии).
Гемоглобинозы
Гемоглобинозы делятся на гемоглобинопатии и талассемии.
Гемоглобинопатии характеризуются образованием гемоглобина неправильной структуры. Могут протекать бессимптомно при мелких изменениях или тяжело при существенных аномалиях. Примером опасной формы является серповидно-клеточная анемия. При ней образуется HbS. Глутаминовая кислота в нем заменена на валин в шестом положении бета-цепи. Это приводит к снижению растворимости гемоглобина внутри эритроцита, и он образует осадок в виде серпа. Для этого заболевания характерны:
- нарушение кровотока в мелких сосудах;
- склонность к тромбозам;
- высокий риск инсульта, инфаркта;
- ускоренное разрушение эритроцитов (гемолитическая анемия);
- одышка, особенно при физических нагрузках.
При талассемии нарушается синтез одной из цепей гемоглобина. Чаще всего изменяется бета-цепь. Фетальный гемоглобин из-за этого не превращается в полноценный HbA1, его в крови у взрослых содержится до 60%, а вторая форма с плохой отдачей кислорода HbA2 составляет около 15%. Эти формы гемоглобина нестойкие, поэтому эритроциты быстро разрушаются. Болезнь сопровождается:
- разрастанием и разрушением костного мозга;
- изменениями формы лица и черепа;
- поражением селезенки и печеночной ткани;
- увеличением количества железа в сыворотке крови и его отложением в тканях.
Причиной смерти больного чаще всего бывает сердечная недостаточность из-за накопления железа в миокарде.
Порфирии
Нарушение янтарно-глицинового пути образования порфирина приводит к порфирии. Это врожденные и приобретенные болезни, наиболее распространены эритроцитарная и печеночная. Первая характеризуется дефектом ферментов, участвующих в синтезе гема. В организме накапливается уропорфириноген, он не может включиться в гемовый остаток и выделяется с мочой, концентрируется в костном мозге. Типичные признаки:
- красная моча;
- ускоренное разрушение эритроцитов;
- красноватый оттенок зубов;
- высокая чувствительность к солнечным лучам.
Печеночная порфирия бывает врожденной и на фоне злоупотребления барбитуратами (снотворные). Моча имеет цвет красного вина, больные предъявляют жалобы на частую рвоту, запоры, нарушения работы сердца, боль в животе. Нередко возникают психические расстройства.
Для синтеза гемоглобина нужно железо, белок, витамины, немного меди и кобальта. Его образование происходит в костном мозге, а при нарушении возникает талассемия, порфирии, серповидно-клеточная и дефицитные анемии.
Источник
Анонимный вопрос
5 марта 2019 · 697
Какое строение имеет молекула АТФ?
Любитель книг, кошек, увлекаюсь написанием рецензий
Молекула АТФ состоит из трех компонентов: аденина, рибозы (пятиуглеродный моносахарид) и трех остатков фосфорной кислоты, которые соединены между собой макроэнергетическими связями (при их расщеплении выделяет в 4 раза больше энергии, чем при расщеплении любых других).
Прочитать ещё 1 ответ
Примерно сколько атомов гелия содержится в 4 кг гелия?
Молодой-исследовать в области химии и ядерной физики ускорителей частиц, г. Падуя, Италия. · tele.click/real_italy
К уже правильному ответу предложу свое решение, для тех кто предпочитает формульные решения.
n = m/M = N / Na = V / Vm
где n – кол моль вещества
m – масса вещества – в г
M – молекулярная масса (в нашем случаи атомная масса) в г/моль
N – колл. составляющих (атомов или молекул)
Na – число Авгодаро 6,022 * 10^23
V – обьем в л
Vm – молекулярный обьем 22,4 л/моль
С помощью этой формулы можно решить очень много задач школьной химии
Подставляем известные и выражаем неизвестную величины:
N = (m * Na)/M = 4000г * 6,022 * 10^23 ) / 4 г/моль = 6,022 * 10^26
Прочитать ещё 2 ответа
Если «миссия» Христа была принять мученическую смерть, и это был замысел Божий, то почему Иуда, который способствовал реализации этого, не считается святым?
мои ответы не являются “глубокомысленными” статьями для ЯДзен. пользователь…
Немного неправильная предпосылка в вопросе, мне кажется.
Смотрите. Вот идет бой, кому-то надо остаться и прикрыть отступление. По условиям боя это гарантированная смерть. Но она нужна для спасения остальных. Разве то, что смерть неизбежна и человек сам сознательно остаётся на эту смерть, делает противника невиновным в смерти?
Или врачи:
“Проблемой № 1 тогда был сифилис, перед которым общество оказалось совершенно беззащитным: действенных средств лечения не существовало, а профилактике препятствовало викторианское ханжество. Медики искали любые пути борьбы с болезнью, и эксперименты на себе происходили постоянно. Люди в расцвете сил обрекали себя на многолетнее гниение заживо даже не во имя победы над этим проклятием, а лишь для уточнения некоторых особенностей его распространения. И сегодня невозможно равнодушно читать выдержки из их историй болезни: «Молодой врач… привил себе материал от ребенка, который появился на свет с этой болезнью… Когда после прививки этот врач заболел, другой врач заразился от него только для того, чтобы узнать, заразна ли болезнь после такого пассажа инфекции через несколько организмов».” chuguev.info
Вот и предатель Иисуса был такой, своего рода, болезнью или противником. Гарантированно, что кто-то в итоге предаст Иисуса на смерть, как противник, который гарантировано выстрелит, как только ты столкнешься с ним, чтобы задержать. Чтобы не предали, надо было не рождаться. Чтобы не заболеть надо было не рождаться. Но Он родился, чтобы быть с нами. Аналогии всегда лишь аналогии, они не буквальны, но немного отражают идею.
Кроме того, предательство Иуды не было необходимым для тех, кто собирался схватить и казнить Иисуса. Ну схватили бы всю группу, а потом разобрались. Всё лишь вопрос времени — потом ведь и восстания были иудейские и всё подавили и всех зачинщиков уничтожили.
Прочитать ещё 30 ответов
Источник
Гемоглобин входит в состав эритроцитов и заполняет большую часть их внутриклеточного пространства. Основная функция гемоглобина связана с транспортом газов (кислорода и углекислого газа) в крови человека. Кроме этого, гемогобин участвует в поддержании кислотно-основного равновесия в организме человека и животных, образуя самую мощную гемоглобиновую буферную систему крови.
В настоящее время достаточно хорошо изучены структура и свойства гемоглобина. У взрослого человека в крови различают следующие физиологические типы гемоглобина:
1. Гемоглобин A1 (HbA1 – от англ. adult – взрослый), содержание которого составляет 96 % от общего содержания гемоглобина (Hb).
2. Гемоглобин A2 (HbA2) – содержание составляет до 2,5 %.
3. Фетальный гемоглобин (HbF от англ. fеtus – плод) составляет 1,5 – 2 %.
HbF явяляется главным гемоглобином у плода и у новорожденных, так как его содержание у новорожденных достигает до 80 %, но затем в первые три месяца после рождения он почти полностью заменяется на HbA.
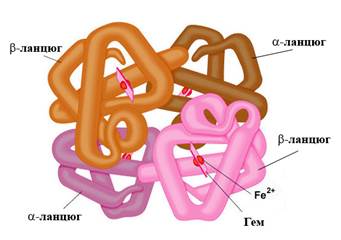
На рис. 1 схематично представлена структура молекулы гемоглобина.

Рис. 1. Модель молекулы гемоглобина (HbA1) (ланцюг с укр. – цепь).
Молекула гемоглобина взрослого человека HbA1 состоит из четырех полипептидных цепей, каждая из которых связана с одним гемом. Белковая часть молекулы гемоглобина имеет название “глобин”.
В состав HbA1 входят 2a- и 2b-цепи, которые являются продуктами экспрессии двух разных генов, и потому они имеют разную первичную структуру. В состав a-цепи входит 141, а в состав b-цепи – 146 аминокислотных остатков. Субъединицы гемоглобина, каждая содержит одну полипептидную цепь и один гем, по своей конформации напоминают структуру молекулы миоглобина (рис. 7). Схематично гемоглобин А1 записывают так: HbA1 = α2β2. В гемоглобине А2 вместо β субъединиц находятся δ-субъединицы: HbA2 = α2δ2, а в фетальном гемоглобине – γ-субъединицы, то есть HbF = α2γ2.
При образовании четвертичной структуры гемоглобина возникают многочисленные нековалентные связи между отдельными полипептидными цепями глобина. Наибольшее их количество образуется между разными типами цепей (a – b, α – δ, α – γ). Это преимущественно гидрофобные взаимодействия, которые возникают между радикалами некоторых аминокислот (лейцин, валин, фенилаланин и др.). Исследование структурной организации субъединиц молекулы гемоглобина в олигомерный белок проводилось с использованием раствора 8М мочевины или при резких изменениях рН. При этом молекула гемоглобина обратимо диссоциирует на две α- и две β-цепи. Эта диссоциация обусловлена разрывом водородных связей. После удаления мочевины происходит автоматическая ассоциация исходной молекулы гемоглобина (рис.2)
Рис. 2. Обратимая диссоциация молекулы гемоглобина при действии 8М раствора мочевины.
Небелковый компонент гемоглобина – гем. Основой структуры гема является протопорфирин. Протопорфирин состоит из четырех пиррольных колец, соединенных между собой α-метиновыми мостиками (–СН=). В зависимости от природы групп, которые находятся в боковых радикалах, порфирины имеют большое количество изомеров. Из возможных 15 изомеров протопорфиринов наиболее широко распространенным в биологических объектах является протопорфирин IX. Он содержит в боковых положениях 4 метильные, 2 винильные и 2 пропионильные группы (рис. 3 А). Хелатный комплекс протопорфирина IX с Fe2+ называется протогемом IX или гемом.
Катион железа, входящий в структуру гема, образует две ковалентные связи и две координационные связи с атомами азота пиррольных колец в плоскости протопорфиринового комплекса. Кроме этого, он участвует в образовании ещё двух координационных связей, которые расположены перпендикулярно плоскости протопорфиринового комплекса (рис. 3 Б).
Рис. 3. Связи катиона железа в геме гемоглобина. А – вид сверху; Б – вид сбоку (координационная связь над плоскостью протопорфиринового кольца свободна).
Пятая координационная связь атома железа обеспечивает присоединение гема к остатку гистидина, который находится в полипептидной цепи глобина.
Шестая координационная связь катиона железа используется для присоединения к гему различных лигандов (молекулы кислорода, монооксида углерода или других соединений). Именно данная связь имеет специальное значение для обратимого связывания молекулы кислорода.
Источник
