Может ли увеличение сродства гемоглобина к кислороду
Оглавление темы “Вентиляция легких. Перфузия легких кровью.”: Сродство гемоглобина к кислороду. Изменение сродства гемоглобина к кислороду. Эффект Бора.Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов. Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц. Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН. Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей. – Также рекомендуем “Углекислый газ. Транспорт углекислого газа.” |
Повышение сродства гемоглобина к кислороду
Молекула гемоглобина может находиться в двух формах — напряженной и расслабленной. Расслабленная форма гемоглобина имеет свойство насыщаться кислородом в 70 раз быстрее, чем напряженная. Изменение фракций напряженной и расслабленной формы в общем количестве гемоглобина в крови обусловливает S-образный вид кривой диссоциации оксигемоглобина, а следовательно, так называемое сродство гемоглобина к кислороду. Если вероятность перехода от напряженной формы гемоглобина к расслабленной больше, то возрастает сродство гемоглобина к кислороду, и наоборот. Вероятность образования указанных фракций гемоглобина изменяется в большую или меньшую сторону под влиянием нескольких факторов.
Основной фактор — это связывание кислорода с геминовой фуппой молекулы гемоглобина. При этом чем больше геминовых фупп гемоглобина связывают кислород в эритроцитах, тем более легким становится переход молекулы гемоглобина к расслабленной форме и тем выше их сродство к кислороду. Поэтому при низком Р02, что имеет место в метаболически активных тканях, сродство гемоглобина к кислороду ниже, а при высоком Р02 — выше. Как только гемоглобин захватывает кислород, повышается его сродство к кислороду и молекула гемоглобина становится насыщенной при связывании с четырьмя молекулами кислорода.
Когда эритроциты, содержащие гемоглобин, достигают тканей, то кислород из эритроцитов диффундирует в клетки. В мышцах он поступает в своеобразного депо кислорода — в молекулы миоглобина, из которого кислород используется в биологическом окислении мышц.
Диффузия кислорода из гемоглобина эритроцитов в ткани обусловлена низким Р02 в тканях — 35 мм рт. ст. Внутри клеток тканей напряжение кислорода, необходимое для поддержания нормального метаболизма, составляет еще меньшую величину — не более 1 кПа. Поэтому кислород путем диффузии из капилляров достигает метаболически активных клеток. Некоторые ткани приспособлены к низкому содержанию Р02 в капиллярах крови, что компенсируется высокой плотностью капилляров на единицу объема тканей. Например, в скелетной и сердечной мышцах Р02 в капиллярах может снизиться чрезвычайно быстро во время сокращения. В мышечных клетках содержится белок миоглобин, который имеет более высокое сродство к кислороду, чем гемоглобин. Миоглобин интенсивно насыщается кислородом и способствует его диффузии из крови в скелетную и сердечную мышцы, где он обусловливает процессы биологического окисления. Эти ткани способны экстрагировать до 70 % кислорода из крови, проходящей через них, что обусловлено снижением сродства гемоглобина к кислороду под влиянием температуры тканей и рН.
Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани.
Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей.
источник
Эффективность связывания кислорода с гемоглобином регулируется
Кооперативное взаимодействие
Взаимовлияние протомеров олигомерного белка друг на друга называется кооперативное взаимодействие.
В легких такое взаимодействие субъединиц гемоглобина повышает его сродство к кислороду и ускоряет присоединение кислорода в 300 раз. В тканях идет обратный процесс, сродство снижается и ускорение отдачи кислорода также 300-кратное.
Схема кооперативного взаимодействия субъединиц гемоглобина
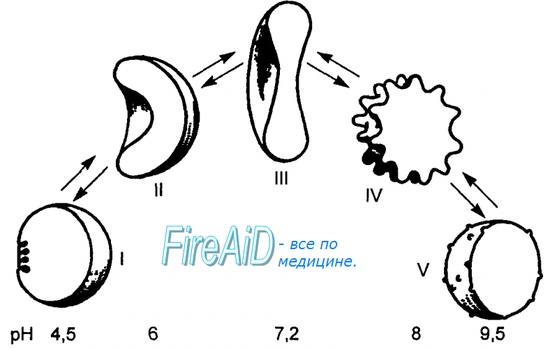
Объясняется такой феномен тем, что в легких при присоединении первой молекулы кислорода к железу (за счет 6-й координационной связи) атом железа втягивается в плоскость гема, кислород остается вне плоскости. Это вызывает перемещение участка белковой цепи и изменение конформации первого протомера. Такой измененный протомер влияет на другие субъединицы и облегчает связывание кислорода со второй субъединицей. Это меняет конформацию второй субъединицы, облегчая присоединение последующих молекул кислорода и изменение других протомеров.
Изменение формы субъединиц гемоглобина
при присоединении и отщеплении кислорода
Дезоксиформа гемоглобина обозначается как Т-форма, напряженная (англ. tense), она обладает существенно более низким сродством к кислороду. Оксигенированная форма, или R-форма (англ. relaxed), обладает высоким сродством к кислороду.
Изменение рН среды
Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н + из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:
Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H + и О2 обусловлено конформационными перестройками глобиновой части молекулы. В тканях молекула О 2 отрывается от железа и ионы водорода присоединяются к остаткам гистидина (глобиновой части), образуя восстановленный гемоглобин (H-Hb) с низким сродством к кислороду. В легких поступающий в больших количествах кислород «вытесняет» ион водорода из связи с остатком гистидина гемоглобиновой молекулы.
Механизм эффекта Бора
Роль 2,3-дифосфоглицерата
2,3-Дифосфоглицерат образуется в эритроцитах из 1,3-дифосфоглицерата, промежуточного метаболита гликолиза, в реакциях, получивших название шунт Раппопорта.
Реакции шунта Раппопорта
2,3-Дифосфоглицерат располагается в центральной полости тетрамера дезоксигемоглобина и связывается с β-цепями, образуя поперечный солевой мостик между атомами кислорода 2,3-дифосфоглицерата и аминогруппами концевого валина обеих β-цепей, также аминогруппами радикалов лизина и гистидина.
Расположение 2,3-дифосфоглицерата в гемоглобине
Функция 2,3-дифосфоглицерата заключается в снижении сродства гемоглобина к кислороду, что имеет особенное значение при подъеме на высоту и при нехватке кислорода во вдыхаемом воздухе. В этих условиях связывание кислорода с гемоглобином в легких не нарушается, так как концентрация его относительно высока. Однако в тканях за счет 2,3-дифосфоглицерата отдача кислорода возрастает в 2 раза.
источник
Факторы, влияющие на сродство гемоглобина к кислороду
Динамика кривой зависит от нескольких факторов. Кривая может сдвигаться относительно оси абсцисс вправо или влево (эффект Бора) в зависимости от сопутствующего парциального давления двуокиси углерода и величины рН. При этом реальная физиологическая кривая имеет S-образную форму. При увеличении содержания двуокиси углерода и закис-лении крови кривая диссоциации оксигемоглобина сдвигается вправо и, напротив, при снижении РСо2 и защелачивания крови кривая сдвигается влево.
Биологическое значение кривой диссоциации оксигемоглобина.Кривая диссоциации оксигемоглобина имеет важное биологическое значение для переноса кислорода кровью. Участок кривой, соответствующий низким парциальным значениям кислорода, характеризует содержание оксигемоглобина в капиллярах тканей, а фрагмент кривой, лежащий в области высокого парциального давления кислорода 80—100 мм рт.ст., соответствует крови в легочных капиллярах.
Эффективность транспорта кислородак тканям определяют два фактора: количество оксигемоглобина, образовавшегося в легких, и количество кислорода, отдаваемого тканям, что зависит от степени распада оксигемоглобина в восстановленный гемоглобин. Процесс наиболее эффективного переноса кислорода к тканям соответствует S-образной форме кривой диссоциации оксигемоглобина. В области высокого парциального давления кислорода кривая близка к насыщению кислородом крови, а в области низких значений парциального давления кислорода в тканях значительная часть оксигемоглобина отдает кислород и превращается в восстановленную форму.
Эффект Бора. Огромное биологическое значение для транспорта кислорода и двуокиси углерода имеет эффект Бора.
При увеличении парциального давления двуокиси углерода в тканях кривая диссоциации оксигемоглобина, сдвигаясь вправо, отражает повышение способности оксигемоглобина отдавать кислород тканям и тем самым высвобождаться для дополнительного связывания двуокиси углерода и переноса ее избытка из тканей в легкие.
Напротив, при снижении парциального давления двуокиси углерода и смещении рН крови в основную сторону (алкалоз) сдвиг кривой диссоциации оксигемоглобина влево означает снижение способности оксигемоглобина отдавать кислород тканям и поглощать двуокись углерода для транспорта ее к легким.
Сдвиг кривой диссоциации оксигемоглобина иллюстрирует взаимосвязь транспорта кислорода и двуокиси углерода в крови и сродство гемоглобина к этим газам.
#82 Объясните мех-мы транспорта углекислого газа кровью, роль карбоангидразы. Проанализируйте роль дыхания в регуляции рН крови.
Перенос углекислого газа. Двуокись углерода, образующаяся в тканях, переносится с кровью к легким и выделяется с выдыхаемым воздухом в атмосферу. В отличие от транспорта кислорода она транспортируется кровью тремя способами.
Формы транспорта углекислого газа. Во-первых, так же как и кислород, двуокись углерода переносится в физически растворенном состоянии. Содержание физически растворенной двуокиси углерода в артериальной крови составляет 0,026 мл в 1 мл крови, что в 9 раз превышает количество физически растворенного кислорода. Это объясняется гораздо более высоким коэффициентом растворимости двуокиси углерода.
Во-вторых, двуокись углерода транспортируется в виде химического соединения с гемоглобином — карбогемоглобина.
В третьих — в виде гидрокарбоната НСОз, образующегося в результате диссоциации угольной кислоты.
Механизм переноса двуокиси углерода. Перенос двуокиси углерода из тканей в легкие осуществляется следующим образом. Наибольшее парциальное давление двуокиси углерода в клетках тканей и в тканевой жидкости — 60 мм рт.ст.; в притекающей артериальной крови оно составляет 40 мм рт.ст. Благодаря этому градиенту двуокись углерода движется из тканей в капилляры. В результате ее парциальное давление возрастает, достигая в венозной крови 46—48 мм рт.ст. Под влиянием высокого парциального давления часть двуокиси углерода физически растворяется в плазме крови.
Роль карбоангидразы. Большая же часть двуокиси углерода претерпевает химические превращения. Благодаря ферменту карбоангидразе она соединяется с водой, образуя угольную кислоту Н2СО3. Особенно активно эта реакция идет в эритроцитах, мембрана которых хорошо проницаема для двуокиси углерода.
Угольная кислота (Н2СО3) диссоциирует на ионы водорода Н + и гидрокарбоната (НСОз), которые проникают через мембрану в плазму.
Наряду с этим двуокись углерода соединяется с белковым компонентом гемоглобина, образуя карбоаминовую связь.
В целом 1 л венозной крови фиксирует около 2 ммоль двуокиси углерода. Из этого количества 10 % находится в виде карбоаминовой связи с гемоглобином, 35 % составляют ионы гидрокарбоната в эритроцитах, и оставшиеся 55 % представлены угольной кислотой в плазме.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Для студентов недели бывают четные, нечетные и зачетные. 9839 —
| 7651 — или читать все.
источник
Сродство гемоглобина к кислороду
Эффект рН и температуры на сродство гемоглобина к кислороду. Молекулы гемоглобина способны реагировать с ионами водорода, в результате этой реакции происходит снижение сродства гемоглобина к кислороду. При насыщении гемоглобина менее 100 % низкое рН понижает связывание кислорода с гемоглобином — кривая диссоциации оксигемоглобина смещается вправо по оси х. Это изменение свойства гемоглобина под влиянием ионов водорода называется эффектом Бора. Метаболически активные ткани продуцируют кислоты, такую как молочная, и С02. Если рН плазмы крови снижается от 7,4 в норме до 7,2, что имеет место при сокращении мыщц, то концентрация кислорода в ней будет возрастать вследствие эффекта Бора. Например, при постоянном рН 7,4 кровь отдавала бы порядка 45 % кислорода, т. е. насыщение гемоглобина кислородом снижалось до 55 %. Однако когда рН снижается до 7,2, кривая диссоциации смещается по оси х вправо. В результате насыщение гемоглобина кислородом падает до 40 %, т. е. кровь может отдавать в тканях до 60 % кислорода, что на 1/з больше, чем при постоянном рН.
Метаболически активные ткани повышают продукцию тепла. Повышение температуры тканей при физической работе изменяет соотношение фракций гемоглобина в эритроцитах и вызывает смещение кривой диссоциации оксигемоглобина вправо вдоль оси х. В результате большее количество кислорода будет освобождаться из гемоглобина эритроцитов и поступать в ткани. Эффект 2,3-дифосфоглицерата (2,3-ДФГ) на сродство гемоглобина к кислороду. При некоторых физиологических состояниях, например при понижении Р02 в крови ниже нормы (гипоксия) в результате пребывания человека на большой высоте над уровнем моря, снабжение тканей кислородом становится недостаточным. При гипоксии может понижаться сродство гемоглобина к кислороду вследствие увеличения содержания в эритроцитах 2,3-ДФГ. В отличие от эффекта Бора, уменьшение сродства гемоглобина к кислороду под влиянием 2,3-ДФГ не является обратимым в капиллярах легких. Однако при движении крови через капилляры легких эффект 2,3-ДФГ на снижение образования оксигемоглобина в эритроцитах (плоская часть кривой диссоциации оксигемоглобина) выражен в меньшей степени, чем отдача кислорода под влиянием 2,3-ДФГ в тканях (наклонная часть кривой), что обусловливает нормальное кислородное снабжение тканей.
КИСЛОРОДНАЯ ЕМКОСТЬ КРОВИ —максимальное количествокислорода, обратимо связанное кровью; выражается в объемных процентах; зависит от концентрации в кровигемоглобина. Кислородная емкость крови человека ок. 18-20%.
Оксигемометрия— фотометрический метод измерения степени насыщения артериальной крови кислородом, т. е. процентного содержания в ней гемоглобина в форме оксигемоглобина. Оксигемометрия позволяет судить, насколько полно осуществляется оксигенация крови в легких, так как она дает объективный показатель эффективности внешнего дыхания и кровообращения. Оксигемометрию используют для выявления гипоксемической циркуляторной гипоксии (см.). О. производят специальными приборами — оксигемометрами.
Пульсоксиметрия — методика определения количества кислорода, связанного с гемоглобином, в артериальной крови. К каждой молекуле гемоглобина может присоединится до четырех молекул кислорода. Средний процент насыщения молекул гемоглобина является кислородной сатурацией крови. 100% сатурация означает, что ккаждая молекула гемоглобина в исследуемом объеме крови переносит четыре молекулы кислорода.
Д.Ц. – парное образование расположенное в продолговатом мозге справа и слева от его дорсальной срединной борозды и обеспечивающее автоматическую смену фаз дыхания.
Виды нейронов дыхательного центра
1. H-пейсмекеры – автоматические нейроны.
2. Инспираторные нейроны (И.Н.)
3. Экспираторные нейроны (Э.Н.)
4. Переходные (инспираторно-экспираторные нейроны, И.-Э., Э.-И.)
Нейроны дыхательного центра образуют скопление в виде дыхательных или респираторных функций.
1. Дорсальная респираторная группа.
· Имеет медиальное расположение
· В основном нейроны вдоха (И.Н.)
· Контролирует мотонейроны диафрагмы
· Обеспечивает рефлекс Геринга-Брейера (рефлекс переключения вдоха на выдох)
· Получает сигналы от рецепторов растяжения легких по блуждающим нервам
· Получает сигналы от рецепротов растяжения легких по блуждающим нервам
· Получает сигналы от верхних структур Г.М., а так же от хемо- и баро- рецепторов сосудов.
2. Вентральная респираторная группа VRG
· Передает сигналы к мотонейронам для наружных и внутренних межреберных мышц
· 3-pre-Botzinger – комплекс (пейсмекеры)
· Содержит пейсмекерные нейроны
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: На стипендию можно купить что-нибудь, но не больше. 9358 —
| 7417 — или читать все.
источник