Нарушение синтеза гемоглобина это
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис
Нарушение синтеза гема может привести к снижению активности геминовых ферментов тканей и к гипотрофии..
Биосинтез порфиринов является одним из универсальных биологических процессов, так как порфирины в виде комплексов с металлами (металлопорфиринов), составляют основу гемоглобина и миоглобина, а также жизненно важных энергетических ферментов (цитохромов В и С, цитохромоксидаз, каталаз, пероксидаз). Синтез порфиринов происходит в эритробластах костного мозга, митохондриальпом аппарате печени и почек, в клетках центральной нервной системы. Основная часть порфиринов идет на синтез тема, который представляет сложный энзиматический процесс, (каждый этап которого регулируется определенным ключевым ферментом).
Участвующие в синтезе гема ферменты можно разделить на три группы. Первая группа связана с синтезом АЛК в янтарно-глициновом цикле. Ключевой фермент – синтетаза АЛК, коферментом этой реакции служит пиридоксальфосфат, производное витамина В6. Вторая группа ферментов осуществляет превращение АЛК в ПБГ. Ключевой фермент – дегидратаза АЛК. Третья группа ферментов связана с заключительным этапом синтеза гема. Ключевые «ферменты – копрогеназа и гемсинтетаза.
Ряд ферментов, регулирующих процесс биосинтеза гема, содержит высоко реактивные функциональные группы – сульфгидрильные, карбоксильные и аминные. Токсические вещества, и особенно тяжелые металлы, могут блокировать эти группировки в ферментах, замещая атомы водорода в них и тем самым нарушая активность ферментов. Наиболее активны в этом плане вещества из группы «тиоловых ядов», которые при попадании в организм вступают во взаимодействие с веществами, содержащими серу, и в частности SH-группами. Таким путем многие токсические вещества, независимо от тропности их действия, способны вызывать изменения в биосинтезе порфиринов. Нарушения порфиринового обмена установлены при интоксикации бензолом – повышение АЛК в эритроцитах, окисью углерода – повышение КП эритроцитов, небольшое увеличение КП и АЛК мочи, акрилатами – увеличение ПП эритроцитов, фосфором – некоторое увеличение мочевой экскреции АЛК и КП.
Однако среди всех промышленных ядов, способных вызывать те или иные расстройства синтеза порфиринов и гема, совершенно исключительное положение занимает свинец, при действии которого они носят первичный характер и являются определяющим патогенетическим механизмом интоксикации.
Гемоглобинопатия — наследственное или врождённое изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов.
К наиболее часто встречающимся и известным гемоглобинопатиям относятся серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина.
Гемоглобинопатии классифицируются на качественные и количественные. Качественные обусловлены заменой аминокислот в полипептидных цепях. Замена аминокислоты глутамина 6 на валин в β-цепи приводит к образованию аномального гемоглобина S, что лежит в основе развития серповидно-клеточной анемии. Аномальных гемоглобинов более 300, но не все аномалии проявляются. Первые аномальные гемоглобины назывались буквами латинского алфавита (М, С, Д, S и др.). Но, так как аномальных гемоглобинов много, их названия включают места открытия (Boston, Москва, Волга и др.) или названия госпиталей. Количественные гемоглобинопатии связаны со скоростью синтеза α- или β-полипептидных цепей глобина. Угнетение скорости синтеза α-цепи приводит к развитию α-талассемии, угнетение синтеза β-цепи лежит в основе заболевания β-талассемии. Гемоглобинопатии — наследственные заболевания. Диагностика гемоглобинопатий основывается, кроме клинических данных, на обязательном специальном исследовании электрофорезе гемоглобина. Это исследование проводится не только для больного, но и для ближайших родственников. Данные электрофореза гемоглобина позволяют поставить диагноз талассемии. Для альфа-талассемии характерно обнаружение гемоглобинов-гомотетрамеров Нв-Н и Нв-Bart.Для бета-талассемии характерно повышенное содержание гемоглобина Α2.
ОБМЕН ЖЕЛЕЗА
В гемсодержащих белках железо находится в составе гема. В негемовых железосодержащих белках железо непосредственно связывается с белком. К таким белкам относят трансферрин, ферритин, окислительные ферменты рибонук-леотидредуктазу и ксантиноксидазу, железофлавопротеины NADH-дегидрогеназа и сукцинат-дегидрогеназа.
В организме взрослого человека содержится 3 – 4 г железа, из которых только около 3,5 мг находится в плазме крови. Гемоглобин имеет примерно 68% железа всего организма, ферритин – 27%, миоглобин – 4%, трансферрин – 0,1%, На долю всех содержащих железо ферментов приходится всего 0,6% железа, имеющегося в организме. Источниками железа при биосинтезе железосодержащих белков служат железо пищи и железо, освобождающееся при постоянном распаде эритроцитов в клетках печени и селезёнки.
В нейтральной или щелочной среде железо находится в окисленном состоянии – Fe3+, образуя крупные, легко агрегирующие комплексы с ОН-, другими анионами и водой. При низких значениях рН железо восстанавливается и легко диссоциирует. Процесс восстановления и окисления железа обеспечивает его перераспределение между макромолекулами в организме. Ионы железа обладают высоким сродством ко многим соединениям и образуют с ними хелатные комплексы, изменяя свойства и функции этих соединений, поэтому транспорт и депонирование железа в организме осуществляют особые белки. В клетках железо депонирует белок ферритин, в крови его транспортирует белок трансферрин..
Железодефицитная анемия (ЖДА) — гематологический синдром, характеризующийся нарушением синтеза гемоглобина вследствие дефицита железа и проявляющийся анемией и сидеропенией. Основными причинами ЖДА являются кровопотери и недостаток богатой гемом пищи. ЖДА является последней стадией дефицита железа в организме. Клинических признаков дефицита железа на начальных стадиях нет, и диагностика предклинических стадий железодефицитного состояния стала возможной лишь благодаря развитию методов лабораторной диагностики. В зависимости от выраженности дефицита железа в организме различают три стадии:
прелатентный дефицит железа в организме;
латентный дефицит железа в организме;
железодефицитная анемия. Биохимический анализ крови
При развитии ЖДА в биохимическом анализе крови будут регистрироваться:
уменьшение концентрации сывороточного ферритина;
уменьшение концентрации сывороточного железа;
повышение ОЖСС;
уменьшение насыщения трансферрина железом.
Распад гемоглобина. Образование пигментов желчи, кала и мочи
Распад гемоглобина протекает в клетках макрофагов, в частности в звездчатых ретикулоэндотелиоцитах, а также в гистиоцитах соединительной ткани любого органа.
Как отмечалось (см. главу 13), начальным этапом распада гемоглобина является разрыв одного метинового мостика с образованием вердоглобина. В дальнейшем от молекулы вердоглобина отщепляются атом железа и белок глобин. В результате образуется биливердин, который представляет собой цепочку из четырех пиррольных колец, связанных метановыми мостиками. Затем биливердин, восстанавливаясь, превращается в билирубин – пигмент, выделяемый с желчью и поэтому называемый желчным пигментом. Образовавшийся билирубин называется непрямым (неконъю-гированным) билирубином. Он нерастворим в воде, дает непрямую реакцию с диазореактивом, т.е. реакция протекает только после предварительной обработки спиртом.
Весь ход образования Ж. п. из гемоглобина можно представить в виде следующей схемы:
Гемоглобин -> Холеглобин -> Вердогемоглобин
↓ — Глобин
— Fe
Биливердин
↓ + H2O
Билирубин
↓ + 2H2
Мезобилирубин
↓ +2Н2
Стеркобилиноген
(Уробилиноген)
↓ — H2
Стеркобилин
(Уробилин).
Ж. п. обладают свойствами кислот и дают соли с металлами (иногда нерастворимые), с чем и связано их участие в образовании жёлчных камней (см. Желчнокаменная болезнь). Повышенное содержание Ж. п. в кожных покровах, крови, моче имеет диагностическое значение при разных формах желтух.
8. Диагностическое значение определения желчных пигментов в крови и моче
Методы определения билирубина и его метаболитов
Определение билирубина в сыворотке крови
В клинической практике используются различные методы определения билирубина и его фракций в сыворотке крови.
Наиболее распространенным из них является биохимический метод Ендрассика-Грофа. Он основан на взаимодействии билирубина с диазотированной сульфаниловой кислотой с образованием азопигментов. При этом связанный билирубин (билирубин-глюкуронид) дает быструю («прямую») реакцию с диазореактивом, тогда как реакция свободного (не связанного с глюкуронидом) билирубина протекает значтельно медленнее. Для ее ускорения применяют различные вещества–акселераторы, например кофеин (метод Ендрассика-Клеггорна-Грофа), которые освобождают билирубин из белковых комплексов («непрямая» реакция). В результате взаимодействия с диазотированной сульфаниловой кислотой билирубин образует окрашенные соединения. Измерения проводят на фотометре.
Нарушения обмена билирубина
Гипербилирубинемия – это нарушение равновесия между образованием и выделением билирубина. Основным клиническим признаком является желтуха (иктеричность) – желтая пигментация кожи или оболочек глаз, обусловленная повышением содержания билирубина в крови.
Нормальный уровень билирубина в крови – 8,5–20,5 мкмоль / л. Желтуха обнаруживается при уровне билирубина выше 34,2 мкмоль / л. Однако точный уровень билирубина в крови, при котором можно выявить желтуху, варьирует.
Билирубин – конечный продукт катаболизма порфиринового кольца молекулы гемоглобина, он не содержит ни железа, ни белка.
Нарушение обмена билирубина связано с расстройством его образования и выделения.
Симптомокомплекс, характеризующийся увеличением количества билирубина в крови с накоплением его в тканях и желтушным окрашиванием кожи, склер, слизистых, серозных оболочек и внутренних органов, называется желтухой.
Желтуха может возникать при наличии следующих условий:
увеличенное образование билирубина;
уменьшенная экскреция печенью;
обструкция желчного протока.
По механизмам развития желтухи различают три ее вида:
надпеченочную (гемолитическую) – характеризуется повышенным образованием билирубина в связи с увеличенным распадом (гемолизом) эритроцитов;
печеночную (паренхиматозную) – возникает при повреждении гепатоцитов (дистрофии и некрозе их), в результате чего нарушается захват, связывание и экскреция билирубина, что приводит к увеличению его содержания в крови;
подпеченочную (механическую) – происходит обтурация желчных путей, что приводит к накоплению связанного билирубина проксимальнее преграды в желчных путях и печени (холестаз).
Источник
Серповидно-клеточная анемия
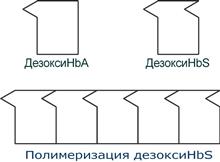
HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ, что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина “липкого” участка. При дезоксигенации гемоглобина участок “раскрывается” и связывает одну молекулу дезоксигемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцитов и, при прохождении ими капилляров, гемолиз.

Схема отличия гемоглобина S от гемоглобина А и его полимеризация
Нарушение синтеза гемоглобина
Порфирии
Порфирии – это группа гетерогенных наследственных заболеваний, возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме. Выделяют наследственные и приобретенные формы порфирии.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.), лекарственными препаратами (антигрибковый антибиотик гризеофульфин).
При наследственных формах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий:
1. Печеночные – группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина IX.
Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность уропорфириноген-I-синтазы снижена на 50%. В результате больные экскретируют с мочой большие количества порфобилиногена и аминолевулиновой кислоты. На свету порфобилиноген окисляется в окрашенные соединения и моча темнеет. Симптомами заболевания являются острые боли в животе, нервно-психические расстройства (полиневриты, тетрапарез, галлюцинации), сердечно-сосудистые нарушения.
Заболевание проявляется после достижения половой зрелости из-за повышенной потребности гепатоцитов в цитохроме Р450 для обезвреживания половых стероидов, обострение состояния также часто бывает после приема лекарственных препаратов, метаболизм которых требует участия цитохрома Р450. Снижение концентрации гема, используемого для синтеза цитохрома Р450, активирует аминолевулинат синтазу.
2. Эритропоэтические – аутосомно-рецессивные нарушения некоторых ферментов синтеза протопорфирина IX в эритроидных клетках. При этом при синтезе уропорфириногенов баланс реакций смещается в сторону синтеза уропорфириногена I. Примером может служить болезнь Гюнтера (частота<1:1000000), при которой развиваются высокая фоточувствительность кожи (ожоги под солнечным светом) и ее поражение, гемолиз, эритродонтия (окрашивание зубов в красный цвет), разрушение хрящей, в том числе носа и ушей.
Талассемии
Для талассемий характерно снижение синтеза α-цепей гемоглобина (α-талассемия) или β-цепей (β-талассемия). Это приводит к нарушению эритропоэза, гемолизу и тяжелым анемиям.
Источник
Железодефицитная анемия
Общепринято выделять две формы железодефицитных состояний: латентный (скрытый) дефицит железа и железодефицитную анемию.
- Латентный дефицит железа характеризуется уменьшением количества железа в организме (сокращение его запасов в органах-депо) и снижением уровня транспортного железа крови при нормальных показателях гемоглобина и эритроцитов.
- Железодефицитная анемия — это патологическое состояние, характеризующееся нарушением синтеза гемоглобина в результате недостатка железа в организме (истощение его запасов в органах-депо), которое проявляется признаками анемии и сидеропении.
Люди, страдающие от железодефицитных состояний, составляют около 20% населения Земли. Железодефицитная анемия является самой распространенной патологией системы крови и самой часто встречаемой анемией.
Причины возникновения железодефицитных состояний очень разнообразны. Распознать причину развития железодефицитной анемии в каждом конкретном случае чрезвычайно важно, так как сама по себе анемия не является первичным заболеванием, а в большинстве случаев обусловлена какой-либо патологией.
Подробнее о железодефицитной анемии читайте в этой статье.
Талассемия
Талассемия — анемия, обусловленная нарушением синтеза глобулиновой части молекулы гемоглобина, связанного с рецессивно наследуемыми аномалиями генов. Выделяют:
- альфа-талассемию, вызванную дефектом сектора α-цепи при отсутствии мРНК гена-α-глобулина,
- бета-талассемию, обусловленную отсутствием или нарушением функции гена β-глобулина.
Альфа-талассемия (α-талассемия)
Существует 4 вида α-талассемии, связанные с 4 генами α-цепей:
— Делеция или инактивация четырех генов α-цепей глобина приводит к водянке плода, ребенок рождается мертвым, концентрация гемоглобина в крови резко снижена, и он представлен в основном гемоглобином Bart. Преобладает у выходцев из азиатских стран.
— Делеция или инактивация трех генов α-цепей глобина приводит к гемоглобинопатии Н, при которой выявляется микроцитарная гипохромная анемия с мишеневидными эритроцитами и тельцами Гейнце в мазках крови. Клиническими проявлениями могут быть гемолитическая анемия и спленомегалия. Течение длительное, симптомы анемии наблюдаются в детском возрасте, но в легких случаях — лишь в зрелом возрасте. При этом варианте гемоглобинопатии показана спленэктомия.
— Делеция или инактивация двух генов α-цепей глобина не приводит к выраженному нарушению нормального эритропоэза. Развивается синдром, называемый “малой α-талассемией”. Клиника проявляется легкой микроцитарной гипохромной анемией, не требующей лечений.
— При делеции или инактивации одного гена α-цепей глобина клиника анемии отсутствует.
Бета-талассемия (β-талассемия)
β-талассемии связаны с наследованием ребенком гена β-глобина с нарушенной функцией. В геноме β-глобина имеются 2 мутантных аллеля.
- При наследовании только одного аллеля развивается гетерозиготная β-талассемия (малая талассемия).
- При наследовании двух мутантных аллелей развивается гомозиготная β-талассемия (большая талассемия, анемия Кули).
Гетерозиготная β-талассемия протекает с клиникой легкой гипохромной анемии, анизоцитозом и пойкилоцитозом, незначительным увеличением селезенки и повышением содержания фракции HbA2. Прогноз при данной форме анемии благоприятный.
Гомозиготная β-талассемия имеет тяжелое течение, проявляется выраженной гемолитической анемией, развивающейся к концу первого года жизни ребенка, гепатомегалией и спленомегалией, отставанием ребенка в физическом развитии, монголоидностью лица и башенным черепом.
Характерны резкое снижение образования HbA1, увеличение содержания HbF, нормальное или повышенное содержание HbA2. Уровень гемоглобина составляет 30–50 г/л, цветовой показатель ниже 0,5. В мазках крови выявляют мишеневидные эритроциты, анизоцитоз и пойкилоцитоз. Длительный гемолиз и частые переливания крови приводят к развитию гемосидероза печени и селезенки и нередко к образованию билирубиновых камней в желчных путях.
Прогноз при тяжелой гомозиготной β-талассемии неблагоприятный, больные умирают в первые годы жизни. При талассемии средней тяжести дети доживают до школьного возраста, при талассемии легкой степени тяжести больные доживают до среднего возраста.
Лечение
При альфа- и бета-талассемиях проводят гемотрансфузии (повторное переливание отмытых или размороженных эритроцитов), введение фолиевой кислоты (прием по 0,005 г 1–2 раза в день). Спленэктомию проводят по показаниям (при значительной спленомегалии и распаде эритроцитов в селезенке). Замедление развития гемосидероза достигается назначением хелатов железа (десферал, дефероксамин). Трансплантация костного мозга может привести к выздоровлению.
Анемии при хронических заболеваниях
У больных с воспалительными процессами, хроническими инфекциями, аутоиммунными заболеваниями и опухолями часто бывает нормоцитарная умеренно выраженная анемия. Анемия развивается обычно медленно в течение нескольких месяцев.
Ведущее значение в патогенезе анемии имеет нарушение использования двухвалентного железа костным мозгом. Кроме того, выявляется низкий уровень эритропоэтина. Это определяет образование в условиях дефицита железа эритроцитов, имеющих сниженную продолжительность жизни. Клиника заболевания проявляется синдромом анемии.
Диагностика
Типична умеренная нормоцитарная анемия с небольшой гипохромией, возможен микроцитоз на фоне хронического заболевания, гемоглобин 80–100 г/л. Сывороточное железо и общая железосвязывающая способность сыворотки обычно снижены в отличие от железодефицитной анемии. Средний эритроцитарный объем составляет 80 — 85 фл, средняя концентрация гемоглобина в эритроцитах 30–32 г/дцл. Насыщение трансферрина более 10%, уровень ферритина сыворотки нормальный, но, являясь белком острой фазы воспаления, может быть повышенным.
Лечение
Лечение направлено на коррекцию основного заболевания. Симптомы анемии обычно исчезают при эффективном лечении через 1 мес. Применение только препаратов железа неэффективно. В настоящее время исследуется действие эритропоэтина при онкологических и хронических воспалительных заболеваниях.
Сидеробластные (сидероахристические) анемии
Сидеробластные анемии — группа заболеваний, характеризующихся нарушением ферментных систем, участвующих в метаболизме железа в клетках эритроидного ряда. Железо поступает в эритробласты, где накапливается в околоядерных митохондриях, нарушается синтез гема. Образуется большое количество сидеробластов — незрелых ядросодержащих клеток костного мозга — предшественниц эритроцитов, в цитоплазме которых выявляются гранулы железа, расположенные диффузно или в виде колец вокруг ядра. Синтез гемоглобина нарушается, снижается среднее содержание гемоглобина в эритроците, появляются популяции гипохромных микроцитов.
Выделяют разные формы сидеробластных анемий:
- Наследственная форма является сцепленной с Х-хромосомной патологией, вызванной аномалией метаболизма пиридоксина (витамина В6) — недостаточностью эритроидной формы аминолевулинатсинтетазы.
- Приобретенная форма может быть вызвана лекарственными средствами (изониазидом, химиотерапевтическими средствами, алкоголем), интоксикацией свинцом, эндокринными или воспалительными заболеваниями.
- Существует также идиопатическая форма (рефрактерная сидеробластная анемия), причина которой неизвестна.
Клиника сидеробластной анемии у детей проявляется тяжелой гемолитической анемией, приводящей к вторичному гиперспленизму, увеличению запасов железа в организме и гемосидерозу. У больных старше 60 лет анемия может быть относительно тяжелой (гемоглобин 80-100 г/л).
Диагностика
При исследовании мазков крови находят диморфную популяцию эритроцитов (нормоцитарную и микроцитарную). При врожденных и идиопатических формах выявляют выраженный анизоцитоз и пойкилоцитоз. Средний эритроцитарный объем обычно нормальный, но может быть незначительно увеличенным. Как правило, наблюдается базофилия эритроцитов. Уровень сывороточного железа, ферритина и содержание трансферрина увеличены. В пунктате костного мозга наблюдается эритроидная гиперплазия. При окраске на железо видны аномальные кольцевидные сидеробласты.
Лечение
Всем пациентам назначают пробное лечение пиридоксином. Назначают прием внутрь пиридоксина в дозе 50–200 мг/сут или его внутримышечное введение по 100 мг 2 раза в неделю на протяжении 2 мес. Наиболее эффективно использование кофермента пиридоксаль фосфата, так как иногда блокируется возможность трансформации пиридоксина в пиридоксальфосфат. При наследственных формах лечение пиридоксином необходимо периодически повторять. Но витамин В6 эффективен только при наследственной форме.
При приобретенных формах необходимо прекратить прием изониазида, употребление алкоголя и исключить другие интоксикации. Андрогены иногда стимулируют продукцию эритроцитов. Многие больные трансфузионнозависимы. У 10% пациентов с приобретенной идиопатической анемией развивается острый лейкоз.
Для уменьшения гемосидероза органов и снижения концентрации сывороточного железа, ориентируясь на его содержание и присутствие сидеробластов в костном мозге, назначают дефероксамин (внутривенно по 500–1000 мг с перерывами).
Источник
