Норма крови при мно
Лабораторная диагностика множественной миеломы – анализыАнализ периферической крови показывает, у большинства больных с множественной миеломой, наличие анемии. Эта анемия, обычно умеренная, гипохромного типа может быть иногда сильно выраженной (менее 1 миллиона гематий/мм3). На мазке наблюдаются аспекты анизоцитоза и пойкилоцитоза. Гематии проявляют часто тенденцию располагаться в виде «монетных столбиков»,—явление, связанное с наличием миеломатозных протеинов в сыворотке и с их скоплением на поверхности гематий. Количество Гб также понижено. Число лейкоцитов, вариабильное, нормальное или повышенное. В развитых стадиях болезни можно наблюдать лейкопении, отягощаемые и применяемыми цитостатическими лечениями. Лейкоцитарная формула, обычно нехарактерная, может показывать иногда повышенное число плазмоцитарных элементов, подобных клеткам в костном мозге. Число тромбоцитов нормальное или умеренно пониженное. Исследование костного мозга при множественной миеломе имеет важнейшее значение для постановки диагноза. Костная пункция производится обычно в грудную кость или в подвздошный гребень, но ее можно производить и в другие затронутые кости: позвонки, пяточную кость, ключицу. Иногда проникание в кость происходит очень легко, костная ткань давая ощущение особой хрупкости. Для миеломы характерен численный рост плазмоцитарной серии, которая может составлять 90% клеточного населения костного мозга. Вообще, при 20% плазмоцитарных элементов ставится вопрос о существовании миеломы. Аномалийные плазмоцитарные элементы или так называемые «миеломатозные клетки», это клетки диаметром в 15—30(л, круглые или овальные. Ядро, диаметром в 5—7у., круглое, расположенное эксцентрично, содержит 1—2 нуклеоли. Нуклеарный хроматин менее комковатый и уже не представляет тот регулярный порядок, который наблюдается в нормальном плазмоците. Цитоплазма этих клеток интенсивно базофильная, становится яркосиней при окрашивании May-Grunwald-Giemsa (цветная вклейка III). В цитоплазме миеломатозных клеток можно встретить гиалиновые шарики (тела Russel), многочисленные вакуоли, придающие клетке вид ежевики (клетки Mott), или хрустальные азурофильные включения иногда подобные телам Auer при миелобластической лейкемии (протеиновые кристаллы) (цветная вклейка III). Вариабильное число клеток может иметь 3 или более ядер. Другие имеют сильно выраженные черты незрелости: они более крупных размеров (20—35u) с болыпдм, круглым ядром, с очень тонким хроматином, а цитоплазма интенсивно базофильная. Встречаются также и несколько зрелых плазмоцитарных клеток, с ядром в виде «колесной спицы » и ясной перинуклеарной зоной. Иногда плазмоциты могут иметь ацидофильную цитоплазму, так называемые «пламенистые клетки » (flaming cells) (цветная вклейка III). С цитохимической точки зрения, цитоплазма миеломатозных клеток является пероксидазо-отрицательной и окрашивается метахроматически с метиловой зеленью. Гиалиновые шарики (тела Russel) обычно PAS-положительные. Миеломатозные клетки преставляют множество нуклеоцитоплазматических асинхронизмов созревания. Согласно Bernier и Graham, степень этих асинхронизмов пропорциональна клиническому распространению заболевания.
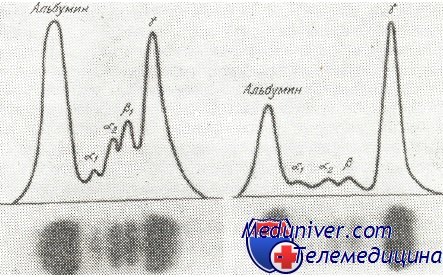
Исследования при помощи электронного микроскопа показали наличие определенных аномалий на уровне клеточных органитов, аномалии тем более явные, чем менее дифференцирована миеломатозная клетка. Митохондрии численно увеличены и имеют патологические аспекты: удлиненные, кольцевидные, иногда с чертами миелиновой дегенерации; аппарат Гольджи везикулярнио трансформирован, центриоли имеют гигантский удлиненный вид, а число рибозомов может возрастать (Bessis). Наиболее интересный аспект представляет эргастоплазмический аппарат. В большинстве случаев он расширен и имеет везикулярный вид. Содержимое эргастоплазмических везикул состоит из протеина и имеет твердую консистенцию, принимая аспект тел Russel, либо в растворимой форме, flaming cells или тезауроцотив (Paraskevas и сотр.), либо в кристаллизованной форме. Протеиновые кристаллы бирефрингентные с периодичностью около 110 A (Bessis). В других случаях эргатоплазмический аппарат менее развит и представлен несколькими пластинками, а редко бывает плохо развитым, подобным лимфоидной клетке. На уровне ядра появляются аномалийные, гипертрофированные нуклеоли, а также и множество интрануклеарных вакуолей (Smetena и сотр.). Некоторые авторы описали наличие в ядре вирусных телец, в 15% случаев (Sorensen), тельца, которые Bessis нашел лишь в одном из 12 изученных им случаев. Иммунохимические и иммунофлюоресцентные исследования, с разными специфическими антисыворотками (IgG, IgA, IgM, IgD IgE, ламбда, каппа) показали наличие Ig в цитоплазме миеломатозных клеток. Они локализированы в особенности на уровне эргастоплазмического аппарата и рибозомов. Делались попытки установить связь между морфологическим аспектом клеток и типом секретированного Ig. Полученные до настоящего времени результаты неубедительны. Paraskevas и сотр. утверждают, что пламенистые клетки секретируют IgA. Цитогенетическое исследование множественной миеломы показало существование разных форм анейплоидии, но которые наблюдаются не во всех случаях. Кроме этого кыло описано и присутствие различных хромозомов маркеров. Вследствие внедрения метода бандирования, Liang и Rowley нашли хромозом 14р+ у 3 больных с множественной миеломой и 1 больного с плазмоцитарной лейкемией, из 22 изученных больных. Этот хромозом 14q+ был найден и при других лимфомах типа Б, а также, изредка, и при лимфомах non-Б. Следует отметить, что Croce и сотрудники установили, что структуральные гены для тяжелых цепей Ig локализированы у человека на хромозоме 14. Исследование протеинового обмена при множественной миеломе. Расстройства протеинового метаболизма составляют характерный аспект множественной миеломы. Злокачественно модифицированные плазмоциты сохраняют и усиливают способность синтетизировать цельные Ig или только определенные составные части глобулиновой молекулы. Изменения протеинового метаболизма проявляются в трех формах: В сыворотке большинства больных, общее количество протеинов повышено, достигая 23 г/100 мл. Среднее количество сывороточных протеинов у больных с миеломой равняется 9 г/100 мл. Этот рост происходит за счет глобулинов, точнее Ig. При электрофорезе на бумаге или в агаре наблюдается появление узкой и высокой полосы, с заметным сокращением остальных дуг. Это является изображением количественного роста гомогенного населения глобулинов. Пик находится обычно в зоне миграции у-глобулинов или b-глобулинов. Аномалийный протеин, находящийся в сыворотке больных с миеломой, получил название парапротеина, миеломатозного глобулина (М-глобулин) или компонента М. В рамках множественной миеломы может происходить: В настоящее время миеломы делятся по типу секретируемого Ig: миеломы IgG наиболее частые, встречающиеся в 60% случаев; миеломы IgA, в 20—25% случаев; IgD, в 2,1% случаев; и ограниченное число миелом IgE. Среди случаев множественной миеломы, 20% — с цепями L (миеломы Бенс-Джонса), причем некоторые без патологического протеина в сыворотке, так как он элиминируется через мочу. Очень малый процент заболеваний (1%) не представляет изменений протеинового метаболизма (несекретирующие миеломы). В рамках миелом IgG, наблюдается следующее распределение на субклассы (Schur): yG1 60—82%; yG2 10—18%; yG3 6—15%; yG4 1—8%. Сравнивая эти цифры с относительными концентрациями в нормальной сыворотке (гл. 7) можно утверждать, что моноклональные Ig типа yGl и yG3 встречаются чаще по сравнению с yG2. Характерной чертой миеломатозного Ig является его гомогенность: узкая зона электрофоретической миграции, индивидуальная антигенная специфичность и цепь L только одного типа (ламбда или каппа). При миеломах IgG и IgA преобладают случаи с цепями каппа (2/3 случаев) (Hobbs и Corbet); при миеломах IgD, цепи ламбда преобладают в 90% случаев, в то время как при миеломах Бенс-Джонса, цепи ламбда присутствуют приблизительно в 45% случаев (Jancelewicz и сотр.). До сих пор не удалось выявить физико-химические или иммунохимические различия между миеломатозными протеинами и соответствующими им нормальными Ig. Было доказано, что миеломатозные Ig обладают способностью связываться с другими веществами, следовательно действовать как антитела. Такая антителовая деятельность отмечалась по отношению к бактериальным соединениям (стрептолизин 0 или спрептококковая гиалу-ронидаза), к гематиям, к некоторым сывороточным протеинам, а также и к гаптенам (динитрофенол, 5-ацетоурацил, пуриновые и пиримидиновые нуклеотиды) (Osterland и сотр.). Способность миеломатозного протеина связываться с гематиями или сывороточными протеинами порождает определенные симптомы, как например агглютинация гематий в виде монетных столбиков, явления повышенной кровоточивости и пр. Значительная диспротеинемия в крови больных с множественной миеломой оказывает влияние на все пробы коллоидальной лабильности.
Реакции на формол-гелифицирование, сульфат кадмия, Вельтмана — положительные. Реакция Sia (помутнение сыворотки в дистилированной воде) — слабо или умеренно положительная. Тесты на коагуляцию модифицированы у некоторых больных. Патологические протеины в сыворотке могут интерферировать с различными фазами коагуляции, как например в трансформация фибриногена в фибрин, во взаимодействии с факторами II, V и VII. Функции тромбоцитов могут быть также модифицированными. Анализ мочи показывает наличие протеина Бенс-Джонса в 40—50% случаев, когда он детерминируется путем нагревания и в 61% случаев, когда он выявляется путем иммуноэлектрофореза. Он представлен выведением легких цепей. Протеин Бенс-Джонса преципитирует в моче нагретой до 50—60°, создавая беловатое облако, которое перерастворяется при кипячении. В случае ассоциированной альбуминурии, перерастворение является неполным и иногда оказывается неполным и без альбуминурии. В такой ситуации мочу можно сделать прозрачной путем добавления нескольких капель 5%-й уксусной кислоты. Физикохимическое исследование альбумина Бенс-Джонса показало, что он состоит из легких цепей, димеризованных дисульфидными связями. Постоянно легкая цепь в моче идентична с легкой цепью сывороточного миеломатозного протеина. В мочевом осадке могут появляться цилиндры, гематии, а в случаях почечного калкулеза появляются кристаллы фосфатов, уратов, а также гематии и лейкоциты. Гиперкальцемия встречается часто при множественной мизломе (20—53% случаев), достигая 12—16 мг/100 мл сыворотки. Этот рост связан в первую очередь с процессами костной деструкции, но и с гиперпаратиреоидизмом, как вторичное явление почечной недостаточности. Гиперкальцемия при множественной миеломе не сопровождается ростом фосфора в крови, а щелочные сывороточные фосфатазы находятся в нормальных пределах, что представляет ценные данные для дифференциальной диагностики по отношению к первичному гиперпаратиреоидизму. Сывороточная мочевая кислота бывает часто повышена, а в случаях, осложняющихся почечной недостаточностью, наблюдается рост креатинина и непротеинового азота. Патологоанатомическое исследование при множественной миеломе. Наиболее явные изменения встречаются на уровне скелета, особенно в черепных костях, позвонках, ключицах, ребрах, грудной кости, лопатке, тазовых костях. Длинные кости затронуты в меньшей мере. На срезе, кость оказывается мягкой, а нормальная ткань заменяется красноватой или серо-красноватой туморальной тканью. Иногда опухоль переходит за периост, инфильтрируя смежные участки.
Микроскопически, туморальная ткань состоит из пролиферации злокачественных плазмоцитоидных клеток, описанных при исследовании костного мозга. На срезе остеокласты и остеобласты немодифицированы. В редких случаях внекостных миелом можно обнаруживать плазмоцитарные опухоли в различных органах, причем характерные особенности пролиферированных клеток подобны тем, которые наблюдаются при костных опухолях. При множественной миеломе почка бывает часто затронута. Наиболее важные поражения встречаются на уровне канальцев. Дистальные канальцы расширены, с уплощенным эпителием и просветами заполненными эозинофильными и полихроматофильными цилиндрами. На периферии этих цилиндров встречаются многоядерные синцитин эпителиальных клеток. Цилиндры состоят из цельного миеломатозного Ig или из цепей L (протеин Бенс-Джонса). На электронном микроскопе, эти цилиндры имеют фибрилярную, амилоидную структуру (Abrahams и сотр.). Не удалось установить несомненную связь между наличием амилоида и протеинурией Бенс-Джонса. Несмотря на это, Glenner и сотр. показали in vitro образование амилоидных волокон путем протеолитической дигестии человеческого протеина Бенс-Джонса. Возможно, что подобный процесс происходит и на уровне почечных канальцев (Zlotnick). В тубулярных эпителиальных клетках часто встречаются отложения кальция. Также на уровне почечных канальцев было отмечено наличие кристаллов, находящихся как в просвете, так и в эпителии. Их химическая структура не была установлена. Почечные гломерулы бывают реже затронутыми при множественной миеломе. Отмечается утолщение базальной мембраны и мезангиомы, которое выступает с особенной ясностью на электронном микроскопе. Встречается также и гипертрофия эндотелиальных и эпителиальных клеток. В развитых фазах болезни появляются гиалиноз и склероз. Иногда в гломерулах можно найти отложения амилоида, что приводит к его гомогенизации. Почечная интерстициальная ткань представляет инфильтрационные поражения, либо благодаря миеломатозным клеткам, либо благодаря клеткам хронического воспаления. – Также рекомендуем “Клинические формы множественной миеломы – стадии” Оглавление темы “Миеломная болезнь”:
|
Диагностические критерии множественной миеломы (ММ) (Durie B.G.M., Kyle R.A. et al., 2003), (требуется наличие всех трех):
1. Моноклональные плазматические клетки в аспирате костного мозга (КМ) >10% или наличие доказанной при биопсии плазмоцитомы.
2. Присутствие моноклонального белка в сыворотке или моче. Если моноклональный белок не выявляется (несекретирующая миелома), для диагноза требуется наличие > 30% плазматических клеток в аспирате КМ и/или наличие плазмоцитомы.
3. Связанные с миеломой органные дисфункции (1 или более):
– гиперкальциемия >10,5 мг/л или верхняя граница нормы;
– почечная недостаточность с уровнем креатинина в сыворотке крови >20 мг/л;
– анемия с уровнем гемоглобина менее 100 г/л или на 20 г/л ниже нормы;
– литические поражения костей или остеопороз (если у пациента диффузный остеопороз без очагов остеодеструкций или солитарная плазмоцитома, то для постановки диагноза требуется >30% плазматических клеток в аспирате костного мозга).
Миелома Бенс-Джонса не относится к редким формам ММ, но ее клиническая картина и лабораторные признаки имеют некоторые особенности. Заболевание характеризуется отсутствием М-градиента в сыворотке крови и наличием белка Бенс-Джонса в моче.
В связи с отсутствием парапротеина в сыворотке крови отмечается нормальное содержание сывороточного белка и отсутствие симптомов, обусловленных гиперпротеинемией. В подобных случаях выполнение иммунохимического анализа мочи следует считать обязательным диагностическим исследованием.
Диагностические критерии солитарной плазмоцитомы
Солитарная плазмоцитома – редкий тип плазмоклеточной пролиферации, частота ее не превышает 5%. Может быть разделена на 2 группы: солитарная плазмоцитома кости и экстрамедулярная плазмоцитома. Их объединяет отсутствие поражения костного мозга, продукция парапротеина в сыворотке и моче отсутствует, либо его количество незначительно; отсутствие дисфункции органов, ассоциированных с миеломой, прежде всего, анемии, гиперкальциемии, почечной недостаточности, несмотря на очевидные морфологические доказательства наличия плазмоклеточной опухоли.
Диагноз солитарных плазмоклеточных опухолей должен быть доказан морфологически.
Диагностические критерии тлеющей или индолентной (вялотекущей) миеломы (требуются все три критерия):
1. Моноклональный протеин присутствует в сыворотке и/или моче. Содержание моноклонального парапротеина: IgG >35 г/л, IgA >20 г/л, белок Бенс-Джонса >1,0 г/24 часа.
2. Моноклональные плазматические клетки присутствуют в КМ и/или выявляются при биопсии ткани
3. Отсутствие костных поражений или ограниченные костные поражения (
– общее состояние (performance status) >70%,
– гемоглобин >100 г/л,
– сывороточный кальций – в норме,
– сывороточный креатинин
– отсутствие инфекций.
Эту форму ММ отличает медленно прогрессирующее течение, при этом даже без лечения не наблюдается существенного увеличения массы опухоли в течение многих месяцев. Основная причина данной особенности заболевания заключается в низкой пролиферативной активности опухоли, подтвержденной с помощью оценки пролиферативного индекса плазматических клеток. Данная форма множественной миеломы встречается у 1,7-4% пациентов.
Диагностические критерии моноклоновых гаммапатий неопределенного генеза (МГНГ):
1) уровень парапротеина: IgG в крови
2)
3) отсутствие костных поражений и других симптомов, связанных с болезнью, прежде всего анемии, гиперкальциемии, почечной недостаточности,
4) отсутствие клинических и лабораторных признаков амилоидоза или болезни отложения легких цепей Ig.
Чтобы окончательно дифференцировать моноклональную гаммапатию неопределенного генеза и IA стадию миеломной болезни, следует прибегнуть к динамическому наблюдению (не меньше одного года) с регулярным измерением содержания парапротеина.
Как показали многочисленные продолжительные исследования, риск трансформации МГНГ в миелому с наличным парапротеином через 10 лет составляет 15-20%, а через 20-25 лет – 30-40%: при этом риск трансформации коррелирует с содержанием парапротеина у впервые выявленного пациента с моноклоновой гаммапатией неопределенного генеза. В целом, около 1/4 пациентов с МГНГ в будущем болеют активной миеломой, макроглобулинемией, амилоидозом.
Факторы риска перехода моноклоновой гаммапатии неопределенного генеза в ММ:
1) М-протеин >15 г/л или IgM- или IgA- гаммапатия;
2) при патологическом каппа/лямбда соотношении легких цепей Ig в плазме риск увеличивается в 3 раза.
Следует помнить, что секреция парапротеина, кроме плазмоклеточных опухолей (ММ, солитарная и экстрамедуллярная плазмоцитома, макроглобулинемия Вальденстрема), нередко встречается при других состояниях: лимфопролиферативных процессах (хроническом лимфолейкозе, неходжкинских лимфомах), системных заболеваниях соединительной ткани, первичном амилоидозе, раковых опухолях (толстой кишки, легких, простаты), хронических гепатиах и циррозах печени, саркоидозе, болезни Гоше, синдроме Шегрена.
Вариантные формы множественной миеломы
Несекретирующая множественная миелома наблюдается у 1% пациентов и характеризуется отсутствием М-протеина в сыворотке крови и моче. Диагноз устанавливается на основании выявления >30% плазматических клеток в КМ, обнаружении поражения органовмишеней, секреции моноклонального Ig в плазматических клетках методом иммунофлюоресценции. У пациентов с этой формой заболевания более чем в 60% случаев выявляется гипогаммаглобулинемия. Прогноз заболевания и принципы врачебной тактики при этой форме ММ не отличаются от общей группы.
Остеосклеротическая форма ММ, когда при рентгенографическом исследовании костей выявляются очаги остеосклероза, встречается крайне редко. Остеолитические поражения костной ткани у пациентов с множественной миеломой могут сочетаться с очагами остеосклероза, отражающего процессы репарации костной ткани. В этом случае можно говорить о смешанном (остеолитическом и остеосклеротическом) типе поражения.
Особенностью клинических проявлений у пациентов с остеосклеротической формой ММ является более частое развитие сенсомоторной полинейропатии, которая встречается у 30-50% пациентов. При классической ММ полинейропатия наблюдается только у 1-8% пациентов, хотя на фоне проводимого лечения с использованием программы VAD, препаратов велкейд, леналидомид, талидомид частота выявления нейропатии может увеличиваться.
Изолированный остеосклеротический тип поражения костной ткани в 47% случаев встречается при так называемом POEMS-синдроме. Акроним POEMS составлен из первых букв следующих синдромов: полинейропатия (polyneuropathy), органомегалия (organomegaly) или лимфаденопатия, эндокринопатия (endocrinopathy), М-протеин (M-protein) и/или плазмоклеточная дискразия, изменения кожи (skin changes). Причина возникновения POEMS-синдрома неясна.
Только у 5-20% пациентов с POEMS-синдромом количество плазматических клеток в костном мозге превышает 10%, что указывает на то, что генез данного заболевания далеко не всегда связан с ММ.
Показатель общей 20-летней выживаемости пациентов составляет 50%. Считается, что множественная миелома у пациентов с POEMS-синдромом протекает благоприятно и не является причиной смерти пациентов. Химиотерапия при данном заболевании, как правило, не проводится. При болях в костях может использоваться локальная лучевая терапия.
В 2003 году в клинике Мейо были разработаны диагностические критерии POEMS-синдрома (таблица 3).
Таблица 3. Диагностические критерии POEMS-синдрома

Для постановки диагноза необходимо наличие у пациента 2-х больших критериев и одного малого.
Редкая форма ММ – биклональная ММ, при которой выявляется 2 клона плазматических клеток, секретирующих 2 типа белка (например, IgG-к и IgG-X, IgA-к и IgG-к). Причины возникновения биклональной миеломы окончательно не установлены. Считается, что в основе биклональной множественной миеломы лежит возникновение мутаций в области генов, ответственных за синтез Ig на разных этапах созревания В-лимфоцита, а также возникновение второго клона патологических плазматических клеток в рамках опухолевой прогрессии заболевания.
Термин «плазмoклеточный лейкоз» используется в том случае, когда абсолюттое количество плазматических клеток в крови превышает 2х109/л или относительное содержание плазматических клеток в крови превышает 20%. Плазмoклеточный лейкоз может быть первичным (de novo), когда диагноз устанавливается в лейкемической фазе заболевания, или вторичным (secondary), когда ММ подвергается лейкемической трансформации.
Первичный плазмoклеточный лейкоз встречается менее чем у 5% пациентов с ММ. Эти пациенты имеют большую опухолевую массу и более высокую частоту экстрамедуллярных поражений. Развитие плазмoклеточного лейкоза сопровождается более частым развитием тяжелой тромбоцитопении с геморрагическим синдромом, глубокой анемией, более высоким уровнем лактатдегидрогеназы (ЛДГ) и в2-микроглобулина в сыворотке крови.
Для пациентов с плазмоклеточным лейкозом характерны моносомии 13 хромосомы и гиподиплоидия. Прогноз заболевания плохой. При проведении полихимиотерапии общая выживаемость пациентов с плазмoклеточным лейкозом de novo составляет 8 месяцев, а пациентов с вторичным плазмoклеточным лейкозом – 2 месяца.
Таким образом, при постановке диагноза «множественная миелома» дифференциальный диагноз проводится с другими злокачественными и доброкачественными моноклоновыми гаммапатиями, солитарной плазмоцитомой, тлеющей (индолентной) миеломой, опухолями с метастазами в кости, заболеваниями, сопровождающимися выраженным остеопорозом.
План обследования при миеломной болезни может включать не только диагностические и стадийные процедуры, но и исследования, направленные на установление прогностической группы риска, которая может влиять на выбор лечения.
Е.В. Зуховицкая, А.Т. Фиясь
Опубликовал Константин Моканов


