Нормы крови у мышей
Домашние мыши, как и любые другие домашние животные, страдают от многих недугов. И поставить диагноз только на основе визуального осмотра удается далеко не всегда.
На помощь ветврачам приходят современные диагностические методы, в том числе анализы.
Их назначают при подозрениях на практически любую болезнь, так как отклонения от нормы наглядно демонстрируют наличие патологий.
Ветеринарная лаборатория
В нашей ветбольнице работает современная лаборатория, в которой мы выполняем все виды анализов на высокоточном оборудовании и в короткие сроки.
Для перевозки биоматериала используется специальный транспорт и строго соблюдаются правила транспортировки, поэтому погрешность в результатах сводится к минимуму.
Биохимическое исследование крови
Если ветдоктор заподозрил у мыши заболевание желчного пузыря, печени, почек и других внутренних органов, а также скрытые воспалительные процессы или нехватку в организме важных микроэлементов, назначается это обследование.
В крови оценивают уровень билирубина, белка, эритроцитов, холестерина и других показателей. Их сверка с нормой помогает выявить отклонения и поставить диагноз.
У мышей кровь могут брать из:
- височной вены,
- ретроорбитального синуса,
- подкожных вен конечности,
- кончика хвоста после удаления,
- литеральной хвостовой вены.
Забор крови у мыши может выполнить только ветдоктор, поэтому рекомендуем не ставить экспериментов над животным, а обратиться к профессионалам.
Клинический анализ крови
Еще одно базовое исследование, направленное на поиск в организме опасных болезней и воспалений.
Кровь подвергают проверке на уровень глюкозы, эритроцитов, холестерина, билирубина и многих других показателей.
Результаты сверяют с нормой, что позволяет ветдоктору найти воспаления и патологии и диагностировать заболевания большинства внутренних органов.
Биохимия необходима для назначения лекарственных препаратов и отслеживания эффективности используемого ранее лечения.
Брать кровь на биохимию у мышей можно из височной вены, ретроорбитального синуса, подкожных вен конечностей и других участков, но под силу это только опытному ветврачу.
Клинический анализ крови
Это важнейшее исследование, при котором в крови оценивают уровень лейкоцитов, тромбоцитов, нейтрофилов, СОЭ, гемоглобина и многих других важных показателей.
Возможно проведение общего или расширенного анализа, а также изучение конкретных параметров.
По результатам принимается решение о необходимости дополнительных обследований, а также выборе или изменении тактики лечения.
Забор крови у мышей – задача сложная, поэтому не стоит проводить эксперименты над грызуном, а лучше довериться профессионалу.
Клинический анализ мочи с микроскопией осадка
Анализ мочи назначают при патологиях мочеполовой системы, а также при подозрениях на скрытые заболевания и инфекции, развивающиеся без симптомов.
Обследование урины также помогает понять, как протекает болезнь, как действует выбранное лечение.
В первую очередь, мочу обследуют на уровень билирубина, глюкозы, белка и ряда других показателей.
Также производят оценку на наличие крови, бактерий, кристаллов и других включений, которые могут сообщить о наличии заболевания в организме.
Точный результат даст анализ только утренней мочи, привезенной в лабораторию не позже, чем через два часа после сбора.
Анализ кала
Это обследование назначают при подозрениях на болезни желудочно-кишечного тракта.
Также мыши нередко страдают от заболеваний желчного пузыря, печени, поджелудочной, от инфекционных и паразитарных недугов.
Результаты анализа помогут подтвердить или опровергнуть диагноз, подобрать лечение или скорректировать его.
Для обследования необходим кал, собранный утром в чистую емкость и доставленный в ветбольницу в этот же день.
Микроскопическая диагностика инфекционных заболеваний
Если у ветврача возникло подозрение на поражение организма мыши инфекцией, вызванной простейшими микроорганизмами.
С помощью этого метода удается обнаружить заболевание, установить вид микроорганизмов и их количество.
После подтверждения диагноза принимается решение о лечении животного теми или иными препаратами.
Материал, подходящий для исследования: мокрота, мазки со слизистых рта и носа, кровь, моча, кал.
Гистология и цитология
Это обследования, направленные на изучение тканей организма и поиск доброкачественных и злокачественных образований.
Специалист производит забор участка ткани и внимательно исследует его под микроскопом. Для более детального изучения выполняется обследование на клеточном уровне.
Гистология и цитология помогают установить характер онкологии, способность к метастазам и рецидивам.
Также изучают скапливающиеся в организме жидкости, берут на анализ ткани печени и легких. Забор материала может производиться специальной иглой или же хирургическим путем.
Мазки на кровепаразитов
Этот анализ необходим для диагностики болезней, вызванных паразитами, проникшими в кровь животного.
Особо опасным считается пироплазмоз, поэтому его важно обнаружить как можно быстрее и принять меры.
Кровь обследуют под микроскопом, и если мышь больна, паразиты будут обнаружены в эритроцитах.
Анализы животных на дому
Наша ветклиника предлагает воспользоваться услугой сбора анализов в домашних условиях.
Наш ветдоктор готов выехать по Москве и Подмосковью 24 часа в сутки, чтобы оказать квалифицированную помощь и взять материал для обследования.
Вы сэкономите свое время на дороге до клиники, а ваш любимец останется рядом с вами там, где ему все хорошо знакомо. Так он испытает меньший стресс, чем при посещении ветбольницы.
Сколько проводится исследование анализов
Результаты анализов сообщаются лечащему ветдоктору и хозяину в течение 1-2 суток.
Дополнительно проводятся экспресс-анализы, которые позволяют получить результат уже через 1-2 часа.
Это необходимо в случае тяжелых патологий, травм и болезней, лечение которых не требует отлагательств.
| Цены на услуги в нашей клинике | В клинике и на дому |
| Выезд ратолога на дом | от 500 |
| Клинический осмотр, постановка предварительного диагноза, консультация | от 500 |
| Консультация по телефону | бесплатно |
| Терапия | от 150 |
| Хирургия | от 150 |
| Скорая помощь на дом (в течение часа) | от 1000 |
| Цены на услуги в нашей клинике | В клинике и на дому |
| Подкожное введение лекарства грызунам | от 150 |
| Внутримышечное введение лекарства грызунам | от 200 |
| Внутривенное (в катетер, через иглу) | от 200 |
| Капельница для грызунов | от 1000 |
| Постановка внутривенного катетера | от 300 |
| Снятие внутривенного катетера | 200 |
| Зондовое питание грызунов | от 300 |
| Взятие проб крови | от 300 |
| Новокаиновая блокада | от 200 |
| Вправление защечного мешка | от 200 |
| Стрижка | |
| Стрижка когтей | от 300 |
| Стрижка колтунов | от 1000 |
| Обработка ушных раковин | от 300 |
| Цены на услуги в нашей клинике | В клинике и на дому |
| Хирургия | |
| Хирургия мочеполовых органов у грызунов: | |
| Кастрация | от 2000 |
| Стерилизация | от 2500 |
| Хирургические процедуры | от 400 |
| Хирургическая обработка ран | от 300 |
| Наложение кожно-мышечных швов | от 200 |
| Наложение бинтовой повязки | от 100 |
| Наложение гипсовой повязки | от 1000 |
| Снятие гипсовой повязки | от 300 |
| Хирургия инфекций кожи, мягких тканей и опухолей | |
| Вскрытие абсцессов, гематом | от 400 |
| Обработка гнойных ран | от 700 |
| Установка дренажа | от 500 |
| Промывание дренажа | 350 |
| Лечение гематомы ушной раковины | от 1500 |
| Унилатеральная мастэктомия | от 4000 |
| Регионарная мастэктомия | от 5000 |
| Удаление новообразований | от 2000 |
| Абдоминальная хирургия | |
| Родовспоможение у грызунов | от 1000 |
| Ранимация новорожденных | от 300 |
| Кесарево сечение | от 3000 |
| Пиометра | от 1500 |
| Цены на услуги в нашей клинике | В клинике и на дому |
| Наркоз | от 500 |
| Цены на услуги в нашей клинике | В клинике и на дому |
| Пластика век при завороте, вывороте | от 2000 |
| Экзентерация глазного яблока | от 3000 |
| Цены на услуги в нашей клинике | В клинике и на дому |
| Удаление резцов | от 500 |
| Подрезка и коррекция зубов у грызунов | от 1500 |
| Цены на услуги в нашей клинике | В клинике и на дому |
| Анализ крови: | |
| Общеклинический анализ крови | 900 |
| Цитология крови | 1000 |
| Биохимический анализ по 1 выборочному показателю | 300 |
| Биохимический анализ крови по 6 показателям | 1500 |
| Биохимический анализ крови по 12 показателям | 2500 |
| Дополнительные биохимические показатели на панкреатическая амилаза, ревматоидный фактор, с-реактивный белок | от 300 |
| Анализ мочи: | |
| Общеклинический анализ мочи | 400 |
| Экспресс анализ мочи на глюкозу | 200 |
| Экспресс анализ мочи | 300 |
| Биохимия мочи 1 показатель | 100 |
| Исследования кала | |
| Общий анализ кала | 500 |
| Посев кала на патогенов | 1500 |
| Анализ кала на дисбактериоз | 2000 |
| Анализ кала на простейшие и яйца гельминтов | 500 |
| Бактериология | |
| Бактериологический скрининг | 2000 |
| Микробиологический скрининг | 2000 |
| Полный микробиологический скрининг (без подтитровки) | 1500 |
| Исследования кожного покрова | |
| Биопсия кожи | 1700 |
| Мазок-отпечаток с кожи | 1000 |
| Дерматофиты и эктопаразиты | 1000 |
| Патоморфология | 1500 |
| Гистология новообразований, кистозного содержимого | 2000 |
| Цитология новообразований, кистозного содержимого | 1500 |
| Цены на услуги в нашей клинике | В клинике и на дому |
| Ветритуал | |
| Усыпление грызунов | 1000 |
| Кремация грызунов | 1000 |
| Индивидуальная кремация грызунов | от 3500 |
| Вскрытие грызунов | 2000-5000 |
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Ажикова А.К.
1
Журавлева Г.Ф.
2
1 ГБОУ ВПО «Астраханский Государственный медицинский университет»
2 ФГОУ ВПО «Астраханский государственный университет»
Впервые изучено влияние лекарственных форм различной консистенции на количественные изменения периферической крови крыс в условиях искусственной ожоговой травмы. Любой патологический процесс может отразиться на количественных и качественных особенностях состава циркулирующей крови. Этим и определяется огромное значение необходимости изучения крови в условиях гипертермии и выявления закономерностей изменений различных показателей. Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения. Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов. Полученные данные расширяют и углубляют представления о характере интоксикации организма в условиях стрессового воздействия различных факторов.
показатели периферической крови
кроветворные органы
ожоговые поражения кожи
термическое воздействие
гипертермия
1. Ажикова А. К. Использование пуповинной крови для восстановления кожи после термической травмы / А. К. Ажикова, М. В. Лазько // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2008. – №.4. – С. 53-57.
2. Грушко М. П. Состояние периферической крови у карповых рыб в нерестовый период / М. П. Грушко, Н. Н. Федорова // Актуальные проблемы современной науки. – Технические науки: Труды 2-го Международного форума. – Самара, 2006. – С.23-25.
3. Земков Г. В. Характер и степень патологических изменений в крови и внутренних органах судака / Г. В. Земков, Г. Ф. Журавлева // Материалы VIII конф. по экологической физиологии и биохимии рыб. – Петрозаводск, 1992. – С. 40.
4. Лазько А. Е. Состояние мембран эритроцитов при воздействии серосодержащего газа / А. Е. Лазько, Р. И. Асфандияров, А. А. Резаев // Актуальные вопросы медицинской фармакологии. – 1993. – С.41-47.
5. Мамонтова Е. В. Влияние ALPHA-токоферола на степень перекисного гемолиза белых мышей в норме и при иммобилизационном стрессе / Е. В. Мамонтова // Современные проблемы науки и образования. – 2006. – № 3. – С. 27-28.
6. Островский В. К. Показатели крови и лейкоцитарного индекса интоксикации в оценке тяжести и определении прогноза при воспалительных, гнойных и гнойно-деструктивных заболеваниях / В. К. Островский, А. В. Мащенко, Д. В. Янголенко, С. В. Макаров // Клин. лаб. диагностика. – 2006. – № 6. – С. 50-53.
7. Покровский А. А. Методика определения перекисного гемолиза эритроцитов / А. А. Покровский, А. А. Абразцов // Вопросы питания. – М.: Наука, 1964. – № 6. – С.44.
8. Рожкова И. С. Влияние хронической интоксикации на свободнорадикальные процессы плазмы крови крыс / И. С. Рожкова, Д. Л. Теплый, Б. В. Фельдман // Научный руководитель. – 2015. – № 3(10). – С. 1-7.
9. Теплый Д. Л. Особенности морфологической картины сыворотки крови мышей разных возрастных групп при экспериментальном стрессе / Д. Л. Теплый, Н. А. Аюпова // Естественные науки: Журнал фундаментальных и прикладных исследований. – 2005. – №.10. – С. 47-50.
10. Ясенявская А. Л. Влияние антиоксидантов на уровень перекисного гемолиза эритроцитов старых крыс в норме и при иммобилизационном стрессе / А. Л. Ясенявская, Н. В. Кобзева // Современные наукоемкие технологии. – 2006. – № 2. – С. 69-70.
В медицинской биотехнологии постановка экспериментов при помощи моделирования патологических состояний, например ожогового повреждения кожи, имеет огромное значение для глубокого исследования крови и кроветворных органов [3]. Исходя из этого, необходимо тщательное и всестороннее изучение всех изменений, которые происходят в организме при этих воздействиях. Главным образом это относится к системам поддержания гомеостаза [2].
Ожоговые поражения кожи стали в современном мире одним из наиболее социально значимых и распространенных типов травматических повреждений у человека. Изучению вопроса реакции клеток крови на ожоги посвящен ряд исследований [1, 8].
Любое заболевание, патологический процесс, а также ряд физиологических сдвигов могут в той или иной степени отразиться на количественных и качественных особенностях состава циркулирующей крови [5]. Этим и определяется огромное значение необходимости изучения крови. Белые клетки крови, имея высокую реактивность, быстро включаются в адаптационные реакции. Они способны к неспецифическому реагированию в ответ на альтерирующие воздействия.
Термическая травма сопровождается развитием интоксикации. Кровь в первую очередь подвергается действию токсических веществ, возникших в очаге поражения [1].
Свой вклад в общее состояние системы организма вносят компоненты крови. Наиболее уязвимым объектом для действия продуктов свободнорадикального окисления липидов является стенка кровеносных сосудов, что обусловлено высоким уровнем кислорода в крови и низким уровнем его утилизации [9]. В условиях патологического процесса происходит поражение неклеточного компонента сосудистой стенки.
Цель исследования – изучение показателей периферической крови половозрелых крыс в норме и в условиях термического воздействия.
Материалы и методы. Объектом исследования явились 50 беспородных крыс-самцов 4-месячного возраста. Во время эксперимента регистрировали общее состояние и поведение животных. Самцы крыс были разделены на пять групп по типу воздействия:
I группа – животные, не подвергшиеся ожоговому воздействию (контрольная, 10 шт.);
II группа – животные, получившие ожоговое воздействие и не подвергшиеся терапии (10 шт.). Раны регенерировали естественным путем;
III группа – животные, получившие ожоговое воздействие и подвергшиеся терапии спреем «Д-Пантенол» (10 шт.);
IV группа – животные, получившие ожоговое воздействие и подвергшиеся терапии бальзамом мазевой формы «Спасатель» (10 шт.);
V группа – животные, получившие ожоговое воздействие и подвергшиеся терапии аппликациями настойки календулы (10 шт.).
Исследование морфологических и биохимических показателей периферической крови заключалось в определении количества лейкоцитов, количества эритроцитов, лейкоцитарной формулы, уровня гемоглобина, перекисной резистентности эритроцитов.
Уровень гемоглобина в образцах крови крыс определяли электрофотометрическим способом на гемоглобинометре APEL Hemoglobinmeter HG-202. Мазки фиксировали и окрашивали по Романовскому – Гимзе. Идентификация форменных элементов крови проводилась согласно методике Н. Т. Ивановой [4]. Количество эритроцитов крови подсчитывали по стандартной методике в камере Горяева. Количество лейкоцитов считали по мазкам крови крыс.
Для оценки уровня свободнорадикального окисления и выраженности в связи с этим липолитических процессов в крови проводили измерение перекисной резистентности эритроцитов. Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про– и антиоксидантный баланс организма [6].
Для определения перекисного гемолиза эритроцитов использовали модификацию методов определения степени перекисного гемолиза эритроцитов (ПГЭ) А. А. Покровского и А. А. Абразцова [7], которую предложили А. Е. Лазько, Р. И. Асфандияров и А. А. Резаев [4].
Результаты исследования и их обсуждение. Анализ гематологических исследований экспериментальных животных показал, что наиболее высокий уровень гемоглобина периферической крови наблюдался у крыс, лечившихся бальзамом «Спасатель» и спреем «Д-пантенол», что наглядно отображено в таблице 1. В группе крыс, лечившихся настойкой календулы, данный показатель незначительно отличался от значений у обожженных животных, не получавших лечения.
Таблица 1
Гематологические показатели через 3 суток после ожоговой травмы
Тип воздействия | Эритроциты (шт./мкл.) | Гемоглобин (г/л) |
1 -Контроль | 7,8х106 | 27,7 |
2-Ожог | 6,5 х106* | 25,6* |
3-Ожог+аппликации мазью «Д-пантенол» | 8,2х106 * | 29,2 * |
4-Ожог+аппликации бальзамом «Спасатель» | 8,3х106* | 28,3* |
5-Ожог+аппликации настойкой календулы | 6,8х106* | 25,7* |
Примечание: * – Р<0,05 по сравнению с контролем.
Изменение уровня гемоглобина в результате опыта отмечено в таблице 1. Высокий уровень гемоглобина наблюдался у крыс, лечившихся Д-пантенолом. Средний показатель уровня гемоглобина отмечен у крыс, леченных бальзамом «Спасатель». В экспериментальной группе с настойкой календулы он незначительно и статистически недостоверно отличался от значений у животных 3 группы.
Выявлено, что термический ожог кожи вызвал уменьшение количества эритроцитов периферической крови крыс. Установлено, что при лечении ожогов этот показатель несколько увеличивался, например, при терапии бальзамом «Спасатель» и спреем «Д-пантенол».
Перекисный гемолиз эритроцитов является чувствительным показателем, отражающим про- и антиоксидантный баланс организма [10].
По данным табл. 2 показано, что не леченный термический ожог межлопаточной области спины крыс способствует наиболее полному перекисному гемолизу эритроцитов крови крыс (степень гемолиза, в среднем, 7 %, p<0,001). Лечение ожогов кожи бальзамом «Спасатель» вызывает средний гемолиз (степень гемолиза в среднем 3,94 %, р<0,05), при терапии ожоговых травм межлопаточной области спины крыс спреем Д-пантенолом наблюдался частичный гемолиз (степень гемолиза в среднем и 3,62 %, Р<0,05).
Таблица 2
Перекисная резистентность эритроцитов самцов крыс (% гемолизированных эритроцитов)
Группа | Количество животных | М+m |
1 -Контроль | 10 | 3,82+0,121* |
2 -Ожог | 10 | 6,83+0,469 *** ### |
3 -Ожог+аппликации мазью «Д-пантенол» | 10 | 3,62+0,174*** ### |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,94+0,081* |
5-Ожог+аппликации настойкой календулы | 10 | 4,94+0,081* |
Примечание: в сравнении с контрольными животными: *р<0,05; **p<0,01; ***p<0,001; в сравнении с группой 2-Ожог: #р<0,05; ##p<0,01; ###p<0,001.
Анализ данных по определению перекисного гемолиза эритроцитов самцов белых крыс показал, что устойчивость эритроцитов к перекисной провокации значительно повышалась в условиях лечения ожогов кожи крыс аппликациями бальзамом «Спасатель». Воздействие аппликациями мазью «Д-пантенол» привели к повышению устойчивости эритроцитов к перекисной провокации и приблизили показатели перекисного гемолиза эритроцитов к контролю. Термический ожог без лечения резко снизил устойчивость эритроцитов к перекисной провокации. Аппликации настойкой календулы незначительно повысил устойчивость эритроцитов к гемолизу (см. табл. 2).
Установлено, что термические ожоги существенно влияют и на общее число лейкоцитов, что проявлялось выраженной лейкопенией во все сроки наблюдения. В табл. 3 представлена некоторая волнообразность лейкопении. Так, на 3-и сутки количество лейкоцитов составляло 1,8±1,4 × 109, на 7-е – 2,5±1,4 × 109, на 14-е – 0,85±1,4 × 109, на 30-е – 2,4±1,4 × 109. Учитывая, что в контрольной серии уровень лейкоцитов составлял 10,2±1,4 × 109, что соответствует и литературным данным [9], отмечено значительное снижение числа защитных клеток крови.
Таблица 3
Содержание лейкоцитов в периферической крови крыс
Экспериментальные группы | Количество животных, n | Количество лейкоцитов × 109 на 3 сутки эксперимента | Количество лейкоцитов × 109 на 7 сутки эксперимента | Количество лейкоцитов × 109 на 10 сутки эксперимента |
1-Контроль | 10 | 3,4 ± 0,1 | 3,2 ± 0,1 | 3,0 ± 0,1 |
2-Ожог | 10 | 3,8 ± 0,2 * | 3,3 ± 0,3 * | 2,9 ± 0,2 * |
3-Ожог+аппликации мазью «Д-пантенол» | 10 | 3,2 ± 0,3 * | 3,1 ± 0,3 * | 2,9 ± 0,3 * |
4-Ожог+аппликации бальзамом «Спасатель» | 10 | 3,1 ± 0,3* | 3,1 ± 0,3* | 3,2 ± 0,4* |
5-Ожог+аппликации настойкой календулы | 10 | 2,8 ± 0,2 * | 3,1 ± 0,3 * | 2,9 ± 0,2 * |
Примечание: * – p<0,05 – достоверность различий между группами животных по сравнению с контролем.
Наблюдалось изменение общего количества лейкоцитов после термического воздействия между экспериментальными группами и контролем (см. табл. 3). В ходе экспериментов было выявлено, что у животных, получавших терапию Д-пантенолом, происходило незначительное уменьшение общего количества лейкоцитов в сравнении с контролем. У животных, получавших лечение настойкой календулы, количество лейкоцитов достоверно уменьшилось в сравнении с контрольной группой на 22 % (р<0,05).
Изучение лейкоцитарной формулы дало не менее интересные результаты. В табл. 4 отражены результаты исследования влияния ожоговой травмы на показатели лейкоцитарной формулы периферической крови подопытных крыс. В контрольной серии в формуле преобладали лимфоциты до 55–60 %, нейтрофилы составляли 40 %. При исследовании получено, что термический ожог приводил к достоверному и выраженному увеличению процентного числа лимфоцитов и нейтрофилов. Так, на 3-и сутки лимфоциты составляли 67,4 %.
Таблица 4
Изменение показателей лейкоцитарной формулы на 3-и сутки эксперимента
Экспериментальные группы | Нейтрофилы, M±m, % | Лимфоциты, M±m, % | Эозинофилы M±m, % | Моноциты M±m, % |
1-Контроль | 40,1±3,52 | 55,6±3,18 | 2,1±0,71 | 6,2±2,00 |
2-Ожог | 27,1± 2,97* | 67,4±2,61* | 3,1± 0,80* | 2,4± 0,34* |
3-Ожог+аппликации мазью «Д-пантенол» | 37,2± 2,91# | 60,2±2,94# | 2,7± 0,49# | 5,9± 0,61# |
4-Ожог+аппликации бальзамом «Спасатель» | 41,0± 2,99# | 58,6±5,22 # | 2,9± 0,31# | 6,4± 2,32# |
5-Ожог+аппликации настойкой календулы | 41,0± 2,99 # | 64,6±5,22 # | 2,7± 0,31# | 2,9± 2,32# |
Примечание: р<0,05, * – в сравнении с контролем,
# – в сравнении с группой получивших ожог без лечения.
Данные эксперимента моделирования термического ожога межлопаточной области спины белых крыс свидетельствовали о достоверном колебании количества нейтрофилов у животных, получавших лечение аппликациями спрея, в сравнении с контрольной группой и группой, не получавших лечение (рис. 1).
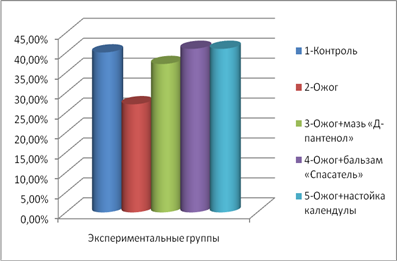
Рис. 1. Количество нейтрофилов (M±m, %) в разных опытных группах
Отмечено, что показатели количества нейтрофилов, по сравнению с контролем, чуть ниже в группе, лечившихся спреем «Д-пантенол», и незначительно выше в группе, лечившихся бальзамом «Спасатель». На рис. 2 видно, что отсутствие терапии ожога у 2 группы крыс отразилось на большем количественном содержании лимфоцитов крови.
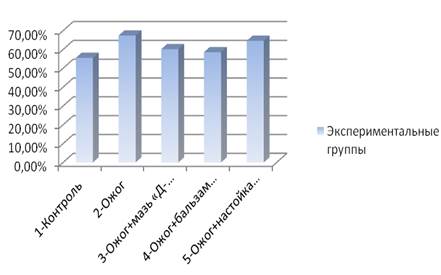
Рис. 2. Количество лимфоцитов (M±m, %) в разных опытных группах
У группы крыс, лечившихся бальзамом «Спасатель», количество лимфоцитов увеличилось. При сравнении крыс, лечившихся спреем «Д-пантенол», с контрольной группой наблюдалось снижение количества лимфоцитов, а у крыс, лечившихся настойкой календулы, количество лимфоцитов практически не отличалось от 2 группы.
При ожоге наблюдалось изменение показателей эозинофилов: увеличение этого показателя в группе 2 (ожог без терапии), в сравнении с группами крыс, получавших лечение (р<0,05). У животных, лечившихся спреем, количество эозинофилов повысилось на 22 %, по сравнению с контролем, при терапии настойкой календулы оно понизилось, что не достоверно (рис. 3).
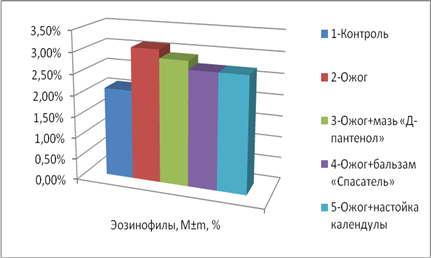
Рис. 3. Количество эозинофилов (M±m, %) в разных опытных группах
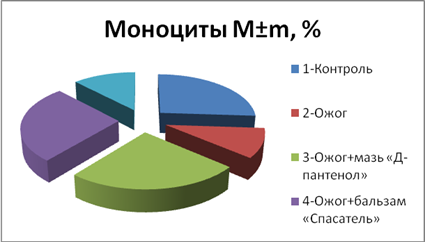
Как видно из круговой диаграммы на рис. 4, термическое воздействие без лечения приводило к снижению количества моноцитов, терапия аппликациями бальзамом «Спасатель» и спреем «Д-пантенол» стимулировало незначительное увеличение количества моноцитов в крови, по сравнению с контрольной группой подопытных животных (рис. 4).

Рис. 4. Количество моноцитов (M±m, %) в разных опытных группах
Заключение
Исследование таких гематологических показателей, как количество эритроцитов, лейкоцитов, уровень гемоглобина и состояние перекисной резистентности эритроцитов, свидетельствует о значительном поражении системы крови под воздействием местного воздействия термического фактора. Наиболее результативными оказались эксперименты терапии ожогов крыс аппликациями спрея «Д-пантенол» и бальзама «Спасатель».
Таким образом, применение в эксперименте лекарственных средств для лечения ожогов (спрей Д-пантенол, бальзам «Спасатель») способствует существенному ингибированию свободнорадикального окисления, к повышению прочности клеточных мембран компонентов крови.
Библиографическая ссылка
Ажикова А.К., Журавлева Г.Ф. ИССЛЕДОВАНИЕ ГЕМАТОЛОГИЧЕСКИХ ПОКАЗАТЕЛЕЙ КРЫС В НОРМЕ И В УСЛОВИЯХ ТЕРМИЧЕСКОГО ВОЗДЕЙСТВИЯ // Современные проблемы науки и образования. – 2016. – № 2.;
URL: https://science-education.ru/ru/article/view?id=24350 (дата обращения: 14.08.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
