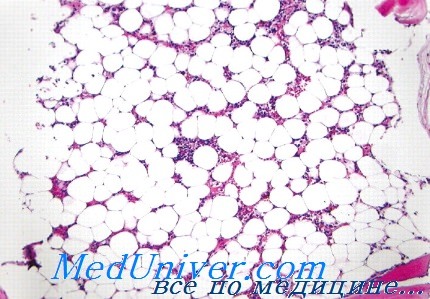
Общий анализ крови при апластической анемии
[40-132]
Развернутая лабораторная диагностика анемий
6060 руб.
Комплексное исследование всех необходимых лабораторных маркеров различных анемий, используемое для дифференциальной диагностики заболеваний из этой группы.
Синонимы русские
Комплексная лабораторная диагностика анемий.
Синонимы английские
Anemia Laboratory Panel, Complex Laboratory Diagnostics of Anemia.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить (по согласованию с врачом) прием лекарственных препаратов, содержащих железо, в течение 72 часов до исследования.
- Исключить физическое и эмоциональное перенапряжение в течение 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
О наличии анемии говорят при снижении гематокрита менее 41 % (гемоглобина менее 13,5 г/дл) у мужчин и менее 37 % (гемоглобин менее 12 г/дл) у женщин. Существует множество причин развития анемии:
1. Нарушение образования эритроцитов:
- дефицит железа;
- талассемии;
- анемия хронического заболевания;
- апластическая анемия;
- метастатическое поражение красного костного мозга;
- дефицит эритропоэтина при заболеваниях почек;
- другие.
2. Усиленное разрушение эритроцитов:
- кровопотеря;
- гемолиз (наследственный сфероцитоз, дефицит глюкозо-6-фосфатдегидрогеназы, наличие искусственного клапана, аутоиммунная анемия);
- гиперспленизм;
- инфекции;
- другие.
Хотя причин анемии очень много, их дифференциальная диагностика достаточно проста при исследовании клинико-лабораторных маркеров анемий. Это комплексное исследование включает следующие анализы и маркеры.
Общий анализ крови – скрининговый анализ при подозрении на анемию. Позволяет получить важную информацию о природе анемии при его правильной интерпретации:
- на основании MCV (mean corpuscular volume, средний объем эритроцита) анемии можно разделить на микроцитарные (MCV менее 80 fl), нормоцитарные (80-100 fl) и макроцитарные (100 fl);
- показатель RDW (RBCd istribution width, распределение эритроцитов по объему) увеличен только при железодефицитной анемии;
- форма эритроцитов – хотя изменения формы эритроцитов могут наблюдаться при многих анемиях, пойкилоцитоз (наличие эритроцитов разной формы) и анизоцитоз (наличие эритроцитов разного размера) – типичные признаки железодефицитной анемии.
Кроме того, независимо от причины анемии, степень ее тяжести оценивается на основании данных ОАК.
Ретикулоциты – клетки-предшественники эритроцитов. Их количество отражает “эффективность” эритропоэза. Повышение количества ретикулоцитов отражает текущий или недавний интенсивный эритропоэз, который наблюдается в следующих случаях:
- состояние после кровотечения (травма, кровотечение из ЖКТ, меноррагия);
- состояние после эпизода гемолиза;
- ответ на терапию (препаратами железа, витамином В12 или фолиевой кислотой, эритропоэтином).
Снижение количества ретикулоцитов отражает нарушение эритропоэза, которое наблюдается в следующих случаях:
- дефицит витамина В12, фолиевой кислоты и железа;
- дефицит эритропоэтина;
- апластическая анемия или инфильтрация красного костного мозга.
Витамин В12, витамин В9 (фолиевая кислота), железо – это элементы, необходимые для разных этапов эритропоэза. При интерпретации уровня этих маркеров необходимо учитывать следующие моменты:
- нередко пациенты с В12-дефицитной анемией имеют нормальный уровень витамина В12, поэтому при наличии макроцитарной (MCV более 100 fl) и мегалобластической анемии (гиперсегментация нейтрофилов) даже при нормальном уровне В12 целесообразно провести дополнительные лабораторные исследования, характеризующие обмен цианокобаламина (например, метилмалоновая кислота и гомоцистеин в крови);
- уровень железа сыворотки всегда интерпретируют в сочетании с ферритином и трансферрином.
Ферритин – внутриклеточный белок, обеспечивающий хранение железа в тканях. Считается, что концентрация ферритина в крови отражает запасы железа в организме. Трансферрин – белок плазмы крови, обеспечивающий транспорт железа. Как правило, концентрации трансферрина и ферритина в крови находятся в обратной пропорциональной зависимости: чем выше уровень ферритина, тем ниже уровень трансферрина. Следует помнить, что трасферрин и ферритин относятся к так называемым белкам острой фазы воспаления, поэтому их концентрация зависит не только от уровня железа, но и от многих других факторов, в первую очередь от воздействия на гепатоциты про- и противовоспалительных цитокинов. По уровню трансферрина, ферритина и железа сыворотки можно судить о природе анемии.
Распространенные анемии | Железо | Ферритин | Трансферрин |
Железодефицитная анемия | ↓ | ↓ | ↑ |
Анемия хронического заболевания | ↓ | ↑ | ↓ |
Витамин В12-дефицитная анемия | ↑ или норма | ↑ или норма | ↓ или норма |
Сидеробластические анемии | ↑ | ↑ | ↓ |
Талассемии | ↑ или норма | ↑ или норма | ↓ или норма |
Билирубин – пигмент, образующийся при распаде гемоглобина и некоторых других гемсодержащих белков в печени, селезенке и костном мозге. Общий билирубин представляет собой совокупность непрямого (несвязанного, ассоциированного с альбумином) и прямого билирубина (связанного с глюкуроновой кислотой). Увеличение концентрации общего билирубина при нормальной концентрации прямого билирубина – характерный признак гемолитических анемий. Следует отметить, что изменение концентрации билирубина может наблюдаться и при многих других заболеваниях, например при вирусных гепатитах. Поэтому для подтверждения того, что изменения билирубина действительно обусловлены гемолизом, могут понадобиться дополнительные лабораторные тесты, такие как гаптоглобин, ЛДГ, коагулограмма и другие.
Креатинин, с определением СКФ и эритропоэтин. Исследование этих параметров позволяет исключить заболевания почек как причину анемии.
- Креатинин – это конечный продукт метаболизма креатинфосфата – энергетического субстрата, образующегося в мышцах. Он свободно фильтруется в почках, что позволяет использовать его для оценки фильтрационной функции почек. Из-за недостаточной чувствительности этого параметра в настоящее время он не рекомендуется в качестве основного метода оценки функции почек, но концентрация креатинина используется для расчета скорости клубочковой фильтрации (СКФ).
- Эритропоэтин – гормон, необходимый для нормального эритропоэза, его основным источником являются почки. При снижении функции почек и развитии хронической почечной недостаточности (ХПН, или ХБП) синтезируемого эритропоэтина становится недостаточно и возникает анемия. В исследованиях показано, что анемия наблюдается у 44,1 % пациентов с IV стадией ХБП. Несмотря на то что уровень эритропоэтина при ХБП находится в пределах нормы или даже немного повышен, он считается неадекватно низким по отношению к степени анемии, так как пациенты с такой же степенью анемии и нормальной функцией почек имеют уровень эритропоэтина в 10-100 раз выше.
Развернутая лабораторная диагностика анемий включает основные, но не все анализы, которые могут быть необходимы при выявлении причин анемии. В некоторых случаях могут потребоваться более сложные анализы, например иммуноморфологическое исследование красного костного мозга. Более того, при определении причины анемии могут потребоваться дополнительные тесты, например анализ кала на скрытую кровь при диагностике железодефицитной анемии у взрослого. Результат исследования оценивают с учетом всех значимых анамнестических, лабораторных и инструментальных данных.
Для чего используется исследование?
- Для дифференциальной диагностики анемий.
Когда назначается исследование?
- При наличии признаков анемии: быстрой утомляемости, одышки, головокружения, ощущения учащенного сердцебиения, бледности;
- при выявлении анемии в общем анализе крови.
Что означают результаты?
Референсные значения
Для каждого показателя, входящего в состав комплекса:
- [02-014] Общий анализ крови (без лейкоцитарной формулы и СОЭ)
- [02-027] Ретикулоциты
- [03-013] Эритропоэтин
- [06-012] Витамин В12 (цианокобаламин)
- [06-017] Железо в сыворотке
- [06-021] Креатинин в сыворотке (с определением СКФ)
- [06-036] Билирубин общий
- [06-037] Билирубин прямой
- [06-040] Трансферрин
- [06-042] Ферритин
- [06-043] Витамин B9 (фолиевая кислота)
- [30-002] Билирубин непрямой
Важные замечания
- Результаты исследования оценивают с учетом дополнительных клинических, инструментальных и лабораторных данных.
Также рекомендуется
[06-077] Гаптоглобин
[06-016] Гомоцистеин
[06-025] Лактатдегидрогеназа (ЛДГ) общая
[13-083] Антитела к внутреннему фактору Кастла
[02-038] Скрытая кровь в кале, количественно (метод FOB Gold)
[12-024] Определение рецепторов в опухоли молочной железы иммуногистохимическим методом (трепанбиоптат, операционный материал)
Кто назначает исследование?
Терапевт, врач общей практики, педиатр, гематолог.
Литература
- Jolobe OM. How to interpret and pursue an abnormal complete blood cell count in adults. Mayo Clin Proc. 2005 Oct;80(10):1389-90; author reply 1390, 1392.
- cPhee S.J., Papadakis M. CURRENT Medical Diagnosis and Treatment / S. J. McPhee, M. Papadakis; 49 ed. – McGraw-Hill Medical, 2009.
Лабораторная диагностика апластической анемии – анализыИсследование периферической крови указывает на наличие панцитопении. Анемия носит нормоцитный характер, однако, в отдельных случаях, может быть умеренно макроцитной (например, при отравлении химическими веществами, такими как бензол). Число ретикулоцитов меньше нормы; в некоторых случаях эти клетки крупных размеров и незрелые, возможно по причине краткосрочности их пребывания в костном мозге. Гранулоцитопения носит абсолютный характер, при этом, когда их количественный показатель менее 200/мм3, создаются брагоприятные условия для развития весьма тяжелых инфекций. Определение запаса гранулоцитов в костном мозге с помощью эндотоксина, этиохоланолона или пирифера лучше отражает фактическое состояние гранулоцитопении. Хотя на первый взгляд образование лимфоцитов и моноцитов не нарушается при этом заболевании, тем не менее, когда, например, количественный показатель лейкоцитов достигает 1000/мм3 отмечается наличие абсолютной лимфоцитопении. Но при определенных обстоятельствах, таких как апластическая анемия у ребенка под воздействием облучения, по иммунологической причине (волчанка) и пр., наблюдается поражение и лимфатической ткани (Мунтяну). В любом случае отмечается наличие тромбоцитопении различной интенсивности с соответствующими проявлениями в клиническом плане. Следует отметить, что в уже проявившейся анемии тромбоцитопоэтическая функция восстанавливается наиболее поздно или никогда. Показатель времени кровоточивости увеличен, пробы на ломкость капилляров — положительные, ретракция сгустка — измененная, причем все это отражает присутствие уменьшенного числа кровяных пластинок. Эритроферокинетические исследования определяют количественный недостаток эритропоэза, при этом выявляемые аномалии отражают, по существу, не только сокращение, но и функциональное поражение ткани красных кровяных клеток (Bryon). Так, показатель железа в сыворотке увеличен, скрытая способность восстановления железа — заниженна, временной показатель клиренса радиоактивного железа завышен, а включение железа в эритроциты сосудистой крови — ниже нормы. Все это свидетельствует о значительном сокращении эритропоэтической ткани. Однако интенсивность и скорость метаболизма железа плазмы в норме (24—30 мг/сутки), что может показаться лишенным логики в отношении не включающего железо костного мозга. Объяснение этого факта следует искать в том, что железо, как свидетельствует сцинтиграфическое исследование, направляется в другие органы — в том числе печень или селезенка.
Исследование продолжительности жизни красных кровяных клеток привели к укладывающимся в норму результатам. Эритропоэтин выделяется в избытке с мочой, видимо по причине неиспользования в процессе эритропоэза. Плодный гемоглобин может увеличиваться до более 1%, особенно у детей, однако в нашей казуистике повышение его показателя обнаруживалось и v взрослых. Собственно наличие подсказывает хороший прогноз (Williams). В принципе макроскопический аспект костного мозга жирный, это обнаруживается при размозжении зерен для мазков, дающих результаты большей точности. Общий аспект костного мозга напоминает «цвет бузины» с перемежающимися участками жирного преобразования и различной целлюлярности. В менее тяжелых случаях клеточная масса слагается из всех кроветворных рядов со всеми ступенями созревания, но, естественно, в меньшем количестве. В отдельных случаях наблюдаются качественные изменения даже среди имеющихся в наличии рядов, в основном — эритроидном. К таковым относятся наличие макробластов или мегалобластов, угнетение созревания ряда гранулоцитов с процентным ростом незрелых элементов (миелоцитов, промиелоцитов). При всех обстоятельствах показатель железа в постном мозге значительно увеличен, в то время как численность сидеробластов превышает норму. Нередко зерна железа располагаются кольцом (при отравлениях, предлейкемическом состоянии) (Мунтяну). В тяжелых случаях клеточная масса костного мозга сводится к редким элементам лимфоидного, плазмоцитного или моноцитного видов. Наиболее точное определение состояния гипо-или аплазии костного мозга достигается проведением биоптического исследования костного мозга различных участков (Duhamel). Гистопатологическое исследование костного мозга представляет исключительную ценность при апластической анемии. Этим способом: – Также рекомендуем “Течение апластической анемии – осложнения” Оглавление темы “Апластическая анемия”:
|
Апластическая анемия – тяжёлое гематологическое заболевание, сопровождающиеся малокровием, резким снижением иммунитета, а также нарушениями процессов свертывания крови. Она возникает вследствие подавления кроветворной функции костного мозг (или аплазии костного мозга).
Болезнь впервые описана известным немецким врачом и ученым Паулем Эрлихом, в 1888 году. Неизвестная ранее патология, обнаруженная у молодой беременной женщины, сопровождалась тяжёлой анемией, снижением числа лейкоцитов, лихорадкой, кровоточивостью и быстро привела к смерти больной. Проведенное патологоанатомическое исследование обнаружило замещение красного костного мозга жировой тканью. Позднее, в 1907 году, Анатоль Шоффар, французский врач, предложил назвать это заболевание апластической анемией.
Апластическая анемия – достаточно редкое заболевание. Средняя заболеваемость – 3-5 на 1 млн. всего населения за год. Большинство больных – дети и молодые люди.
Различают наследственную (генетически обусловленную) и приобретенную апластическую анемию.
80% случаев заболевания обусловлены приобретенной формой патологии, 20% вызваны генетическими факторами.
Медики пользуются классификацией патологии по МКБ-10 (Международная Классификация Болезней 10 пересмотра). Различают следующие виды апластических анемий:
D61.0 Конституциональная апластическая анемия
D61.1 Медикаментозная апластическая анемия
D61.2 Апластическая анемия, вызванная другими внешними агентами
D61.3 Идиопатическая апластическая анемия
D61.8 Другие уточненные апластические анемии
D61.9 Апластическая анемия неуточненная
У детей в большинстве случаев заболевание носит приобретенный характер. Частота встречаемости составляет 2-3 случая на 1 млн. детей (пик заболеваемости приходится на подростковый возраст). В 70% случаев непосредственную причину болезни установить не удаётся, принято считать, что наибольшее значение имеют вирусные инфекции, химикаты и лекарственные препараты.
Чаще всего диагноз устанавливают случайно, при общем анализе крови. При правильном лечении и своевременной диагностике прогноз благоприятный. Апластическая анемия у детей хорошо лечится. Результаты применения трансплантации костного мозга и иммуносупрессивной терапии примерно одинаковы по эффективности, однако следует отдавать предпочтение пересадке костного мозга от подходящего (в идеале брат или сестра) донора. Современные методы лечения апластической анемии в детском возрасте позволяют сохранить здоровье и не влияют на способность иметь детей в будущем.
Генетически обусловленные нарушения кроветворной функции отмечают при некоторых наследственных патологиях, таких как семейная анемия Фанкони, синдром Швахмана-Даймонда, истинная эритроцитарная аплазия, врождённый дискератоз.
Мутации в критически важных генах, отвечающих за регуляцию клеточного цикла, синтез белков, защиту и восстановление повреждений ДНК, ведут к образованию дефектных стволовых (гемопоэтических) клеток. Ошибки в генетическом коде инициируют запуск апоптоза – механизма запрограммированной клеточной смерти. При этом пул стволовых клеток сокращается гораздо быстрее, чем у здоровых людей.
Приобретенная форма патологии возникает в результате прямого токсического воздействия на гемопоэтические клетки. К таким факторам относят:
· Воздействие ионизирующей радиации. От апластической анемии погибла Мария Склодовская-Кюри – физик, дважды лауреат Нобелевской премии, полученной за работы в области исследования радиоактивности и за открытие новых радиоактивных элементов;
· Пестициды, инсектициды, производные бензола, соли тяжёлых металлов, мышьяк обладают прямым токсическим эффектом на костный мозг, угнетают продукцию форменных элементов крови и приводят к гибели стволовых клеток;
· Схожим эффектом обладают некоторые лекарства. Нестероидные противовоспалительные средства, противоопухолевые препараты, анальгин, левомицетин (вызывает наиболее тяжёлую форму заболевания, которая по статистике возникает в 1 из 30 тыс. курсов лечения левомицетином), мерказолил, карбамазепин, хинин способны вызвать апластическую анемию у некоторых людей;
· Пусковым фактором для болезни могут быть вирусы. Вирусные гепатиты, некоторые виды парвовирусов, ЦМВ, вирус Эпштейна-Барр и ВИЧ обладают способностью вызывать сбой в иммунной системе, вследствие чего она начинает атаковать собственные ткани организма. Например, у 2% пациентов с острым вирусным гепатитом – выявляют апластическую анемию;
· Аутоиммунные заболевания (ревматоидный артрит, СКВ) также может сопровождать аплазия костного мозга;
· Апластическая анемия при беременности, предположительно, также возникает из-за нарушений в иммунной системе.
В более 50% случаев непосредственную причину заболевания не находят, тогда говорят об идиопатической апластической анемии.
Красный костный мозг – основной и самый важный кроветворный орган, в котором происходит образование и созревание элементов крови. Стволовые гемопоэтические клетки в нем дают начало эритроцитам (отвечают за перенос О2 и СО2), лейкоцитам (обеспечивают иммунитет) и тромбоцитам (участвуют в процессах свёртывания крови). Количество гемопоэтических клеток ограничено и постепенно уменьшается на протяжении всей жизни человека.
При апластической анемии происходит массовая гибель стволовых клеток костного мозга, и, как результат, – резкое снижение содержания эритроцитов, тромбоцитов и лейкоцитов в кровеносном русле больного. Недостаток эритроцитов приводит к малокровию, уменьшение количества лейкоцитов вызывает резкое угнетение иммунной системы, уменьшение числа тромбоцитов – причина кровоточивости и, как следствие, повышенного риска неконтролируемого кровотечения.
Результаты последних исследования дают основание полагать, что приобретенная форма заболевания почти всегда – аутоиммунная патология. Ключевой момент в развитии аплазии красного костного мозга – прямое цитотоксическое действие Т-лимфоцитов. Однако причина, по которой Т-лимфоциты начинают распознавать гемопоэтические стволовые клетки как цели для атаки, до сих пор неизвестна. Пусковым фактором могут служить точечные мутации в генах, кодирующих человеческие лейкоцитарные антигены (HLA система), и объясняющий искажённый иммунный ответ (как и при других аутоиммунных патологиях).
Также полагают, что для развития патологии необходима комбинация нескольких факторов – как внутренних (неизвестные дефекты в ДНК стволовых клеток, мутации генов системы HLA, иммунные нарушения), так и внешних (лекарственные препараты, вирусные инфекции, экзотоксины и антигены).
Симптомы, характерные для заболевания:
· Необъяснимая слабость, утомляемость, сонливость;
· Низкая работоспособность;
· Одышка, возникающая даже при легком физическом напряжении;
· Головокружение, головные боли;
· Перебои в сердце, сердцебиение, тахикардия;
· Бледность кожи;
· Удлинение времени свертывания крови, кровоизлияния в мягкие ткани, головной мозг, образование синяков и кровоподтёков при незначительном воздействии, кровотечение из носа, затяжные изнуряющие менструации у женщин;
· Мелкоточечные кровоизлияния в кожу и слизистые оболочки, кровоточивость десен;
· Частые инфекции (дыхательных путей, кожи, слизистых оболочек, мочевыводящих путей), сопровождающиеся лихорадкой;
· Безболезненные язвы на слизистой рта;
· Потеря массы тела, похудание.
Течение болезни может быть постепенным или молниеносным (с быстрым развитием крайне тяжелой анемии, иммунодефицита, нарушениям процессов свертывания крови с соответствующими осложнениями).
Для диагностики используют развернутый анализ крови и гистологическое исследование материала, добытого из костного мозга.
Лабораторные признаки патологии, обнаруживаемые в периферической крови:
· Снижение концентрации эритроцитов и гемоглобина в крови без дефицита железа;
· Снижение концентрации лейкоцитов всех видов в крови больного;
· Дефицит тромбоцитов;
· Низкое количество ретикулоцитов – незрелых форм эритроцитов;
· Увеличение скорости оседания эритроцитов (до 40-60 мм/ч).
В очень тяжелых случаях концентрация гемоглобина падает ниже 20-30 гр/л. Цветовой показатель, уровни сывороточного железа, эритропоэтина обычно в норме или повышены. Количество тромбоцитов ниже нормы, в тяжёлых случаях они полностью отсутствуют.
Диагноз подтверждается с помощью биопсии костного мозга. Гистология пунктата показывает большое содержание жира на фоне снижения количества гемопоэтических клеток. Клеточность (общее содержание гемопоэтических стволовых клеток) – ниже 30%, могут отсутствовать мегакариоциты – клетки-предшественники тромбоцитов.
По результатам биопсии различают апластическую анемию лёгкой, тяжёлой и крайне тяжелой степени.
Тяжёлая форма болезни: клеточность – ниже 25%; в периферической крови: нейтрофилов – < 0,5х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Крайне тяжелая форма болезни: клеточность – ниже 25; в периферической крови: нейтрофилов – < 0,2х109/л, тромбоцитов – < 20х109/л, ретикулоцитов – < 20х109/л.
Легкая форма патологии отклонения от нормы не достигают таких критических показателей.
Тактика лечения зависит от нескольких факторов: от степени тяжести, возраста больного, возможности провести пересадку костного мозга от подходящего донора (в идеале – близкие единокровные родственники больного).
Оптимальным методом лечения тяжелой и крайне тяжелой формы патологии принято считать трансплантацию костного мозга от подходящего донора. Максимальный эффект наблюдается у пациентов молодого возраста. При пересадке костного мозга от подходящего донора 10-летняя выживаемость может достигать 85-90%.
При наличии противопоказаний к трансплантации костного мозга или отсутствии возможности провести её (отсутствие подходящего донора) используется иммуносупрессивная терапия.
Основные препараты, использующиеся для консервативной терапии – антитимоцитарный иммуноглобулин (АТГ) и циклоспорин А.
АТГ – это сыворотка, содержащая антитела против человеческих Т-лимфоцитов, полученная из лошадиной крови. Введение приводит к сокращению популяции Т-лимфоцитов в организме больного, в результате снижается цитотоксическое воздействие на стволовые клетки, улучшается кроветворная функция.
Циклоспорин А – селективный иммунодепрессант, избирательно блокирующий активацию Т-лимфоцитов и высвобождение интерлейкинов, включая интерлейкин-2. В результате блокируется аутоиммунный процесс, разрушающий стволовые клетки, улучшается кроветворная функция. Циклоспорин А не подавляет кроветворную функцию костного мозга и не приводит к тотальной иммуносупрессии.
Показания к назначению глюкокортикостероидов при апластической анемии ограничены профилактикой осложнений при терапии АТГ. Во всех остальных случаях стероидные гормоны имеют посредственную эффективность и являются причиной целого ряда осложнений.
Несмотря на высокую эффективность иммуносупрессивной терапии наиболее радикальное лечение – это пересадка костного мозга. Применение АТГ и циклоспорина А увеличивает риск развития миелодиспластического синдрома и лейкозов, не гарантирует отсутствие рецидивов заболевания.
При неэффективности иммуносупрессивной терапии проводится пересадка костного мозга от донора, не состоящего в родстве с больным. Результаты операции могут быть разными. В 28-94% случаев отмечают 5-летняя выживаемость, в 10-40% случаев происходит отторжение трансплантата.
Пациенты с тяжёлой апластической анемией получают препараты крови в качестве экстренной медицинской помощи. Переливание эритроцитарной массы позволяет быстро компенсировать анемию, а переливание тромбоцитарной массы предупреждает угрожающие жизни кровотечения.
Даже при стойкой ремиссии необходимо проходить периодические обследования (прежде всего, сдавать анализы крови) и по возможности – избегать воздействия негативных факторов.
В период лечения следует помнить, что больные с апластической анемией имеют слабую иммунную систему. Необходимо избегать посещения мест массового скопления людей, регулярно мыть руки, не есть приготовленную в сомнительных местах еду (из-за риска инфекции). Своевременная вакцинация может предупредить некоторые заболевания (в том числе гриппа).
Высокий риск кровотечения или кровоизлияния ограничивает занятия спортом, особенно травмоопасными видами. Несмотря на это, активный образ жизни с регулярными дозированными физическими нагрузками положительно влияют на самочувствие и психоэмоциональное состояние больных.
Сбалансированное питание, богатое витаминами, минералами и белками способствует быстрому восстановлению кроветворения. Не следует употреблять скоропортящиеся продукты (из-за риска возникновения пищевых токсикоинфекций). При лечении циклоспорином А следует ограничить потребление соли.
Оппортунистические инфекции (вирусные, грибковые, бактериальные), обусловленные иммунодефицитом;
Кровотечения, кровоизлияния, нарушения свертывания крови (обусловленные низким числом тромбоцитов);
Осложнения, обусловленные побочными эффектами лекарственных средств для лечения апластической анемии (вторичный гемохроматоз, сывороточная болезнь);
Трансформация болезни в миелодиспластический синдром, лейкемию и другие гематологические заболевания.
До выяснения причин и механизмов развития патологии смертность от апластической анемии достигала 90%. За последние 20-30 лет удалось значительно снизить летальность заболевания. Современные методы лечения значительно улучшили прогноз – 85% пациентов достигают 5-летнего порога выживаемости.
У детей и молодых людей при адекватном лечении прогноз благоприятный и пятилетняя выживаемость достигает 90% (для больных старше 40 лет – 75%).
Эффективные меры профилактики генетически обусловленной апластической анемии отсутствуют в настоящее время.
Профилактика приобретенной апластической анемии заключается в адекватной защите от воздействия токсических веществ, пестицидов и ионизирующего излучения. Следует избегать самостоятельного приема лекарственных средств, особенно длительного и в высоких дозах.
