Оксигенация гемоглобина крови это
В последнее время из-за ситуации с коронавирусом мы стали все больше погружаться во врачебную терминологию. КТ, ИВЛ и оксигемометр — привычные слова в лексиконе рядового человека, интересующегося ситуацией с коронавирусом.
Сегодня поговорим про оксигенацию и устройства с помощью которых ее можно измерить. А также расскажем, как определить тяжелое развитие коронавирусной пневмонии в домашних условиях.
Оксигенация: что это такое?
Оксигенация — это уровень насыщения или сатурации крови кислородом. Этот важный показатель, который демонстрирует общее состояние организма человека и говорит о дыхательной функции.
Всемирная организация здравоохранения сообщила, что нормальным показателем сатурации для взрослых и детей является — 95-98%, если уровень насыщения крови кислородом ниже 93% для взрослого и 90% для ребенка — то это один из главных симптомов развития осложнений из-за коронавирусной инфекции или других факторов.
Обычно сатурация измеряется при помощи небольшого устройства оксигемометра или пульсометра. Эти устройства крепятся на пальце человека и устанавливают насыщенность кислородом гемоглобина. Такие устройства подходит даже для домашнего использования с целью контроля своего состояния.
оксигемометр
Так же существует метод, который позволит установить уровень сатурации без дополнительных устройств. Просто зажмите фалангу пальца, не накрашенного лаком, с обеих сторон. Дождитесь пока ноготь побелеет и отпустите. Если палец из белого состояния в розовый вернется меньше чем за 2 секунду, то у вашего организма отличная сатурация и переживать не стоит.
Сатурация ниже нормы: что делать?
Если вы считаете, что ваша кровь недостаточно насыщенна кислородом, то это не значит, что вы больны COVID-19. А также если у вас хорошая сатурация, это не говорит о том, что COVID-19 обошел ваш организм стороной.
Хорошая сатурация всего лишь говорит о том, что ваши сосуды и кровь насыщенны кислородом в достаточном количестве для нормальной жизнедеятельности. Ведь когда происходит инфицирование организма, то в борьбу включаются лимфоциты, которые пытаются блокировать клетки вируса в кровеносных сосудах. Поглощенные бактерии внутри сосуда создают плотность и снижают сатурацию.
Грубо говоря, если сатурация держится на уровне 98-100%, то это говорит о двух вещах: вы полностью здоровы, либо вы заражены коронавирусом, но ваша иммунная система с ним прекрасно справляется. Однако, достоверно сказать об этом можно будет только после проведения тестов на коронавирус.
Если вы заметили, что у вас низкая сатурация, то это может указывать на следующие факторы:
- Вам не хватает витаминов;
- Организм испытывает нехватку жидкостной среды;
- Развивается гипоксия (нехватка кислорода).
В этом случае у человека также будет повышенная температура, которая, как мы знаем, указывает на то, что в организме происходит воспалительный процесс.
Например, если у пациента наблюдаются проблемы с пищеварением, легкими или сердцем, а также если он злоупотребляет алкоголем. Однако, даже после сильных физических нагрузок, сатурация может удерживаться на низком уровне.
Поэтому только по уровню сатурации нельзя точно сказать больны вы коронавирусом или же здоровы. Однако, зная эту информацию, вы можете следить за состоянием своего организма, что поможет вовремя определить изменения в организме и правильно среагировать.
Итог
Хорошая сатурация не говорит, об отсутствии коронавирусной инфекции, равно как и плохая сатурация не подтверждает наличие COVID-19.
Паниковать по поводу коронавируса можно только в том случае, если вместе с плохой сатурацией совпали высокая температура, кашель и ломота в мышцах. В этой ситуации нельзя медлить и важно вовремя вызвать врача на дом.
Несмотря на то, что исследование кислотно-основного состояния, строго говоря, подразумевает исследование только величины pH (концентрации ионов H+), в реальности в него также включается исследование физиологически важных газов, присутствующих в крови – O2 и CO2. Анализ газов показывает эффективность газообмена по величинам парциальных давлений – pO2 и pCO2.
Через альвеолярную мембрану молекулы любых газов перемещаются диффузно по градиенту концентрации. Молекулы O2 атмосферного воздуха поступают из альвеол в кровь, а молекулы CO2 из крови в альвеолы до тех пор пока их парциальные давления не выровняются.
Величина парциального давления – это процентная доля газа в общем объеме.
Углекислый газ
Концентрация СО2 в альволярном воздухе столь низка, а в крови столь высока, что диффузия этого газа в альвеолы чрезвычайно эффективна и скорость его удаления зависит только от альвеолярной вентиляции – общего объема воздуха, транспортируемого в минуту между альвеолами и атмосферой (“скорости выдувания”).
Следовательно,
- при усиленной вентиляции легких углекислый газ быстро выводится, и показатель pCO2в крови снижается. Это означает потерю организмом угольной кислоты (ионов H+), что является причиной защелачивания крови – алкалоза, называемого дыхательным или респираторным.
- при недостаточной альвеолярной вентиляции величина рСО2 повышается, что свидетельствует о недостаточном его удалении и накоплении H2CO3. Иными словами, повышение в крови показателя рСО2 является причиной дыхательного ацидоза.
Увеличенное pCO2 (гиперкапния) всегда свидетельствует о снижении альвеолярной вентиляции.
Кислород
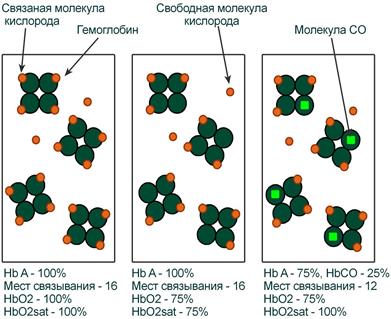
Вопросы, связанные с оксигенацией крови и транспортом кислорода более сложны. Связано это с тем, что в виде свободных (растворенных) молекул O2 находится лишь небольшая доля общего кислорода крови. Основная часть кислорода связана с гемоглобином (оксигемоглобин) и истинное содержание кислорода зависит от двух дополнительных параметров – концентрации Hb и насыщения (сатурации) гемоглобина кислородом.
Оксигемоглобин
Оксигемоглобин (HbО2) – процентное содержание в крови, является отношением фракции оксигемоглобина (HbО2) к сумме всех фракций (общему гемоглобину).
Насыщение гемоглобина кислородом
Насыщение гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Отличия между двумя показателями HbО2 и HbOSAT заключаются в том, что у пациентов возможно наличие в крови такой формы гемоглобина, которая не способна акцептировать О2 (Hb‑CO, metHb, сульфоHb). Но так как большинство больных не имеют в крови повышенного содержания этих форм гемоглобина, значения HbО2 и SО2 обычно очень близки.
Например, если при отравлении нитритами количество metHb составляет 15%, тогда величина HbО2 никогда не сможет превысить 85%, но насыщение (HbOsat) может быть различно – от максимума (HbOsat=95-98%) при полном насыщении до низких величин при отсутствии кислорода.
Показатель насыщения кислородом показывает процент доступных мест связывания на гемоглобине.

Иллюстрация понятий оксигемоглобина (HbO2) и насыщения гемоглобина (HbO2sat)
Парциальное давление кислорода (pO2)
Парциальное давление O2 выступает как движущая сила, приводящая к насыщению гемоглобина кислородом. И хотя, как правило, чем выше pO2 тем выше HbOsat, эта зависимость не является линейной.
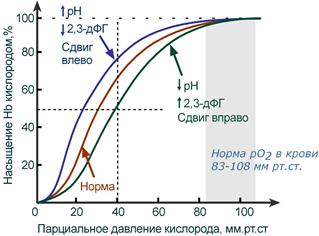
Кривая диссоциации гемоглобина в норме и
при изменении pH и концентрации 2,3-дифосфоглицерата
В центральной части кривой насыщения (или кривой диссоциации) гемоглобина малейшие сдвиги pO2 приводят к резким изменениям насыщения гемоглобина. И наоборот, при высоком pO2 (80-90-100 мм рт.ст) кривая становится плоской, насыщение гемоглобина мало зависит от колебаний кислорода в плазме.
Сдвиг влево происходит при защелачивании и снижении концентрации 2,3-дифосфоглицерата и сигнализирует об увеличении сродства кислорода к гемоглобину (в легких). Сдвиг вправо – это снижение сродства кислорода к гемоглобину (в тканях), обеспечивается закислением среды и накоплением 2,3-дифосфоглицерата.
Показатель pO2 не отражает содержание кислорода в цельной крови! Но хотя pO2 и не показывает общее количество кислорода в крови, но это общее количество зависит от pO2 через показатель сатурации гемоглобина.
В свою очередь имеются факторы, влияющие на величину pO2:
1. Альвеолярная вентиляция. Хотя она влияет как на pO2 так и на pCO2, но доля кислорода в альвеолах при гипервентиляции может лишь слегка увеличиться, приближаясь к pO2 атмосферного воздуха, при гиповентиляции – стремительно падает, вытесняясь поступающим из крови CO2. В то же время доля CO2 в альвеолах быстро снижается при усиленной вентиляции.
2. Вентиляционно-перфузионное соотношение, определяется тем, что
- не вся кровь, притекающая к легким, соприкасается с хорошо вентилируемыми альвеолами (спадение альвеол, уплотнение стенки).
- не все хорошо вентилируемые альвеолы получают достаточно крови (правожелудочковая сердечная недостаточность).
3. Концентрация кислорода во вдыхаемом воздухе (FiO2, fraction of inspired oxygen).
В таблице приведены сравнительные величины концентрации кислорода и углекислого газа в воздухе, крови и тканях.
Необходимо обратить внимание на перепады концентраций кислорода и углекислого газа в крови и альвеолярном воздухе. Важной особенностью является то, что pO2 в альвеолярном воздухе и артериальной крови очень близки, т.е. в обычных условиях глубоким и/или частым дыханием невозможно повысить потребление кислорода и насыщение им гемоглобина. В то же время разность концентраций pCO2 в венозной крови и альвеолярном воздухе позволяет эффективно его удалять при частом дыхании.
| pO2, мм рт.ст. | pCO2, мм рт.ст | |
| Вдыхаемый воздух | 159 | 0,23 |
| Альвеолярный воздух | 105-110 | 40 |
| Артериальная кровь | 83-108 | 35-45 |
| Ткани | 10-20 | 50-60 |
| Венозная кровь | 35-49 | 46-51 |
| Выдыхаемый воздух | 116 | 32 |
Качество оксигенации артериальной крови оценивают по трем показателям: напряжению кислорода (РаО2), содержанию кислорода (СаО2) и насыщению гемоглобина (SaO2). Все три параметра взаимосвязаны, но при этом по каждому из них судят о разных аспектах оксигенации.
РаО2 — напряжение кислорода в артериальной крови; измеряется в единицах давления (традиционно — в мм рт. ст. [torr]), а в последнее время — в килопаскалях [кПа}). РаО2 численно равно давлению, под которым произошло насыщение крови кислородом. Его Можно определить и как давление кислорода, требующееся для того, чтобы удержать В артериальной крови растворенный кислород. Чем выше Ра02, тем больше кислорода содержится в крови и тем выше скорость движения кислорода из капиллярной крови в ткани. В норме (то есть когда здоровый человек дышит атмосферным воздухом) этот показатель составляет 92-98 мм рт. ст.* РаО2 обычно измеряют в лабораторных условиях в пробе артериальной крови или в мониторном режиме микроэлектродом, введенным в артерию.
СаО2 — количество кислорода в артериальной крови; обычно измеряется в мл О2/100 мл крови. Чаще всего данный показатель получают расчетным путем, реже — лабораторно. Кислород содержится в крови в двух формах:
• Кислород, физически растворенный в крови. Растворимость кислорода в биологических жидкостях очень низка, а его количество в них прямо пропорционально напряжению. В 100 мл крови на каждый 1 мм рт. ст. напряжения О2 приходится 0,0031 мл растворенного 02. Нетрудно подсчитать, что в 100 мл артериальной крови в норме содержится всего около 0,3 мл растворенного кислорода. Поэтому существенное количество физически растворенного кислорода появляется в крови лишь в гипербарических условиях или после инфузии перфторкарбоновых соединений. Видимо, излишне упоминать о том, что пульсоксиметр не реагирует на кислород, растворенный в крови.
• Основной запас кислорода находится в обратимой связи с гемоглобином. Один грамм полностью насыщенного кислородом гемоглобина (Sa02 °° 100 °/о) содержит 1,39 мл кислорода*. Поэтому количество мл кислорода, присоединенного к гемоглобину, в 100 мл крови равняется:
НЬ(г/100 мл) х Sa02 X 1,39/100.
Так, при НЬ = 15 г/100 мл и Sa02 = 98 % гемоглобин артериальной крови содержит:
(15 х 0,98 х 1,39) ° 20,4 мл 02/1QO мл крови.
Таким образом, в норме в 100 мл артериальной крови при данном количестве гемоглобина содержится (20,4 + ДЗ) = 20,7 мл кислорода.
Кислородная емкость гемоглобина ограничена, поскольку молекула HЬ способна присоединить к себе только 4 молекулы кислорода. После, того как весь гемоглобин пре-вращается в оксигемоглобин, дальнейшее насыщение его кислородом становится невозможным.
Следует отметить, что даже при нормальном РаО2 содержание кислорода в крови может быть низким (например, при анемии или отравлении окисью углерода). И наоборот, при сниженном напряжении кислорода в артериальной крови Са02 может быть нормальным (например, при гемоконцентрации или полицитемии).
Кислородная емкость одного грамма чистого гемоглобина (константа, впервые измеренная фон Гюфнер в лабораторных условиях в 1894 году) составляет 1,39 мл/г. Однако реальное значение этой константы равняется 1,34-1,37 мл/г, что зависит от количества карбокси- и метгемоглобина, всегда присутствующих в крови и небольших количествах. Отсюда — разночтения в литературе относительно ее величины.
SaO2 — степень насыщения гемоглобина артериальной крови кислородом. Пульсоксиметр измеряет именно этот показатель (напомним, что в данном случае он обозначается SpO2), поэтому мы рассмотрим его подробнее.
Степень насыщения гемоглобина кислородом зависит от напряжения кислорода в крови. Отношения между Ра02 и Sa02 Достаточно сложны, регулируются несколькими физиологическими факторами (речь о них пойдет ниже) и графически выражаются S-образной кривой диссоциации оксигемоглобина.
Диссоциация оксигемоглобина — отделение кислорода от оксигемоглобина. Обратный процесс — образование оксигемоглобина из гемоглобина и кислорода — называется сатурацией, или оксигенацией гемоглобина. Эти два процесса лежат в основе транспорта кислорода кровью.
Диссоциация гемоглобина. Этим термином, схожим с предыдущим по звучанию, но не по сути, в действительности обозначается разрушение гемоглобина с образованием гема и глобина; однако в клинике им нередко ошибочно пользуются, говоря о SaO2.
* Для каждого возрастного диапазона существуют собственные нормативы итого показателя.
Ответ на эти вопросы был получен после того, как выяснилось, что молекула дезоксигемоглобина при связывании кислорода претерпевает конформационные изменення. Первое указание на существование таких изменений относится к тому времени, когда было обнаружено, что кристаллы дезоксигемоглобина, выращенные в бескислородной атмосфере, разрушаются, как только вступают в контакт с кислородом. Это наблюдение наводило на мысль о том, что при связывании кислорода молекулы гемоглобина изменяются в своих размерах и уже не укладываются в кристаллическую решетку дезоксигемоглобина. Это предположение было полностью подтверждено результатами сравнительного рентгеноструктурного анализа, которые показали, что дезоксигемоглобин и оксигемоглобин имеют разные пространственные конформации (рис. 8-10 и 8-18). При оксигенации дезоксигемоглобина третичная структура и -цепей практически не изменяется, поскольку они остаются плотно пригнанными друг к другу и образуют димеры . Однако, как только кислород присоединяется к гемогруппам дезоксигемоглобина, половинки молекулы сохраняя свойственную им жесткую конформацию, изменяют свое положение относительно друг друга и теснее сближаются между собой. Иными словами, оксигенация гемоглобина вызывает изменение его четвертичной структуры, т.е. упаковки субъединиц. В результате молекула оксигемоглобина приобретает несколько более компактную структуру по сравнению с дезоксигемоглобином, и центральная полость уменьшается. Гемы двух Р-цепей сближаются друг с другом, а темы двух -цепей раздвигаются, что и приводит к сигмоидной форме кривой насыщения кислородом. Вследствие этих изменений аминокислотные остатки в и -цепях, связывающие ионы перемещаются из относительно гидрофильного окружения в более гидрофобное, что облегчает отщеплепие ионов от протонированных групп; иначе говоря, при оксигенации гемоглобина протонированные группы приобретают свойства более сильных кислот, чем и объясняется эффект Бора. Таким образом, изменение четвертичной структуры гемоглобина в результате его оксигенации находится в прямой связи с существованием обратного соотношения между сродством гемоглобина к кислороду и его сродством к и ионам .
Наконец, еще одну особенность регуляторных свойств гемоглобина выявили Рейнгольд Бенеш и Руфь Бенеш, обнаружившие четвертый лиганд гемоглобина -дифосфоглицерат. Об этой интересной особенности рассказывается в дополнении 8-1.
Рис. 8-18. Схематическое изображение (в виде «стоп-кадров») изменений в четвертичной структуре гемоглобина, обусловленных перемещением пары субъединиц относительно неподвижной пары в процессе освобождения кислорода из оксигемоглобина, переходящего в форму дезоксигемоглобина.
Дополнение 8-1. Дифосфоглицерат и сродство гемоглобина к кислороду
Уже давно известно, что 2,3-дифосфоглицерат (рис. 1) присутствует в эритроцитах в довольно высоких концентрациях, однако функция этого соединения оставалась загадкой до тех пор, пока не было обнаружено, что он оказывает сильное влияние на сродство гемоглобина к кислороду. При добавлении 2,3-дифосфоглицерата (ДФГ) к раствору чистого гемоглобина сродство гемоглобина к кислороду значительно снижается.
Этот эффект обусловлен тем, что ДФГ сам связывается с дезоксигемоглобином. Следовательно, можно написать уравнение еще одной (четвертой по счету) реакции связывания гемоглобина с лигандом:
Таким образом, наблюдается обратная зависимость между двумя процессами – связыванием кислорода и ДФГ (присоединяющихся к разным участкам молекулы гемоглобина).
Рис. 1. А. Структура 2,3-дифосфоглицерата (ДФГ). Красным цветом выделены заряженные группы взаимодействующие с двумя Р-цепями. Б. Расположение молекулы ДФГ (выделена красным цветом) в центральной полости гемоглобина. Отрицательно заряженные группы ДФГ притягиваются к находящимся поблизости положительно заряженным R-группам -цепей (показаны жирными черными линиями).
Регулирующее влияние ДФГ на сродство гемоглобина к кислороду в эритроцитах зависит от величины парциального давления кислорода в легких. После того как здоровый человек поднимется, скажем, на высоту 4000 м над уровнем моря, в течение первых нескольких часов концентрация ДФГ в его эритроцитах будет возрастать; при этом число молекул ДФГ, связанных с гемоглобином, увеличится, а сродство гемоглобина к кислороду снизится. На большой высоте парциальное давление кислорода значительно ниже, чем на уровне моря. Поэтому и в тканях парциальное давление кислорода снижается. Увеличение содержания ДФГ в эритроцитах при восхождении на большую высоту облегчает освобождение кислорода из гемоглобина в тканях. Изменения противоположного характера наблюдаются у людей, акклиматизировавшихся к условиям высокогорья, например у жителей Гималаев или Андов, когда они спускаются в долины.
Повышение концентрации ДФГ в эритроцитах наблюдается также у людей при гипоксии; это патологическое состояние возникает вследствие недостаточного снабжения тканей кислородом, что может быть обусловлено заболеваниями органов дыхания или нарушениями в системе кровообращения.
С каким участком молекулы гемоглобина связывается ДФГ? В молекуле гемоглобина имеется открытая центральная полость, или канал, который хорошо виден на рис. 8-10. Этот канал, выстланный многими положительно заряженными -группами, и служит местом связывания ДФГ, который присоединяется к дезоксигемоглобину и образует поперечную связь (солевой мостик) между двумя -субъединицами. При связывании гемоглобином кислорода ДФГ вытесняется из полости. Гемоглобин связывает только одну молекулу ДФГ (рис. 1); напомним, что он может связывать по четыре молекулы или и примерно четыре иона Н+.
Рис. 2. Влияние ДФГ на кривую насыщения гемоглобина кислородом.
При обычном выделении гемоглобина из крови он содержит довольно большое количество ДФГ, от которого трудно освободиться полностью. При полном удалении ДФГ из гемоглобина кривая связывания его с кислородом в значительной степени утрачивает свою сигмоидную форму и гемоглобин приобретает намного более высокое сродство к кислороду. После добавления избытка ДФГ к гемоглобину способность последнего к связыванию кислорода понижается (рис. 2). Таким образом, присутствие ДФГ весьма существенно для нормального освобождения кислорода из гемоглобина в тканях. В эритроцитах некоторых птиц содержится не ДФГ, а другое фосфатсодержащее соединение – инозитолгексафосфат, который даже еще более эффективно, чем ДФГ, снижает сродство гемоглобина к кислороду.
Гемоглобин можно рассматривать как молекулярную автоматическую систему управления, которая отзывается на изменение концентрации любого из его четырех лигандов, передает соответствующую информацию, преобразуя ее в конформационные изменения молекулы, и таким путем регулирует свое сродство к другим лигандам.
Рис. 8-19. Симметричная («все или ничего») и последовательная (индуцированное соответствие) модели кооперативного связывания кислорода гемоглобином. В обеих моделях субъединицы могут находиться в двух различных состояниях. Кружками обозначено состояние, в котором субъединицы имеют низкое сродство к кислороду, а квадратами состояние с высоким сродством к кислороду. А. Согласно симметричной модели («все или ничего»), гемоглобин может находиться только в двух формах: в одной из них все субъединицы имеют низкое сродство к кислороду, а в другой высокое. При отсутствии кислорода обе эти формы находятся в равновесии, но форма с низким сродством к кислороду доминирует. Если же кислород присутствует, то он связывается преимущественно с формой гемоглобина, имеющей высокое сродство; при этом равновесие сдвигается вправо и вероятность связывания с гемоглобином оставшегося кислорода увеличивается. В симметричной модели не предусматривается существования промежуточных форм по отношению к формам с низким и высоким сродством к кислороду. Б. В последовательной модели (модели индуцированного соответствия) имеется несколько промежуточных конформаций, последовательно приближающихся к форме с высоким сродством к кислороду. Связывание молекулы кислорода с одной из субъединиц, имеющей низкое сродство к кислороду, индуцирует переход этой субъединицы в форму с высоким сродством. Такой переход в свою очередь повышает вероятность того, что последовательное присоединение кислорода к другим субъединицам будет индуцировать их переход в форму с высоким сродством.
Считается, что связывание кислорода с одной или двумя субъединицами вызывает в них небольшие конформационные изменения, способствующие конформационным перестройкам пустых (не заполненных кислородом) субъединиц, в результате чего изменяется четвертичная структура всей молекулы; при этом ее сродство к кислороду повышается, а сродство к и ионам понижается. Наоборот, при освобождении кислорода четвертичная структура вновь принимает исходную форму, способствующую связыванию и ионов .
Были предложены различные теории для детального объяснения всех структурных изменений гемоглобина, наблюдаемых в процессе его оксигенаиии и дезоксигенации, а также происходящих при этом изменений в его способности к связыванию лигандов (рис. 8-19). Но каковы бы ни были детали всех этих изменений, ясно одно – гемоглобин может служить моделью автоматической регулирующей системы при рассмотрении других олигомерных белков. например ферментов, особенно тех из них, которые обладают как каталитической, так и регуляторной активностью. Многие белки, наделенные такими регуляторными свойствами, состоят из двух или большего числа пригнанных одна к другой полипептидных цепей, образующих характерную четвертичную структуру, способную изменяться при переходе белка из одного активного состояния в другое в процессе его функционирования.
