Осмотическое давление крови в норме составляет
Осмотическое давление крови — это давление, которое способствует проникновению водного растворителя через полупроницаемую мембрану в сторону более концентрированного состава.
Благодаря этому в организме человека происходит водный обмен между тканями и кровью. Измерять его можно с помощью осмометра или криоскопически.
От чего зависит осмотическая величина
На этот показатель оказывает влияние количество электролитов и неэлектролитов, растворенных в плазме крови. Не менее 60% составляет ионизированный хлорид натрия. Растворы, осмотическое давление которых приближается к плазменному, называют изотоническими.
Если эта величина снижена, то такой состав зовется гипотоническим, а в случае ее превышения — гипертоническим.
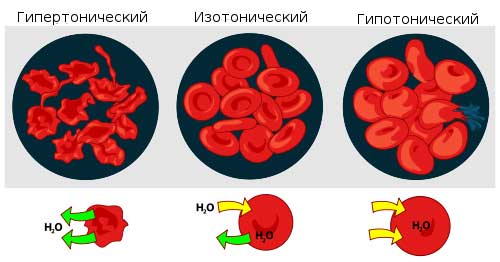
При изменении нормального уровня раствора в тканях клетки повреждаются. Для нормализации состояния жидкости могут вводиться извне, причем состав будет зависеть от характера болезни:
- Гипертонический раствор способствует выведению воды в сосуды.
- Если давление в норме, то препараты разводят в изотоническом растворе, обычно это натрий хлорида.
- Гипотонический концентрированный раствор способен привести к разрыву клетки. Вода, проникая в клетку крови, стремительно наполняет ее. Но при правильной дозировке это способствует очистке ран от гноя, уменьшению аллергического отека.
Почки и потовые железы заботятся о том, чтобы этот показатель был неизменным. Они создают защитный барьер, который не допускает влияния продуктов обмена на организм.
Поэтому осмотическое давление у человека практически всегда имеет постоянную величину, резкий скачек может произойти лишь после интенсивной физической нагрузки. Но организм все равно сам быстро нормализует этот показатель.
Как влияет питание
Правильное питание — залог здоровья всего человеческого тела. Изменение давления происходит в случае:
- Употребления большого количества соли. Это приводит к отложению натрия, из-за чего стенки сосудов становятся плотными, соответственно, уменьшается просвет. В таком состоянии организм не справляется с выведением жидкости, что приводит к увеличению циркуляции крови и повышению артериального давления, появлению отеков.
- Недостаточного употребления жидкости. Когда организму не хватает воды, нарушается водный баланс, кровь сгущается, так как уменьшается количество растворителя, то есть воды. Человек ощущает сильную жажду, утолив которую, запускает процесс возобновления работы механизма.
- Употребления вредной пищи или нарушения работы внутренних органов (печени и почек).
Как измеряется, и о чем говорят показатели
Величина осмотического давления плазмы крови измеряется при замерзании последней. В среднем эта величина в норме составляет 7,5–8,0 атм. При повышении показателя температура замерзания раствора будет выше.
Часть осмотической величины создает онкотическое давление, его образуют белки плазмы. Оно отвечает за регуляцию водного обмена. Онкотическое давление крови в норме составляет 26–30 мм рт. ст. Если показатель изменяется в меньшую сторону, то появляется отечность, так как организм плохо справляется с выведением жидкости, и она скапливается в тканях.
Это может происходить при заболеваниях почек, длительном голодании, когда состав крови содержит мало белков, или при проблемах с печенью, в этом случае за сбой отвечают альбумины.
Влияние на человеческий организм
Бесспорно, осмос и осмотическое давление — это основные факторы, влияющие на упругость тканей и способность организма сохранять форму клеток и внутренних органов. Они обеспечивают ткани нутриентами.
Чтобы понять, что это такое, следует эритроцит поместить в дистиллированную воду. Со временем вся клетка наполнится водой, оболочка эритроцита разрушится. Этот процесс получил название «гемолиз».

Если клетку окунуть в концентрированный солевой раствор, она потеряет свою форму и упругость, произойдет ее сморщивание. Плазмолиз приводит к потере эритроцитом воды. В изотоническом же растворе сохранятся первоначальные свойства.
Осмотическое давление обеспечивает нормальное движение воды в организме.
Мы настоятельно рекомендуем не заниматься самолечением, лучше обратитесь к своему лечащему доктору. Все материалы на сайте носят ознакомительный характер!
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (осмос). Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Мера градиента осмотического давления, то есть различия водного потенциала двух растворов, разделённых полупроницаемой мембраной, называется тоничностью. Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Взаимодействие эритроцитов с растворами в зависимости от их осмотического давления.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для внутривенного введения, растворяют в изотоническом растворе, содержащем столько хлорида натрия (поваренной соли), сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном (гипотоническом по отношению к цитоплазме) растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия (3—10 %, гипертонические растворы), то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называется плазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, — соответственно, деплазмолизом.
Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ (или ионов, если молекулы вещества диссоциируют), следовательно, осмотическое давление является коллигативным свойством раствора. Чем больше концентрация вещества в растворе, тем больше создаваемое им осмотическое давление. Это правило, носящее название закона осмотического давления, выражается простой формулой, очень похожей на уравнение состояния для идеального газа:
,
где i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м³; R — универсальная газовая постоянная; T — термодинамическая температура раствора.
Это показывает также схожесть свойств частиц растворённого вещества в вязкой среде растворителя с частицами идеального газа в воздухе. Правомерность этой точки зрения подтверждают опыты Ж. Б. Перрена (1906): распределение частичек эмульсии смолы гуммигута в толще воды в общем подчинялось закону Больцмана.
Осмотическое давление, которое зависит от содержания в растворе белков, называется онкотическим (0,03—0,04 атм). При длительном голодании, болезни почек концентрация белков в крови уменьшается, онкотическое давление в крови снижается и возникают онкотические отёки: вода переходит из сосудов в ткани, где πОНК больше. При гнойных процессах πОНК в очаге воспаления возрастает в 2—3 раза, так как увеличивается число частиц из-за разрушения белков.
В организме осмотическое давление должно быть постоянным (около 7,7 атм). Поэтому для внутривенного введения обычно используются изотонические растворы (растворы, осмотическое давление которых равно πплазмы ≈ 7,7 атм. (0,9 % NaCl — физиологический раствор, 5 % раствор глюкозы). Гипертонические растворы, у которых π больше, чем πплазмы, применяются в медицине для очистки ран от гноя (10 % NaCl), для удаления аллергических отёков (10 % CaCl2, 20 % глюкоза), в качестве слабительных лекарств (Na2SO4∙10H2O, MgSO4∙7H2O).
Закон осмотического давления можно использовать для расчёта молекулярной массы данного вещества (при известных дополнительных данных).
Обоснование формулы Вант-Гоффа с термодинамических позиций[править | править код]
В растворе свободная энергия , где — молярная часть раствора, — его мольный объем. Появление члена эквивалентно внесению в свободную энергию внешнего давления. Для чистого растворителя . При равновесии для растворителя равно нулю. Таким образом,
откуда:
то есть получена формула Я. Вант-Гоффа ().
При её выведении высчитано, что — малая величина. Это позволяет разложить в ряд и далее применить соотношение Произведение в разбавленных растворах практически равно объему раствора.
Осмотическое давление коллоидных растворов[править | править код]
Для возникновения осмотического давления должны выполняться два условия:
- наличие полупроницаемой перегородки (мембраны);
- наличие по обе стороны мембраны растворов с разной концентрацией.
Мембрана проницаема для частичек (молекул) определенного размера, поэтому она может, например, выборочно пропускать сквозь свои поры молекулы воды, не пропуская молекулы этилового спирта. Для газовой смеси — водорода и азота — роль полупроницаемой мембраны может выполнять тонкая палладиевая фольга, сквозь которую свободно диффундирует водород, тогда как азот она практически не пропускает. с помощью такой мембраны можно разделять смесь водорода и азота на отдельные компоненты.
Простыми и давно известными примерами мембран, которые проницаемы для воды и непроницаемы для многих других растворенных в воде веществ, является кожа, пергамент, и другие ткани животного и растительного происхождения.
Пфеффер с помощью осмометра, в котором в качестве полупроницаемой мембраны использовался пористый фарфор, обработанный Cu2Fe(CN)6, исследовал осмотическое давление водных растворов тростникового сахара. На основе этих измерений Вант-Гофф в 1885 году предложил эмпирическое уравнение, которому подчиняется осмотическое давление разведенных растворов:
,
где c=n/V — концентрация растворенного вещества, моль/м3.
Это уравнение по форме совпадает с законом Бойля-Мариотта для идеальных газов. Поэтому осмотическое давление разведенных растворов можно определить как давление, которое бы создавала то же самое количество молекул растворенного вещества, если бы оно было в виде идеального газа и занимало при данной температуре объем, равный объему раствора.
Уравнение Вант-Гоффа можно несколько преобразовать, подставляя вместо концентрации :
,
где — массовая концентрация растворенного вещества; — его молекулярная масса.
В таком виде уравнение Вант-Гоффа широко применяется для определения молярной массы растворенного вещества. Осмотический метод применяют зачастую для определения молярных масс высокомолекулярных соединений (белков, полисахаридов и других). Для этого достаточно измерить осмотическое давление раствора с известной концентрацией.
Если вещество диссоциирует в данном растворе, то осмотическое давление будет большим, чем рассчитанное и нужно вводить изотонический коэффициент:
Уравнение Вант-Гоффа справедливо только для разведенных растворов, которые подчиняются закону Рауля. При повышенных концентрациях растворов в последнем уравнении должно быть заменено на активность или фугитивность
Роль осмоса в биологических системах[править | править код]
Явление осмоса и осмотическое давление играют огромную роль в биологических системах, которые содержат полупроницаемые перегородки в виде разных тканей, в том числе оболочек клеток. Постоянный осмос воды внутрь клеток создает избыточное гидростатическое давление, которое обеспечивает прочность и упругость тканей, которое называют тургором.
Если клетку, например, эритроцит, поместить в дистиллированную воду (или очень разбавленный раствор соли), то вода будет проникать внутрь клетки и клетка будет набухать. Процесс набухания может привести к разрыву оболочки эритроцита, если произойдет так называемый гемолиз.
Обратное явление наблюдается, если вместить клетку в концентрированный раствор соли: сквозь мембрану вода из клеток диффундирует в раствор соли. При этом протоплазма сбрасывает оболочку, клетка сморщивается, теряет тургор и стойкость, свойственные ей в нормальном состоянии. Это явление называется плазмолизом. При помещении плазмолизованных клеток в воду протоплазма опять набухает и в клетке восстанавливается тургор. Происходит при этом так называемый деплазмолиз: это можно наблюдать, помещая цветы, которые начинают вянуть, в воду. И только в изотоническом растворе, который имеет одинаковую концентрацию (вернее, одинаковое осмотическое давление с содержанием клетки), объем клетки остается неизменным.
Процессы усвоения еды, обмена веществ тесно связаны с разной проницаемостью тканей для воды и других растворенных в ней веществ.
Осмотическое давление отыгрывает роль механизма, который подает нутриенты клеткам; у высоких деревьев последние поднимаются на высоту нескольких десятков метров, что соответствует осмотическому давлению в несколько десятков атмосфер. Типовые клетки, сформировавшиеся с протоплазматических мешков, наполненных водными растворами разных веществ (клеточный сок), имеют определенное значение для давления, величина которого измеряется в пределах 0,4—2 МПа.
См. также[править | править код]
- Осмос
- Обратный осмос
- Осморегуляция
- Диффузионное давление
- Коллигативные свойства растворов
Литература[править | править код]
- Детлаф А. А., Яворский Б. М. Курс физики: Учебное пособие для вузов — М.: Высшая школа, 1989. — С. 113.
- Яцимирський В.К. – Фізична хімія
Явление осмотического давления в воде было обнаружено и описано еще в 1748 году французским физиком-экспериментатором Жаном-Антуаном Нолле.
Проводя свой эксперимент, Нолле наполнил сосуд этанолом и, закрыв его плотной мембраной, опустил в емкость с чистой водой. Под действием физических сил вода поступала внутрь сосуда с концентрированной жидкостью и создавала там давление, под действием которого сосуд раздувался. В процессе его эксперимента хватало пяти часов, чтобы объем в сосуде увеличился, а мембрана раздулась. Тогда он решил провести обратный опыт и наполнил колбу водой, поместив ее в сосуд со спиртом. Объем в колбе стал уменьшаться, а мембрана начала прогибаться вниз.
Нолле объяснил это явление, как избирательный перенос молекул через мембрану: когда жидкость с меньшей плотностью легко проходила через стенки мембраны, вторая, концентрированная, не могла осуществить диффузию.
Позже было доказано, что если к концентрированному раствору будет приложено давление, то перенос молекул растворителя можно замедлить или остановить в зависимости от величины давления. Наименьшее давление, за исключением давления самого растворителя, которое нужно приложить к раствору, чтобы предотвратить перемещение молекул чистого вещества через мембрану, было названо»«соматическое», а сам процесс произвольного перехода молекул растворителя стали называть «осмос».
Осмотическое и онкотическое давление плазмы крови
Осмотическое давление – то, что способствует проникновению раствора через полупроницаемую клеточную мембрану в сторону, где концентрация выше. Именно благодаря этому важному показателю в организме происходит обмен жидкостью между тканями и кровью.
А вот онкотическое давление помогает удерживать кровь в русле. За молярный уровень данного показателя отвечает белок альбумин, способный притягивать к себе воду.
Главная задача этих параметров – поддерживать внутреннюю среду организма на постоянном уровне со стабильной концентрацией составляющих клетки.
Характерными особенностями этих двух показателей можно считать:
- изменение под воздействием внутренних факторов;
- постоянство у всех живых организмов;
- уменьшение после интенсивной физической нагрузки;
- саморегуляция организмов при помощи внутриклеточного калиевого насоса – запрограммированной на клеточном уровне формулы идеального состава плазмы.
Гемолиз
Если поместить каплю крови, а следовательно, и эритроциты и гипотонический раствор, эритроциты набухают и разрушаются. Гемоглобин при этом выходит из эритроцитов и растворяется в плазме, которая становится прозрачной и окрашенной в красный цвет. Такая кровь называется лаковой кро-нью. Разрушение эритроцитов называется гемолизом. Гемолиз может наступить не только в условиях гипотонического раствора, но также при добавлении к крови эфира и некоторых других веществ.
Гемолиз вызывается также укусом тех змей, яд которых оказывает гемолизирующее действие.
Гемолиз наступает также при повторном введении животному эритроцитов других видов животных. В этих случаях в крови появляются специальные вещества — гемолизины, которые гемолизируют вводимые эритроциты.
При введении в кровь жидкостей должно быть учтено осмотическое давление вводимою раствора, которое должно соответствовать осмотическому давлению крови.
От чего зависит осмотическая величина
Осмотическое давление зависит от содержания электролитов, которые включает в себя плазма крови. Те растворы, которые по концентрации схожи с плазмой, называются изотоническими. К таковым относится популярный физраствор, вот почему его всегда используют для капельниц, когда необходимо восполнить водный баланс или когда была кровопотеря.
Именно в изотоническом растворе чаще всего растворяются вводимые препараты. Но иногда может потребоваться использование других средств. К примеру, гипертонический раствор необходим для выведения воды в сосудистый просвет, а гипотонический помогает очистить раны от гноя.
Осмотическое давление клетки может зависеть от обычного питания.
К примеру, если человек потребил большое количество соли, тогда концентрация ее в клетке увеличится. В дальнейшем это приведет к тому, что организм будет стремиться уравновесить показатели, потребив воды больше для нормализации внутренней среды. Таким образом, вода будет не выводиться из организма, а аккумулироваться клетками. Такое явление часто провоцирует развитие отечности, а также гипертензии (за счет увеличения общего объема крови, циркулируемой в сосудах). Также клетка после перенасыщения водой может лопаться.
Чтобы более понятно разъяснить изменения, происходящие в клетках, погруженных в разную среду, следует описать кратко одно исследование: если эритроцит поместить в дистиллированную воду, то он будет напитываться ею, увеличиваясь в размерах до разрыва оболочки. Если же его поместить в среду с большой концентрацией соли, то он начнет постепенно отдавать воду, сморщиваться, усыхать. Лишь в изотоническом растворе, который имеет такой же изоосмотический, как и сама клетка, она будет оставаться на том же уровне.
Это же происходит с клетками внутри организма человека. Именно поэтому столь распространено наблюдение: после съеденного соленого человеку сильно хочется пить. Такое стремление объясняется физиологией: клетки «хотят вернуться» к привычному уровню давления, под воздействием соли они сморщиваются, вот почему у человека возникает жгучее желание выпить простой воды, чтобы восполнить недостающие объемы, уравновесить организм.
Иногда больным дают специально приобретенные в аптеках смеси электролитов, которые затем разводятся в воде и принимаются в качестве питья. Это позволяет восполнить потерю жидкости в случае отравлений.
Как питание сказывается на осмотическом давлении
Сбалансированное правильное питание – один из способов профилактики скачков показателей и их последствий. Негативно влияют на осмотическое и онкотическое давление крови следующие пищевые привычки:
- Избыток соли в пище. Увлечение солью, специями и искусственными добавками провоцирует отложение натрия, что вызывает уплотнение стенок сосудов. В результате прохождение и выведение воды затрудняется, кровь циркулирует быстрее, артериальное давление возрастает, образуются отеки.
- Увлеченность некоторыми напитками. Например, кока-кола, кофе, пиво способны за двадцать минут изменить Ph среды плазмы крови, чем спровоцировать склеивание эритроцитов и повышение давления.
- Голодание, увлечение диетами. При несбалансированном или недостаточном питании уменьшается концентрация белков (гипопротеинемия), что провоцирует изменение вязкости, образование тромбов, снижение иммунитета, чувство усталости и апатии, понижение онкотического давления.
Сладкие газированные напитки повышают давление
- Несоблюдение режима потребления воды, чаще – недостаточное потребление. Возникает обезвоживание, сгущение крови, истощение клеток, возникает чувство жажды.
Важно! Лучше не допускать критического состояния, а регулярно выпивать по стакану воды и следить за режимом ее потребления-выведения из организма.
Об особенностях измерения кровяного давления вам подробно расскажут в этом видео:
Как измеряется, и о чем говорят показатели
Во время проведения лабораторных исследований кровь или отдельно плазма замораживаются. От того, какова будет температура заморозки, зависит тип соляной концентрации. В норме этот показатель должен составить 7,5-8 атм. Если удельный вес соли увеличится, то и температура, при которой замерзнет плазма, будет намного выше. Также измерять показатель можно при помощи специально предназначенного прибора – осмометра.
Частично осмотическая величина создает онкотическое давление при помощи белков плазмы. Они отвечают за уровень водного баланса в организме. Норма этого показателя: 26-30 мм.рт.ст.
Когда белковый показатель уменьшается, у человека возникает отечность, которая формируется на фоне повышенного потребления жидкости, что способствует ее скоплению в тканях. Такое явление наблюдается при снижении онкотического давления, на фоне длительного голодания, проблем с почками и печенью.
Методы измерения
Наиболее широко распространенных способов измерения давления осмоса существует два. Каким из них воспользоваться, врачи выбирают, исходя из ситуации.
Криоскопический способ
Поскольку температура замерзания крови напрямую зависит от количества в ней веществ, то данный метод часто используют. Чем насыщеннее плазма, тем при более низкой температуре она твердеет. Показатель осмоса, это важный параметр в работе организма, и он показывает, в оптимальных ли количествах присутствует в нем растворитель (вода).
Измерение осмометром
Второй вариант измерения предлагает делать это при помощи специального прибора — осмометра. Он представляет собой 2 колбы с перегородкой. Проходимость между ними частичная.
В одну из них наливают кровь и накрывают крышкой со шкалой, а в другую раствор. Он может быть гипертоническим, гипотоническим либо изотоническим. Смотрят на показатели шкалы в сосуде.
Влияние на человеческий организм
Осмотическое давление – важнейший показатель, который отвечает за поддержание формы клеток, тканей и органов человека. Собственно норма, которая обязательна для человека, отвечает также и за красоту кожи. Особенность клеток эпидермиса в том, что под действием возрастной метаморфозы содержание жидкости в организме сокращается, клетки теряют упругость. Как следствие появляется дряблость кожи, морщины. Именно поэтому медики и косметологи в один голос призывают потреблять не менее 1,5-2 литров очищенной воды в день, чтобы необходимая концентрация водного баланса на клеточном уровне не изменялась.
Осмотическое давление отвечает за правильное перераспределение жидкости в организме. Оно позволяет поддерживать постоянство внутренней среды, ведь очень важно, чтобы концентрация всех составляющих тканей и органов находилась на едином химическом уровне.
Таким образом, данная величина является не просто одним из показателей, необходимых только для медиков и их узконаправленных исследований. От нее зависят многие процессы в организме, состояние здоровья человека. Вот почему так важно знать хотя бы примерно, от чего параметр зависит, и что необходимо для поддержания его на нормальном уровне.
[adsp-pro-1] [adsp-pro-2]
Гипертония
Какие показатели считаются нормой, а какие – отклонением от нормы
Во время данного обследования крови находят точку ее замерзания. Оптимальное значение для кровяного раствора, это минус 0,56-0,58 градусов. Если перевести в атмосферное давление, то нормальными показателями силы осмоса является величина в 7,5-8 миллиметров ртутного столба. При показателе либо большем, либо меньшем, чем указанные границы, его величина будет отклонением от оптимальной.
Белки, как и соли, также создают осмотическое давление плазмы, но более слабое, в сравнении с ними (его величина составляет 26-30 миллиметров ртутного столба). Такое давление еще называют онкотическим, и оно изменяет значение общего показателя.
Способы нормализации
Человеческий организм обладает способностью саморегуляции осмотического давления. Когда от головного мозга поступает соответственный импульс об уменьшении объема межклеточной жидкости, то образуется гормон, который поступает в кровь. Затем на его присутствие реагируют почки.
Также способностью привести параметры осмотического давления к оптимальным значениям обладает и кровь, которая исполняет роль буферного устройства, как при повышении давления, связанного с осмосом, так и при его понижении.
Это происходит из-за перераспределения ионов между плазмой крови и красными тельцами, и «умением» белков в составе крови присоединять либо отдавать ионы.
Источники
- https://moyakrov.info/veny/davlenie/osmoticheskoe
- https://sosudoved.ru/diagnostika/osmoticeskoe-davlenie-krovi.html
- https://davlenii.ru/gipertoniya/osmoticheskoe.html
- https://serdcedoc.com/davlenie/ponyatie-ob-osmotricheskom-davlenii.html
- https://101sovet.guru/diagnostika/ot-chego-zavisit-osmoticheskoe-davlenie-krovi
[свернуть]
Что влияет на показатели осмоса
Показатели осмотического давления могут меняться по разным причинам:
- Концентрация неэлектролитов и электролитов (минеральных солей), растворенных в плазме. Эта зависимость прямо пропорциональна. Высокое содержание частиц провоцирует повышение давления, как и наоборот. Главный компонент – ионизированный хлорид натрия (60%). Однако от химического состава осмотическое давление не зависит. Концентрация катионов и анионов солей в норме – 0,9%.
- Количество и подвижность частиц (солей). Внеклеточная среда с недостаточной концентрацией будет принимать воду, среда с избыточной концентрацией – отдавать.
- Онкотическое давление плазмы и сыворотки крови, играющее главную роль в удержании воды в кровеносных сосудах и капиллярах. Отвечает за создание и распределение всех жидкостей. Снижение его показателей визуализируется отеками. Специфика функционирования обусловлена высоким содержанием альбуминов (80%).
На осмотическое давление влияет содержание солей в плазме крови
- Электрокинетическая стабильность. Определяется электрокинетическим потенциалом частиц (белков), который выражается их гидратацией и способностью отталкиваться друг от друга и скользить в условиях раствора.
- Суспензионная устойчивость, связанная напрямую с электрокинетической. Отражает скорости соединения эритроцитов, то есть свертываемость крови.
- Способность компонентов плазмы при движении оказывать сопротивление относительно течения (вязкость). При тягучести давление повышается, при текучести – падает.
- При физической работе возрастает осмотическое давление. Значение в 1,155% хлорида натрия вызывает чувство утомления.
- Гормональный фон.
- Обмен веществ. Избыток продуктов обмена, «загрязненность» организма провоцирует рост давления.
На показатели осмоса влияют привычки человека, питание и потребление напитков.
Также на давление влияет обмен веществ в организме человека
( 1 оценка, среднее 4 из 5 )
