Острая анемия при желудочном кровотечении
Специалистам / Практика / Практика (статья)
Статья |
17-09-2014, 22:10
|
 АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
АнемияВ практике гастроэнтеролога анемический синдром встречается достаточно часто. При этом основными видами анемий у пациентов с патологией органов пищеварения являются железодефицитная и В12-фолиеводефицитная анемии. В патогенезе анемий при заболеваниях желудочно-кишечного тракта ведущими механизмами выступают хроническая кровопотеря и нарушение всасывания гемопоэтических факторов.
Железодефицитная анемия – наиболее частая форма анемий в гастроэнтерологии, и причиной ее развития являются кровотечения, нарушения всасывания железа, диетические ограничения. Ряд хронических заболеваний пищеварительной системы сопровождается развитием анемии различной степени тяжести. Анемия может являться первым признаком основного заболевания, в частности, опухолевого процесса пищевого канала, а также быть причиной снижения качества жизни пациентов.
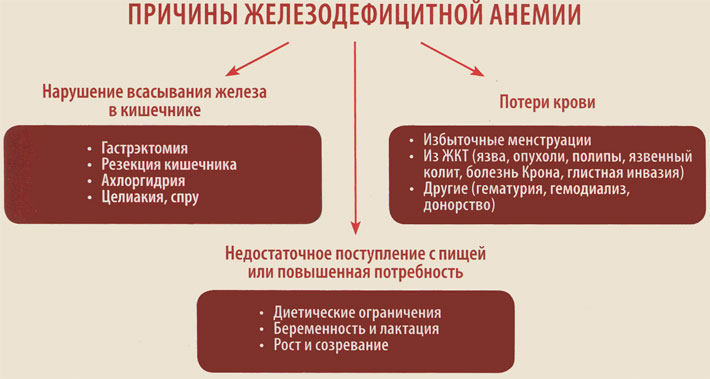
Выделяют три глобальные причины развития дефицита железа в организме:
- Недостаточное поступление с пищей или повышенная потребность.
- Нарушение всасывания железа в кишечнике.
- Хронические потери крови.
Заболевания желудочно-кишечного тракта являются одной из основных причин развития железодефицитной анемии, что обусловлено нарушением всасывания железа в кишечнике или его потерями вследствие эрозивно-язвенных, опухолевых или аутоиммунных воспалительных поражений слизистой оболочки кишечника.
Перечень заболеваний пищеварительного тракта, сопровождающихся развитием анемии, достаточно широк. Причиной железодефицитных состояний часто выступают болезни верхних отделов желудочно-кишечного тракта и толстой кишки.
Одной из важных причин развития железодефицитной анемии является нарушение процессов всасывания железа в двенадцатиперстной кишке и проксимальном отделе тощей кишки. Различные заболевания тонкой кишки, сопровождающиеся синдромом мальабсорбции (энтерит, амилоидоз, целиакея, идеопатическая стеаторея), а также оперативные вмешательства на желудке и тонкой кишке (состояние после тотальной гастроэктомии, субтотальной резекции желудка, ваготомии с гастроэктомией, резекция тонкой кишки) приводят к развитию дефицита железа.
Накапливаются данные о потенциальной связи инфекции H. pylory с железодефицитной анемией, которая может быть следствием скрытых кровотечений при эрозивном гастрите и язвенной болезни, нарушение всасывания железа при хеликобактерном атрофическом пангастрите, а также снижения содержания аскорбиновой кислоты в желудке и конкурентного захвата и утилизации железа самой бактерией. Таким образом, эрадикация H. pylory может стать еще одним подходом к лечению железодефицитной анемии в отсутствии других явных ее причин.
Этиологическим фактором анемии может стать прием нестероидных противовоспалительных препаратов (НПВП). Врачам хорошо известна возможность как массивных, так и скрытых кровотечений из эрозий и язв желудка и двенадцатиперстной кишки при НПВП-гастропатии. Однако, железодефицитная анемия может быть следствием НПВП-энтеропатии, другими клиническими проявлениями которой могут служить гипоальбуминемия, мальабсорбция и наличие измененной крови в кале.
Причиной нарушения всасывания гемопоэтических факторов являются и заболевания тонкой кишки. К ним можно отнести целиакию (половина пациентов с неясной этиологией железодефицитной анемии, резистентной к терапии препаратами железа), резекцию участка тонкой кишки, синдром избыточного бактериального роста в тонкой кишке, диабетическую энетропатию, амилоидоз, склеродермию, болезнь Уиппла, туберкулез, лимфому тонкой кишки, тропическое спру, паразитарные заболевания (лямблиоз) и гельминтозы (дифиллоботриоз).
Воспалительные заболевания кишечника, прежде всего, неспецифический язвенный колит и болезнь Крона, часто сопровождаются развитием анемии. Ведущими механизмами при этом выступают кровопотеря у пациентов с язвенным колитом и болезнью Крона, а также мальабсорбция при вовлечении в процесс тощей и подвздошной кишки при болезни Крона.
Ведущей причиной анемии при патологии нижних отделов желудочно-кишечного тракта, особенно у пациентов старше 50 лет, служит колоректальный рак. Хроническая кровопотеря наблюдается при полипах толстой кишки, дивертикулезе, ишемическом колите, геморрое и анальных трещинах.
Анемический синдром часто делает необходимым тщательное обследование желудочно-кишечного тракта. Для уточнения вида анемии проводят исследования общего и биохимического анализа крови.
Среди причин железодефицитной анемии (почти 30-50% всех случаев) прежде всего рассматривают острые или хронические кровопотери из желудочно-кишечного тракта.
Причины железодефицитной анемии
Как показали результаты открытого мультицентрового исследования, проведенного в Украине в 2008 году и базировавшиеся на анализе 1299 историй болезней больных железодефицитной анемией, основной причиной развития были эрозивно-язвенные поражения пищевого канала (44,58%) и заболевания, сопровождающиеся синдромом мальабсорбции. Циррозы печени являлись причиной железодефицитной анемии в 10,39% случаев, воспалительные заболевания кишечника – 4,54% больных.
Диагностируется железодефицитная анемия у больных с гастроэнтерологическими заболеваниями по совокупности анамнестических данных (указания на оперативные вмешательства на желудке или кишечнике, прием нестероидных или гормональных противовоспалительных препаратов, антикоагулянтов и антиагрегантов, язвенный анамнез, наличие хронических заболеваний печени и воспалительных заболеваний кишечника и т.д.), клинических проявлений (наличие специфического сидеропенического синдрома, проявляющегося сухостью и истончением кожи, ангулярный хейлит, дисфагия, ломкость ногтей, их поперечная исчерченность, вогнутость ногтевой пластинки, извращение вкуса и обоняния, симптом «голубых склер», мышечная слабость) и лабораторных показателей.
Диагностика анемии основывается, главным образом, на данных лабораторных исследований, в первую очередь – на результатах клинического исследования крови с определением концентрации гемоглобина.
Верхние отделы желудочно-кишечного тракта | Нижние отделы желудочно-кишечного такта | Весь желудочно-кишечный тракт |
– Язва желудка | – Аденома толстой кишки | – Болезнь Крона |
Согласно рекомендациям ВОЗ, критерием анемии является снижение концентрации гемоглобина до уровня 120 г/л для женщин (во время беременности – менее 110 г/л), для мужчин – менее 130 г/л. По степени тяжести различают анемию легкую (уровень гемоглобина крови 90-110 г/л), средней тяжести (гемоглобин – 70-89 г/л) и тяжелую (гемоглобин менее 70 г/л).
В лабораторной диагностике железодефицитной анемии основное практическое значение имеют три показателя: сывороточные концентрации железа, ферритина и общая железосвязывающая способность сыворотки (ОЖСС). ОЖСС – это общее количество железа, которое может связаться с трансферином. В норме сывороточная концентрация железа составляет 12-30 мкМоль/л (50-150мкг%), а ОЖСС – 30-85 мкМоль/л (300-360 мкг%).
Важное значение в лечении железодефицитной анемии имеет место устранение причин ее развития (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.), а также возмещение дефицита железа в крови и тканях и достижение полной клинико-гематологической ремиссии. В ряде случаев радикальное устранение причины железодефицитной анемии невозможно, и тогда основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
В качестве заместительной терапии при железодефицитной анемии используют препараты железа.
Терапия железодефицитной анемии при заболеваниях желудочно-кишечного тракта проводится преимущественно препаратами железа для перорального приема, за исключением случаев тяжелой мальабсорбции и состояний после резекции тонкой кишки.
Рекомендуемая ВОЗ оптимальная доза составляет 120 мг элементарного железа в сутки. Более высокие дозы не увеличивают эффективность, однако могут вызвать диспепсические явления вследствие раздражения желудочно-кишечного тракта. Лечение препаратами железа должно быть длительным.
Суточная доза для профилактики анемии и лечения легкой формы заболевания составляет 50-60 мг Fe2+, а для лечения выраженной анемии – 100-120 мг Fe2+.
При выборе препаратов железа необходимо учитывать и их состав.
В настоящее время существуют препараты двухвалентного и трехвалентного железа. По мнению специалистов, наибольшей биодоступностью обладает двухвалентная форма железа, именно поэтому старт терапии начинают с препаратов этой группы. Согласно проведенным клиническим исследованиям, терапия препаратами двухвалентного железа позволяет за более короткий временной интервал нормализовать показатели красной крови.
Таким образом, анемический синдром достаточно часто является «маской» многих распространенных и тяжелых заболеваний желудочно-кишечного тракта. Ключевыми моментами диагностики являются определение вида и причины развития анемии, а залогом успешного лечения служат своевременная терапия основного заболевания и правильная патогенетическая терапия с восполнением дефицита железа.
Источник
Хронические кровотечения, которые могут протекать без явных признаков выделения крови и получили название “скрытых” ЖКК, в отличие от острых кровотечений вызывают совсем другие патогенетические изменения в организме, которые со временем проявляются признаками железодефицитной анемии. Такие кровотечения обычно не вызывают нарушений геодинамики, но постепенно ведут к дефициту железа в организме. Потеря 10 мл крови равнозначна уменьшению запасов Fe в организме на 5 мг.
При нормальном питании за сутки человек усваивает из рациона 1,5-2,5 мг железа. Столько же он его теряет (мужчины – 1 мг/сутки, женщины – 2 мг/сутки) за счет шелушения эпителия кожи, слизистых оболочек, волос, ногтей и мочи, а у женщин еще и в результате mensis. Достаточный уровень Fe в организме поддерживается благодаря его круговороту (рис. 10) и экономному использованию.
Циркулируя в сыворотке крови на достаточно постоянном уровне (мужчины 8,95-28,64 мкмоль/л, а женщин – 7,16-26,85 мкмоль/л) железо в основном тратится на построение гемоглобина, который через 4 месяца разрушается и опять идет в обращение. Таким образом, атом Fe в организме сохраняется свыше 10 лет.
Потеря его при анемиях возобновляется слишком медленно (от 0,5 до 2,0 лет), в связи с ограниченным всасыванием в кишечнике, а введение повышенного количества препаратов железа непосредственно в кровь может вызывать тяжелые последствия в виде сидероза с необратимыми изменениями в печени, сердце, почках, одновременно с проявлениями токсикоза.
Основная масса железа в организме (70%) находится в составе гемоглобина, 15-25% связано с ферритином, который считается основным резервным запасом Fe. Остальные (8%) приходятся на миоглобин, железосодержащие ферменты (цитохромы, оксидазы и другие) и некоторые белки.

Рис. 10 Обращение железа в организме здорового человека
Ферритин, который является комплексом железа с белком апофоретином находится в клетках печенки, селезенке, костном мозге и ретикулоцитах, то есть в тех органах, где наиболее интенсивно протекают процессы синтеза, дозревания и деградации эритроцитов. Его растворимая внеклеточная форма плазменный ферритин, как почтальон, выполняет роль переносчика железа от ретикулоэндотелиальной системы к гепатоцитам, где синтезируется гемоглобин.
Концентрация ферритина в плазме четко коррелирует как с резервными запасами Fe, так и общим количеством его в организме. Таким образом, концентрация ферритина в крови снижается при уменьшении железа в организме и повышается соответственно с увеличением его в организме, превышая 400-500 нг/мл (в норме у мужчин – 20-350, а у женщин 10-150 нг/мл) а при выраженном гемохроматозе может достигать даже 10 000 нг/мл.
При кровопотере, когда возникает отрицательный баланс железа (рис. 11), потребности эритропоэза покрываются сначала за счет ферритина. Это сохраняет процесс эритропоэза, но вызывает сидеропению, то есть не хватает обеспечения железом образования миоглобина и других железосодержащих белков, включая ферменты (оксидазы, супероксидисмутазы, каталазы, цитохромы), что проявляется соответствующими метаболическими изменениями. Эти изменения можно считать начальной стадией в патогенезе железодефицитной анемии, которая возникла, в частности, в результате хронического ЖКК [С.М. Гайдукова, С.В. Видиборец, 2001].

Рис. 11 Патогенез хронического кровотечения
Если кровотечение продолжается, то наступает вторая стадия развития железодефицита, которая обусловлена отсутствием или значительным снижением железа в депо и также низким содержанием его в плазме. Это еще больше усиливает сидеропению, но ткани обеспечиваются кислородом удовлетворительно, потому что показатели гемоглобина и количества эритроцитов в периферийной крови остаются в норме. Следующая стадия развития железодефицита проявляется железодефицитной микроцитарной анемией и метаболическими, а также атрофическими изменениями в разных органах, особенно в головном мозгу, сердце, печени, в результате кислородного голодания тканей.
Таким образом, патогенез изменений, которые развертываются в организме при хроническом кровотечении, зависит в первую очередь от количества потерянного организмом железа, а затем в результате постепенного уменьшения гемоглобина дополняются изменениями вызванными нарушениями транспорта кислорода во все органы, где возникают разнообразные метаболические нарушения.
Степанов Ю.В., Залевский В.И., Косинский А.В.
Опубликовал Константин Моканов
Источник
Клиническая картина желудочно-кишечных кровотечений
Клиническая картина при желудочно-кишечных кровотечениях определяется темпом и объемом кровопотери. Кровопотеря 300-400 мл
(легкая) сопровождается проходящей тошнотой, сухостью во рту, слабостью,
познабливанием. Если нет рвоты, то больной может не обратить на эти симптомы
внимания. Наиболее постоянным симптомом кровопотери является позыв на дефекацию и
дегтеобразный стул. Такую кровопотерю организм обычно переносит легко за счет
включения механизмов саморегуляции и компенсации. Помимо выброса катехоламинов,
приводящих к спазму периферических сосудов и уменьшению сосудистого русла, благодаря
чему сохраняется достаточный кровоток в жизненно важных органах (мозг, миокард,
печень и др.), включается механизм аутогемодилюции. Этот механизм состоит в
мобилизации собственной межтканевой жидкости и выбросе ее в сосудистое русло, что
приводит к восстановлению ОЦК, уменьшению вязкости крови, вымыванию эритроцитов из
депо. Показатели крови быстро восстанавливаются, и повторное исследование крови в
последующие сроки может не выявить отклонения от нормы содержания гемоглобина,
эритроцитов и гематокрита.
Однако с 3-4 дня в периферической крови увеличивается количество ретикулоцитов в
результате активации эритропоэза. Положительная реакция кала на скрытую кровь после
однократной кровопотери сохраняется 2-3 недели, а мелена – от 3 до 5 суток.
При большой кровопотере (более 400 мл) или повторной кровопотере появляются симптомы
постгеморрагической анемии (внезапная слабость, тошнота, потливость, шум в ушах,
“мелькание мушек” перед глазами, сердцебиение, головокружение, обмороки, выявляется
бледность больного, холодный липкий пот, малый учащенный пульс, систолический шум на
верхушке, снижение АД, жажда, осиплость голоса, адинамия, олигурия). Подобные
симптомы нередко появляются раньше рвоты (типа кофейной гущи) и мелены. Происходит
разжижение крови в результате происходящих компенсаторно-приспособительных
механизмов, развивается нормохромная гиперрегенераторная анемия. Однако в первые часы
после значительной кровопотери содержание гемоглобина и эритроцитов существенно не
снижается. Это снижение начинается к концу первых суток и особенно прогрессирует под
влиянием трансфузионной терапии (полиглюкин и др.).
После однократного кровотечения анемия становится наиболее выраженной к концу первых
суток. При отсутствии положительной динамики со стороны показателей красной крови в
течение двух-трех суток после кровопотери, следует предположить продолжение
кровопотери или повторные кровотечения. Необходимо отметить, что при массивной
кровопотере повышается содержание мочевины и креатинина в крови, как результат
резорбции белка в кровь. Резорбционная азотемия закономерно возникает при массивной
кровопотере и быстро проходит, если кровотечение прекращается, особенно под влиянием
адекватных лечебных мероприятий. Иногда у больных повышается содержание билирубина,
снижается уровень протромбина и альбумина в крови. На второй день после кровопотери
может быть резорбционная лихорадка.
В.Г. Лычeв
“Объем кровопотери при желудочно-кишечном кровотечении, развитие анемии” раздел Желудочно-кишечные кровотечения
Дополнительная информация:
- Причины желудочно-кишечных кровотечений
- Вся информация по этому вопросу
Источник
Этиология и патогенез. Острая кровопотеря может быть прежде всего травматического происхождения при ранении сосудов более или менее крупного калибра. Она может зависеть и от разрушения сосуда тем или иным патологическим процессом: разрыв трубы при внематочной беременности, кровотечение из язвы желудка или двенадцатиперстной кишки, из варикозных вен нижнего отрезка пищевода при атрофическом циррозе печени, из варикозных расширений геморроидальных вен. Легочное кровотечение у больного туберкулезом, кишечное – при брюшном тифе могут быть также очень обильными и внезапными и вызвать большее или меньшее малокровие.
Уже простое перечисление различных по своей этиологии кровопотерь говорит о том, что и клиническая картина, и течение, и терапия будут различными в зависимости от общего состояния больного перед наступлением кровотечения: здоровый человек, получивший ранение, здоровая до того женщина после разрыва трубы при внематочной беременности, больной язвой желудка, не знавший раньше о своей болезни, при внезапном желудочном кровотечении будут реагировать аналогично. Иначе будут переносить кровопотерю больные циррозом, брюшным тифом или туберкулезом. Основная болезнь определяет фон, от которого в значительной степени зависит дальнейшее течение малокровия.
Острая потеря крови до 0,5 л здоровым, нестарым среднего веса человеком вызывает кратковременные, нерезко выраженные симптомы: небольшая слабость, головокружение. Повседневный опыт институтов переливания крови – сдача крови донорами – подтверждает это наблюдение. Потеря 700 мл крови и больше вызывает уже более резко выраженные симптомы. Считается, что кровопотеря, превышающая 50-65% крови, или более 4-4,5% веса тела, является безусловно смертельной.
При острой кровопотере смерть наступает и при меньших количествах излившейся крови. Во всяком случае острая потеря больше трети крови вызывает обморок, коллапс и даже смерть.
Имеет значение быстрота истечения крови. Потеря даже 2 л крови, происходящая на протяжении 24 часов, еще совместима с жизнью (по Феррата).
Степень анемизации, быстрота восстановления нормального состава крови зависят не только от величины потери крови, но и от характера ранения и наличия или отсутствия инфекции. В случаях присоединения анаэробной инфекции у раненых наблюдается наиболее резко выраженная и стойкая анемия, так как к анемии от кровопотери присоединяется усиленный гемолиз, обусловленный анаэробной инфекцией. У этих раненых наблюдается особенно высокий ретикулоцитоз, желтушность покровов.
Наблюдения в период войны над течением острого малокровия у раненых уточнили наши знания о патогенезе основных симптомов острой анемии и о развивающихся при этом компенсаторных механизмах.
Кровотечение из поврежденного сосуда останавливается в результате сближения краев раненого сосуда в связи с его рефлекторным сокращением, благодаря образованию тромба в области поражения. На важные факторы, способствующие остановке кровотечения, обратил внимание Н. И. Пирогов: уменьшается “напор” крови в артерии, кровенаполнение и кровяное давление в раненом сосуде, изменяется направление кровяной струи. Кровь направляется по другим, “обходным” путям.
В результате обеднения плазмы крови белками и падения числа клеточных элементов понижается вязкость крови, ускоряется ее оборот. В связи с уменьшением количества крови сокращаются артерии и вены. Повышается проницаемость сосудистых Мембран, что способствует усилению тока жидкости из тканей в сосуды. К этому присоединяется поступление крови из кровяных депо (печень, селезенка и пр.). Все эти механизмы улучшают кровообращение и снабжение кислородом тканей.
При остром малокровии уменьшается масса циркулирующей крови. Наступает обеднение крови эритроцитами, носителями кислорода. Минутный объем крови уменьшается. Наступает кислородное голодание организма в результате понижения кислородной емкости крови и нередко остро развивающейся недостаточности кровообращения.
Тяжелое состояние и смерть при остром кровотечении зависят в основном не от потери большого количества переносчиков кислорода – эритроцитов, а от ослабления кровообращения из-за обеднения сосудистой системы кровью. Кислородное голодание при острой кровопотере – гематогенно-циркуляторного типа.
Одним из факторов, компенсирующих последствия малокровия, является также и увеличение коэффициента утилизации кислорода тканями.
Изучением газообмена при остром малокровии занимался еще В. В. Пашутин и его ученики. М. Ф. Кандаратский уже в диссертации 1888 г. показал, что при высоких степенях малокровия газообмен не изменяется.
По данным М. Ф. Кандаратского, для минимального жизнепроявления достаточно и 27% общего количества крови. Имеющееся в норме количество крови позволяет организму удовлетворить потребность при максимальной работе.
Как показал И. Р. Петров, при больших потерях крови особенно чувствительны к недостатку кислорода клетки коры головного мозга и мозжечка. Кислородным голоданием объясняется начальное возбуждение и торможение в дальнейшем функции мозговых полушарий.
В развитии всей клинической картины малокровия и компенсаторно-приспособительных реакций организма огромное значение имеет нервная система.
Еще Н. И. Пирогов обращал внимание на влияние душевных волнений на силу кровотечения: “Страх, который наводит на раненого кровотечение, также препятствует остановиться крови и нередко служит к его возврату”. Отсюда Пирогов делал вывод и указывал, что “врач должен прежде всего нравственно успокоить больного”.
Нам в клинике пришлось наблюдать больную, у которой регенерация была заторможена после нервного потрясения.
Под влиянием кровопотери активируется костный мозг. При больших кровопотерях желтый костный мозг трубчатых костей временно превращается в активный – красный. Резко увеличиваются в нем очаги эритропоэза. Пункция костного мозга обнаруживает большие скопления эритробластов. Количество эритробластов в костном мозгу достигает громадных размеров. Эритропоэз в нем часто преобладает над лейкопоэзом.
В отдельных случаях регенерация крови после кровопотери может быть задержана в связи с рядом причин, из которых надо выделить неполноценное питание.
Патологическая анатомия. На секции при ранней гибели больного мы находим бледность органов, малое наполнение сердца и сосудов кровью. Селезенка мала. Мышца сердца бледна (мутное набухание, жировая инфильтрация). Под эндокардом и эпикардом мелкие кровоизлияния.
Симптомы. При острой массивной кровопотере больной становится бледным, как полотно, как при смертельном испуге. Наступает непреоборимая мышечная слабость. В тяжелых случаях наступает полная или частичная потеря сознания, одышка с глубокими дыхательными движениями, подергивания мышц, тошнота, рвота, зевота (анемия головного мозга), иногда икота. Обычно выступает холодный пот. Пульс частый, еле ощутимый, кровяное давление резко понижено. Имеется полная клиническая картина шока.
Если больной оправляется от шока, если он не погибнет от обильной кровопотери, то, придя в сознание, жалуется на жажду. Он пьет, если ему дают пить, и снова впадает в забытье. Постепенно улучшается общее состояние, появляется пульс, поднимается артериальное давление.
Жизнь организма, его кровообращение возможны только при определенном количестве жидкости в кровеносном русле. Вслед за потерей крови немедленно опорожняются резервуары крови (селезенка, кожа и прочие депо эритроцитов), в кровь поступает жидкость из тканей, лимфа. Отсюда понятен основной симптом – жажда.
Температура после острого кровотечения обычно не повышается. Небольшие ее повышения на 1-2 дня наблюдаются иногда после кровотечения в желудочно-кишечный тракт (например, при кровотечении из язвы желудка и двенадцатиперстной кишки). Повышения температуры до более высоких цифр бывают при кровоизлиянии в мышцы и серозные полости (плевра, брюшина).
Бледность покровов зависит от уменьшения количества крови – олигемии – и от сокращения кожных сосудов, наступающего рефлекторно и уменьшающего емкость кровяного русла. Ясно, что в первый момент после кровопотери по уменьшенному руслу будет течь кровь более или менее прежнего состава, наблюдается олигемия в буквальном смысле слова. При исследовании крови в этот период обнаруживают свойственное больному до кровопотери количество эритроцитов, гемоглобина и обычный для него цветной показатель. Эти показатели могут быть даже большими, чем до кровопотери: с одной стороны, при указанном уменьшении кровяного русла кровь может сгуститься, с другой – в сосуды из освобождающихся кровяных дело поступает кровь, более богатая форменными элементами. Кроме того, как указано выше, при сокращении сосудов из них выдавливается больше плазмы, чем форменных элементов (последние занимают центральную часть “кровяного цилиндра”).
Малокровие стимулирует функции кроветворных органов, поэтому костный мозг начинает с большей энергией вырабатывать эритроциты и выбрасывать их в кровь. В связи с этим в последующий период изменяется состав эритроцитов. При усиленной выработке и выбрасывании в кровь неполноценных в смысле насыщенности гемоглобином эритроцитов последние бледнее нормальных (олигохромия), различной величины (анизоцитоз) и различной формы (пойкилоцитоз). Размер эритроцитов после кровотечения несколько возрастает (сдвиг кривой Прайс-Джонса вправо). В периферической крови появляются более молодые красные кровяные тельца, не потерявшие еще полностью базофилию, полихроматофилы. Процент ретикулоцитов значительно поднимается. Как правило, полихроматофилия и увеличение количества ретикулоцитов развиваются параллельно, являясь выражением усиленной регенерации и усиленного поступления молодых эритроцитов в периферическую кровь. Стойкость эритроцитов к гипотоническим растворам поваренной соли сначала на короткое время понижается, а затем повышается в связи с выходом в периферическую кровь более молодых элементов. Могут появиться эритробласты. Цветной показатель в этот период понижается.
Скорость восстановления нормального состава крови зависит от количества потерянной крови, от того, продолжается ли кровотечение или нет, от возраста больного, от состояния его здоровья до потери крови, от основного страдания, вызвавшего кровопотерю, и, главное, от своевременности и целесообразности терапии.
Наиболее быстро восстанавливается нормальное число эритроцитов. Количество гемоглобина нарастает медленнее. Постепенно приходит к норме цветной показатель.
После большой кровопотери у здорового до того человека нормальное количество эритроцитов восстанавливается в 30-40 дней, гемоглобина – в 40-55 дней.
При анемии от кровопотери, в особенности после ранений, важно устанавливать срок, прошедший после ранения и потери крови. Так, по данным Ю. И. Дымшица, через 1-2 суток после проникающего ранения грудной клетки, сопровождающегося кровоизлиянием в полость плевры, в 2/3 случаев определяется менее 3,5 млн. эритроцитов в 1 мм3. Анемия имеет гипохромный характер: в 2/3 случаев цветной показатель меньше 0,7. Но уже через 6 дней количество эритроцитов ниже 3,5 млн. в 1 мм3 наблюдается меньше чем в 1/6 случаев (у 13 из 69 обследованных).
Вслед за происшедшим кровотечением обычно наступает умеренный нейтрофильный лейкоцитоз (12 000-15 000 лейкоцитов в 1 мм3), а также нарастает число кровяных пластинок и увеличивается свертываемость крови уже через 10 минут).
Значительно увеличивается в костном мозгу процент ретикулоцитов. Форсель считал, что степень ретикулоцитоза является наиболее тонким показателем регенераторной способности костного мозга.
Лечение. При остро наступившем малокровии терапевтическое вмешательство должно быть срочным. Организм страдает от недостатка крови и жидкости, который должен быть немедленно восполнен. Ясно, что наиболее действенным средством, если кровопотеря значительна, является переливание крови.
Переливанием крови достигается пополнение утраченной организмом жидкости, питательного материала, раздражение костного мозга, усиление функций его, гемостатическое действие, введение полноценных эритроцитов и фибрин-фермента. Переливают обычно 200-250 мл крови или более массивные дозы. При продолжающемся кровотечении дозу повторно переливаемой крови снижают до 150-200 мл.
В условиях боевой травмы при шоке с кровопотерей вливают 500 мл крови. При необходимости эту дозу увеличивают до 1-1,5 л. Перед переливанием крови применяются все меры для остановки кровотечения.
При кровотечении одинаковый результат дает переливание свежей и консервированной крови. В случае необходимости оно облегчает дальнейшее оперативное вмешательство (при язве желудка, внематочной беременности). Переливание крови показано при кровотечении из брюшнотифозной язвы и противопоказано, если кровотечение обусловлено разрывом аневризмы аорты. При кровотечениях из легких у больных туберкулезом переливание крови не дает ясных результатов и обычно не применяется. Для остановки кровотечения с успехом применяют вливание в вену плазмы крови.
По данным Л. Г. Богомоловой, можно пользоваться сухой плазмой, полученной высушиванием при низкой температуре и растворяемой перед вливанием в дистиллированной стерильной воде.
Применяемые физиологический раствор хлористого натрия (0,9%) и различные смеси растворов солей заменителями крови не являются. Значительно лучшие результаты получаются при введении в вену солевых смесей, к которым прибавлены коллоиды, родственные данному организму.
Введение в вену кровезамещающих жидкостей и крови должно производиться обязательно медленно. Необходимая скорость вливания, – 400 мл в течение 15 минут при здоровом сердце и здоровой сосудистой системе. При нарушениях кровообращения необходимо применять капельный метод введения. Несоблюдение этих правил может явиться источником нежелательных реакций на вливание и осложнений.
В более поздние сроки основным методом лечения является применение железа. Хорошим подспорьем является мышьяк.
Кроме того, необходим постельный режим, полноценное питание с достаточным содержанием витаминов, в частности витамина С. Как показывают наблюдения, для быстрого восстановления крови у доноров необходимо содержание в суточном пайке не менее 50-60 мг аскорбиновой кислоты.
Небезынтересны методы остановки кровотечения, применявшиеся в прежнее время русской народно-бытовой медициной. Сок сырой морковки и редьки рекомендовалось пить при цинге. Сок редьки, свеклы и капусты употреблялся при кровохарканье у больных туберкулезом.
Женский журнал www.BlackPantera.ru:
М. Тушинский
Источник
