Патогенез железодефицитной анемии патфиз
Железодефицитная
анемия — анемия, вызванная недостатком
железа в организме в результате нарушения
баланса между его поступлением,
использованием и потерей. Это самый
распространенный вид анемии (80% всей
заболеваемости анемиями).
Этиология.
Наиболее частой причиной развития
железодефицитной анемии (ЖДА) являются
повторные и длительные, иногда массивные
однократные кровотечения, приводящие
к потере железа вместе с эритроцитами.
Чаще всего это наблюдается при маточных,
реже — желудочно-кишечных, почечных,
легочных кровотечениях, при геморрагическом
синдроме
ЖДА
может возникать при нарушении поступления
железа с пищей (при кормлении детей
только коровьим или козьим молоком) и
повышенном расходе железа в период
роста, созревания организма, при
беременности, лактации. Кроме того,
причиной развития ЖДА служит снижение
всасывания железа при заболеваниях
пищевого канала (гипоацидный гастрит,
хронический энтерит) или резекции его
отделов, а также нарушение транспорта
железа (гипотрансферринемия при поражении
печени, наследственная атрансферринемия1),
его утилизации из резервов2
(при инфекции, интоксикации, глистной
инвазии) и депонировании (при гепатитах,
циррозе печени).
Патогенез.
Экзогенный или эндогенный дефицит
железа в организме характеризуется
уменьшением и постепенным истощением
резервов железа, что проявляется
исчезновением гемосидерина в макрофагоцитах
печени и селезенки, снижением до 2—5% в
костном мозге количества сидеробластов
(клетки, содержащие железо в виде гранул
ферритина; их число в норме — 20—40%). В
крови понижается концентрация
сывороточного железа (ги п о си де р е м
и я достигает 1,8— 2,7 мкм/л вместо 12,5 —
30,4 мкм/л в норме) и степень насыщения им
трансферрина, что приводит к уменьшению
транспорта железа в костный мозг.
Нарушается включение железа в
эритроцитарные клетки, снижается синтез
гема в гемоглобине и некоторых
железосодержащих и железозависимых
ферментов (каталазы, глутатионпероксидазы)
в эритроцитах, что повышает их
чувствительность к гемолизирующему
действию окислителей. Увеличивается
неэффективный эритропоэз вследствие
возросшего гемолиза эритрокариоцитов
в костном мозге и эритроцитов в крови.
Продолжительность жизни эритроцитов
уменьшается.
В
организме при железодефицитной анемии
возникают компенсаторные реакции —
усиление абсорбции железа в пищевом
канале, повышение концентрации
трансферрина, гиперплазия эритроцитарного
ростка, увеличение интенсивности
гликолиза и активности 2,3-дифосфоглицерата
в эритроцитах, способствующее лучшей
отдаче кислорода тканям. Однако эти
реакции оказываются недостаточными,
чтобы восполнить дефицит железа в
организме и улучшить кислородтранспортную
функцию крови при уменьшении общего
количества эритроцитов и содержания в
них гемоглобина. Возникают морфологические
изменения в эритроцитарных клетках
костного мозга: гипохромия, связанная
с недостаточной гемоглобинизацией,
преобладание базофильных нормобластов
над ацидофильными в костном мозге,
микроцитоз, деструкция ядерных клеток
(нарушение митоза, кариорексис,
вакуолизация цитоплазмы эритробластов
и нормобластов).
Наряду
с патологическими изменениями эритропоэза
дефицит железа в организме приводит к
уменьшению миоглобина и активности
железосодержащих ферментов тканевого
дыхания. Следствием гемической и тканевой
гипоксии при железодефицитной анемии
являются атрофические и дистрофические
процессы в тканях и органах, особенно
выраженные в пищевом канале (глоссит,
гингивит, кариес зубов, поражение
слизистой оболочки пищевода, атрофический
гастрит с ахилией) и сердце (дистрофия
миокарда).
Картина
крови.
Железодефицитная анемия — это анемия
с эритробластическим типом кроветворения,
гипохромная с низким цветовым показателем
(0,6 и меньше). Количество гемоглобина
снижается в большей степени, чем число
эритроцитов. Для мазка крови характерны
гипохромия, “тени” эритроцитов,
анулоциты, микроцитоз, пойкилоцитоз.
Количество ретикулоцитов зависит от
регенераторной способности эритроцитарного
ростка (регенераторная или чаще
гипорегенераторная анемия).
Соседние файлы в предмете Патологическая физиология
- #
- #
- #
- #
- #
- #
- #
26.01.20181.49 Mб56Лечки кратко (Не Кокорева).wiz
- #
- #
- #
- #
Дефицит железа — наиболее распространенное во всем мире расстройство, связанное с дефицитом питания. Железодефицитная анемия больше распространена в развивающихся странах, но эта форма анемии часто встречается в США, особенно у детей младшего возраста, молодых девушек и женщин в репродуктивном возрасте. Факторы, лежащие в основе железодефицитной анемии, в разных популяционных группах несколько различаются, и эти факторы лучше рассматривать в контексте нормального метаболизма железа.
а) Метаболизм железа. Среднесуточная диета в западных странах обычно содержит 10-20 мг железа, в основном в виде гема, присутствующего в продуктах животного происхождения (оставшаяся часть представляет собой неорганическое железо в растительной пище). Всасывается 20% железа, входящего в состав гема (гемовое железо), и 1-2% железа, не входящего в состав гема (негемовое железо).
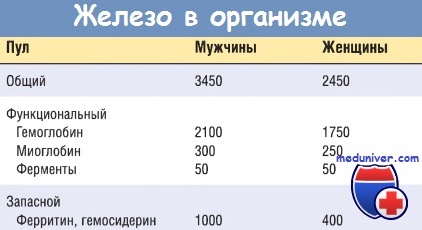
Таким образом, среднего содержания железа в диете западных стран достаточно, чтобы сбалансировать его ежедневную потерю. Общее содержание железа в организме в норме составляет 2 г у женщин и до 6 г у мужчин. Выделяют функциональный и запасной пулы железа. Около 80% функционального железа находятся в гемоглобине, остальные 20% приходятся на долю миоглобина и железосодержащих ферментов, таких как каталаза и цитохромы.
Запасной пул, состоящий из гемосидерина и ферритина, содержит от 15 до 20% общего железа организма. Этот пул у здоровых молодых женщин меньше, чем у мужчин, главным образом из-за потери крови во время менструаций, но дефицит железа у женщин часто наблюдается в результате обильных менструаций или при повышенной потребности в железе во время беременности.
В организме происходит интенсивный обмен (рециклирование) железа между функциональным и запасным пулами. Железо в плазме транспортирует железосвязывающий гликопротеин (трансферрин), синтезируемый в печени. У здоровых людей трансферрин на 35% насыщен железом, и нормальный уровень железа в сыворотке составляет в среднем 120 мкг/дл у мужчин и 100 мкг/дл у женщин. Главная функция трансферрина — доставка железа клеткам, включая эритроидные клетки-предшественники, которым железо необходимо для синтеза гемоглобина. Эритроидные клетки-предшественники имеют высокоаффинные рецепторы трансферрина, опосредующие импорт железа путем эндоцитоза.
Свободное железо высокотоксично, поэтому важно, чтобы железо запасного пула было секвестрировано. Это осуществляется путем прочного связывания железа запасного пула с ферритином или гемосидерином. Ферритин представляет собой распространенный во всех тканях организма комплекс белок-железо, в наибольшем количестве присутствующий в печени, селезенке, костном мозге и скелетных мышцах. В печени большая часть ферритина находится в гепатоцитах. В других тканях, в частности селезенке и костном мозге, ферритин содержится в макрофагах. Гематоциты получают железо из плазмы крови, тогда как железо в макрофагах накапливается в результате разрушения эритроцитов.
В клетках ферритин содержится в цитозоле и лизосомах, в которых частично деградированная белковая оболочка ферритина агрегирует в гранулы гемосидерина. Железо в составе гемосидерина метаболически активно и окрашивается в сине-черный цвет при воздействии ферроцианида калия, составляющего основу красителя берлинская лазурь. В нормальных условиях в организме обнаруживаются лишь следовые количества гемосидерина, в основном в макрофагах костного мозга, селезенки и печени. В перегруженных железом клетках большая часть железа хранится в виде гемосидерина.
Поскольку ферритин поступает в плазму главным образом из запасного пула, уровень железа в плазме хорошо коррелирует с запасами железа в организме. При дефиците железа уровень ферритина в сыворотке всегда ниже 12 мкг/л, тогда как при перегрузке железом этот показатель достигает 5000 мкг/л. Физиологическое значение запасного пула железа состоит в том, что оно может быть быстро мобилизовано в случае возрастания потребности в нем, например после кровопотери.
Баланс железа поддерживается в основном за счет регуляции абсорбции алиментарного железа в проксимальном отделе двенадцатиперстной кишки. Железо необходимо для клеточного метаболизма, но высокотоксично в избытке, поэтому общие запасы железа в организме должны тщательно регулироваться. Не существует регулируемого пути экскреции железа, которая ограничена 1-2 мг/сут за счет слущивания эпителиальных клеток слизистой оболочки и кожи. По мере возрастания запасов железа абсорбция падает и наоборот. Пути, ответственные за абсорбцию железа, к настоящему времени изучены достаточно детально и немного различаются у гемового и негемового.
Негемовое железо в просвете кишечника находится главным образом в трехвалентном состоянии (Fe3+) и сначала должно быть восстановлено до двухвалентного (Fe21) посредством ферриредуктаз — цитохрома В и STEAP3. Затем Fe2+ транспортируется через апикальную мембрану двухвалентным металлотранспортером 1. Абсорбция негемового железа вариабельна и часто неэффективна; ее могут подавлять вещества, присутствующие в пище и стабилизирующие Fe3+, и усиливать агенты, стабилизирующие Fe2+. Часто абсорбируются менее 5% негемового железа из пищи.
В отличие от этого количество абсорбируемого гемового железа из гемоглобина, миоглобина и других продуктов животного происхождения достигает 25%. Гемовое железо переходит через апикальную мембрану в цитоплазму с помощью транспортеров, характеристики которых изучены не до конца. Здесь оно метаболизируется с высвобождением Fe2+, которое поступает в общий пул вместе с Fe2+, высвобожденным из негемового железа. Поступившее в дуоденальные клетки железо может транспортироваться в кровь или нет, что зависит от запасов железа в организме. Fe2+, предназначенное для поступления в циркуляцию, транспортируется из цитоплазмы через базолатеральную мембрану энтероцитов ферропортином. Этот процесс сопряжен с окислением Fe2+ до Fe3+, осуществляемым ферриоксидазами гефестином и церулоплазмином.
Вновь абсорбируемое Fe3+ быстро связывается с белком плазмы трансферрином, который доставляет железо клеткам-предшественникам эритроцитов в костном мозге.
Двухвалентный металлотранспортер 1 и ферропортин, широко распространенные в организме, участвуют в транспорте железа в другие ткани. Например, двухвалентный металлотранспортер 1 опосредует поступление функционального железа, высвободившегося из эндоцитированного трансферрина, в цитозоль клеток-предшественников эритроцитов в костном мозге через мембраны лизосом, а ферропортин играет важную роль в высвобождении железа из запасного пула в макрофагах.
Абсорбцию железа регулирует гепсидин — небольшой циркулирующий пептид, синтезируемый в печени и высвобождаемый в ответ на повышение уровня железа в печени. Гепсидин ингибирует перенос железа из энтероцитов в плазму, связывая ферропортин и вызывая его эндоцитоз и деградацию. В результате, как только уровень гепсидина возрастает, железо захватывается дуоденальными клетками в форме ферритина слизистых оболочек и утрачивается при отторжении этих клеток. Таким образом, когда организм переполняется железом, высокий уровень гепсидина ингибирует его абсорбцию в кровь.
И наоборот, при низких запасах железа в организме синтез гепсидина падает, и это облегчает абсорбцию железа. Ингибируя ферропортин, гепсидин не только снижает захват железа из энтероцитов, но и супрессирует высвобождение железа из макрофагов, которые представляют собой важный источник железа, используемого эритроидными клетками-предшественниками для синтеза гемоглобина. Это обстоятельство играет важную роль в патогенезе анемии при хронических заболеваниях.
Изменение уровня гепсидина имеет первостепенное значение при заболеваниях, сопровождающихся нарушениями метаболизма железа. Как будет указано далее, анемию при хронических заболеваниях частично вызывают воспалительные медиаторы, повышающие продукцию гепсидина в печени. Редкую форму микроцитарной анемии вызывают мутации, блокирующие TMPRSS6 — печеночную трансмембранную серинпротеазу, в норме супрессирующую продукцию гепсидина, когда запасы железа снижены.
У пациентов с такой мутацией повышен уровень гепсидина, что приводит к падению абсорбции железа и отсутствию ответа на терапию железосодержащими препаратами. И наоборот, активность гепсидина несоразмерно низка как при первичном, так и при вторичном гемохроматозе — синдроме, возникающем при системной перегрузке железом. Вторичный гемохроматоз может развиться при заболеваниях, ассоциированных с неэффективным гемопоэзом, например при большой b-талассемии и МДС. Посредством еще недостаточно изученных механизмов неэффективный эритропоэз супрессирует образование гепсидина в печени даже при высоком уровне запасов железа. Как указано в главе 18, различные наследственные формы первичного гемохроматоза ассоциируются с мутациями гепсидина или генов, регулирующих его экспрессию.

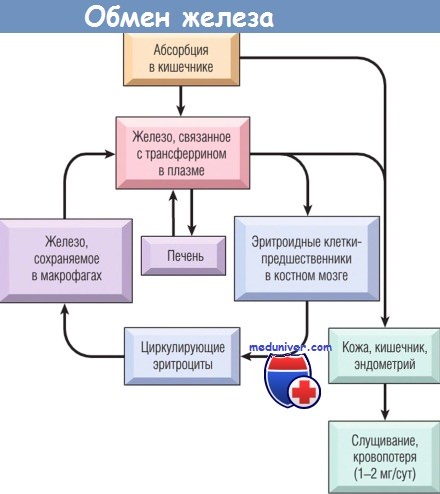
Метаболизм железа.
Железо, абсорбированное из кишечника, связывается с трансферрином плазмы и транспортируется в костный мозг,
где доставляется развивающимся эритроцитам и включается в гемоглобин.
Зрелые эритроциты поступают в кровоток, и через 120 сут их захватывают и разрушают макрофаги,
главным образом в селезенке, печени и костном мозге.
Там железо высвобождается из гемоглобина и включается в новый цикл, связываясь с трансферрином плазмы.
Количество абсорбируемого из кишечника железа сбалансировано его потерей за счет слущивания кератиноцитов,
энтероцитов и клеток эндометрия (у женщин).
б) Этиология. Причинами дефицита железа могут быть:
(1) недостаток железа в пище;
(2) нарушение абсорбции;
(3) повышенная потребность в железе;
(4) хроническая кровопотеря (что наиболее важно).
Чтобы поддерживать нормальный баланс железа, каждые сутки из пищи должно абсорбироваться 1 мг железа. Поскольку из поступающего с пищей железа абсорбируется только 10-15%, то ежедневно в организм взрослого мужчины должно поступать 7-10 мг железа, а взрослой женщины — 7-20 мг. Среднесуточный прием железа с пищей в западных странах составляет 15-20 мг, это количество для большинства мужчин избыточно, а для многих женщин — минимально необходимо. Биодоступность железа в пище — столь же важный фактор, как и его общий уровень.
Железо гема абсорбируется в гораздо большей степени, чем неорганическое железо, на абсорбцию которого влияют другие компоненты пищи. Абсорбцию неорганического железа повышают аскорбиновая кислота, лимонная кислота, аминокислоты и сахара, присутствующие в пище, а ингибируют абсорбцию соли дубильной кислоты (содержатся в чае), карбонаты, оксалаты и фосфаты.
Недостаток железа в пище редко встречается в развитых странах, где 65% алиментарного железа представлено в легко абсорбируемой гемовой форме, обеспечиваемой мясной пищей. Иное наблюдается в развивающихся странах, где источником железа служит в основном растительная пища, в которой оно присутствует в плохо абсорбируемой неорганической форме. Недостаток железа в пище отмечается в особых группах населения:
– грудные дети, составляющие группу высокого риска вследствие очень малого содержания железа в грудном молоке. Грудное молоко человека содержит лишь ~ 0,3 мг/л железа. Количество железа в коровьем молоке в 2 раза выше, однако его биодоступность низкая;
– бедные люди, питание которых недостаточно в любом возрасте вследствие социально-экономических причин;
– пожилые люди, употребляющие мало мяса в силу низких доходов или плохого состояния зубов;
– подростки, употребляющие нездоровую (суррогатную) пищу.
Нарушение абсорбции происходит при спру, стеаторее и хронической диарее. Гастрэктомия ухудшает абсорбцию, уменьшая содержание соляной кислоты и время прохождения пищи через двенадцатиперстную кишку. Как указано ранее, на абсорбцию влияют также специфические компоненты пищи.
Повышенная потребность в железе служит важной причиной его дефицита у детей и подростков, а также у женщин во время беременности и в период предменопаузы. Женщины из бедных слоев общества, много и часто рожающие, имеют крайне высокий риск развития дефицита железа.
Наиболее распространенной причиной дефицита железа в западных странах является хроническая кровопотеря. Наружное кровотечение или геморрагии в желудочно-кишечный, мочевой либо половой тракты истощают запасы железа. При дефиците железа у взрослых мужчин и женщин после менопаузы в западных странах следует прежде всего думать о кровотечении в желудочно-кишечном тракте, если не доказано иное. Сразу же пытаться объяснить дефицит железа у таких лиц другими причинами — значит пропустить скрытый рак органов пищеварения или другое поражение с кровотечением.
При внимательном клиническом исследовании пациента с необъяснимой железодефицитной анемией иногда обнаруживают скрытое кровотечение или опухоль и тем самым спасают жизнь больного.
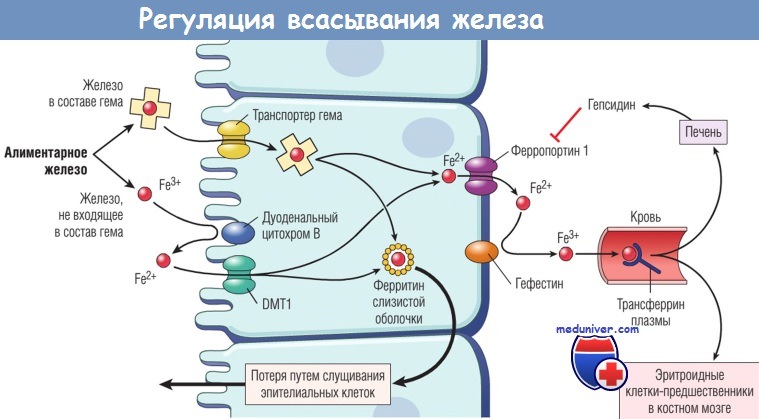
Регуляция абсорбции железа.
Показан захват железа эпителиальными клетками двенадцатиперстной кишки.
Если запасов железа в организме достаточно и эритропоэтическая активность в норме, уровень гепсидина в плазме повышается.
Это ведет к снижению уровня ферропортина и захватыванию абсорбированного железа,
которое утрачивается при слущивании эпителиальных клеток двенадцатиперстной кишки.
И наоборот, когда запасы железа в организме уменьшаются или усиливается эритропоэз,
уровень гепсидина падает и активность ферропортина возрастает,
в результате чего большее количество абсорбированного железа переносится на ферритин плазмы.
DMT1 — двухвалентный металлотранспортер 1.
в) Патогенез. Независимо от причин дефицит железа приводит к микроцитарной гипохромной анемии. В начале хронической кровопотери или развития других состояний на фоне отрицательного баланса железа его резервов в форме ферритина и гемосидерина может быть достаточно, чтобы поддержать нормальные уровни гемоглобина, гематокрита, железа в сыворотке и насыщение им трансферрина. В результате прогрессирующего истощения этих резервов сначала снижаются уровни железа в сыворотке и насыщения им трансферрина, не вызывая анемии. На этой ранней стадии возрастает эритроидная активность в костном мозге.
Анемия появляется лишь тогда, когда запасы железа истощены полностью, что сопровождается снижением содержания железа в сыворотке, ферритина и уровня насыщения железом трансферрина.
г) Морфология. В костном мозге повышается (от низкого уровня до умеренного) количество эритроидных клеток-предшественников. Диагностически важным признаком служит отсутствие железа в макрофагах костного мозга, лучше всего определяемое с помощью окрашивания аспиратов костного мозга берлинской лазурью. В мазках периферической крови эритроциты выглядят небольшими (микроцитарными) и бледными (гипохромными). Нормальные эритроциты с достаточным содержанием гемоглобина имеют центральную зону просветления величиной примерно 1/3 диаметра клетки.
При развившейся железодефицитной анемии эта зона увеличена, а гемоглобин виден лишь как узкий ободок. Характерным является также пойкилоцитоз.
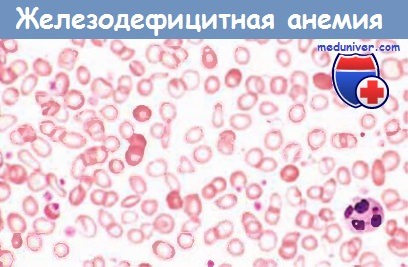
Микроцитарная гипохромная железодефицитная анемия (мазок периферической крови).
Обратите внимание на мелкие эритроциты с узким ободком из гемоглобина.
Некоторые из них имеют вытянутую форму («клетки-карандаши»).
От этих клеток разительно отличаются немногочисленные, содержащие нормальное количество гемоглобина эритроциты,
присутствующие в крови пациента после недавно проведенной гемотрансфузии.
д) Клинические признаки. Клинические проявления анемии неспецифичны и подробно были описаны ранее. Доминирующие признаки и симптомы часто обусловлены причинами развития анемии, например желудочно-кишечными или гинекологическими заболеваниями, недостаточным питанием, беременностью и мальабсорбцией. При тяжелом и продолжительном дефиците железа истощение железосодержащих ферментов в клетках всего организма проявляется также койлонихией (вогнутые ногти), алопецией, атрофическими изменениями языка и слизистой оболочки желудка и кишечной мальабсорбцией.
Снижение количества железа в центральной нервной системе может привести к извращению аппетита (пикацизму), при котором больные начинают употреблять в пищу несъедобные предметы, например глину, или такие пищевые ингредиенты, как мука. У больных периодически отмечаются движения нижних конечностей во время сна. Дегенерация мышц пищевода, микроцитарная гипохромная анемия и атрофический глоссит — триада главных признаков редкого синдрома Пламмера-Винсона.
Диагноз «железодефицитная анемия» основывают на данных лабораторных исследований. Уровни гемоглобина и гематокрита обычно умеренно снижены. Также наблюдаются микроцитоз, гипохромия и умеренная степень пойкилоцитоза. Содержание железа и ферритина в сыворотке снижено, а общая железосвязывающая способность плазмы, отражающая уровень трансферрина, высока. Низкий уровень железа в сыворотке в совокупности с повышенной железосвязывающей способностью плазмы приводит к падению насыщения трансферрина ниже 15%. Уменьшение запасов железа ингибирует синтез гепсидина, и его уровень в сыворотке снижается.
При неосложненном дефиците железа терапия железосодержащими препаратами per os примерно через 5-7 сут приводит к повышению количества ретикулоцитов, затем наблюдается постепенное увеличение количества эритроцитов и нормализация показателей красной крови.
– Рекомендуем ознакомиться со следующей статьей “Механизмы развития (патогенез) анемии из-за хронического заболевания”
Оглавление темы “Патогенез анемий”:
- Механизмы развития (патогенез) серповидно-клеточной анемии
- Механизмы развития (патогенез) бета-талассемии
- Механизмы развития (патогенез) альфа-талассемии
- Механизмы развития (патогенез) пароксизмальной ночной гемоглобинурии
- Механизмы развития (патогенез) иммуногемолитической анемии
- Механизмы развития (патогенез) мегалобластной анемии
- Механизмы развития (патогенез) пернициозной анемии
- Механизмы развития (патогенез) анемии при дефиците фолиевой кислоты
- Механизмы развития (патогенез) железодефицитной анемии
- Механизмы развития (патогенез) анемии из-за хронического заболевания
