Перенос газов кровью гемоглобин

Кровь
служит переносчиком кислорода из
альвеолярного воздуха к тканям и двуокиси
углерода от тканей тела к легочным
альвеолам. Количество газа, растворяющегося
в крови, зависит от следующих факторов:
состав жидкости, объем и давление газа
вне жидкости, температура жидкости и
физические свойства данного газа. Для
определения степени растворимости газа
введен показатель — коэффициент
растворимости. Он отражает объем газа,
который может раствориться в 1 мл жидкости
при температуре 0 °С и давлении его,
равном 760 мм рт. ст. Если над жидкостью
находится несколько газов, то каждый
из них растворяется соответственно его
парциальному давлению.
Парциальное
давление —
это часть общего давления газовой смеси,
приходящегося на долю того или иного
газа смеси. Парциальное давление можно
узнать, если известны давление газовой
смеси и процентный состав данного газа.
Если общее давление газовой смеси
обозначить Р (мм рт. ст.), а содержание
газа — а (в объемных процентах), то
парциальное давление газа р можно найти
по формуле Дальтона: р = р -T7J7J-,
за
вычетом давления водяного пара — 47 мм
рт. ст. Например, при атмосферном давлении
воздуха 760 мм рт. ст. парциальное давление
кислорода составит примерно 21 % (от 760
мм), т. е. 159 мм рт. ст., азота — 7 9 % (от 760
мм), т. е. 596 мм рт. ст.
Если
газы растворены в жидкости, то применяют
термин «напряжение»,
что
аналогично понятию «парциальное
давление». У млекопитающих животных
напряжение кислорода в крови ниже
атмосферного. Так, в атмосферном воздухе
оно равно 150 мм рт. ст., а при переходе
его в клетки — нескольким миллиметрам,
причем уровень напряжения кислорода
непосредственно связан с местом его
нахождения в данный период дыхания
(альвеолярный воздух, артериальная и
венозная кровь).
Связывание и перенос кислорода кровью.
Кислород,
поступающий в кровь, поглощается плазмой
в незначительном количестве, основная
же его часть переходит в эритроциты,
где
связывается с гемоглобином (НЬ) и образует
с кислородом непрочное, легко диссоциирующее
соединение — оксигемоглобин — НЬ02.
Связывание кислорода гемоглобином
зависит от напряжения кислорода в крови
и является легкообратимым процессом.
При понижении напряжения кислорода
оксигемоглобин отдает кислород.
Соотношение между парциальным давлением
и количеством образовавшегося
оксигемоглобина можно выразить кривой
диссоциации оксигемоглобина, напоминающей
по форме гиперболу. Нижняя часть кривых
характеризует свойства гемоглобина в
зоне низкого парциального давления
кислорода,
которые близки к имеющимся в тканях.
Средняя частькривой создает представление
о свойствах гемоглобина при тех величинах
напряжения кислорода, которые имеются
в венозной крови, а верхняя ее часть
соответствует условиям, имеющимся в
альвеолах легких. При парциальном
давлении кислорода 80—100 мм рт. ст., то
есть в тех условиях, которые имеются в
альвеолах, он быстро поступает в кровь,
и образуется оксигемоглобин. При низких
парциальных давлениях кислорода, как
это происходит в тканях, оксигемоглобин
распадается, и кислород, освобождаясь,
переходит в ткани.
На
связывание кислорода гемоглобином
влияет наличие двуокиси углерода. При
одном и том же парциальном давлении в
присутствии окиси углерода меньше
связывается кислорода и кривая диссоциации
оксигемоглобина смещается вправо. В
связи с этим поступление С 0 2 из тканей
в кровь облегчает освобождение кислорода
из оксигемоглобина и переход его в
ткани. Наоборот, выделение из крови С 0
2 в легких способствует связыванию
кислорода гемоглобином.
В
снабжении мышц кислородом при напряженной
работе важную роль играет внутримышечный
пигмент миоглобин, который дополнительно
связывает кислород. Связь кислорода с
миоглобином более прочная, чем с
гемоглобином. При этом существенное
значение имеют ферментативные
внутриклеточные процессы.
Количество
кислорода, которое может быть связано
100 мл крови при полном переходе гемоглобина
крови (НЬ) в оксигемоглобин (НЬ02 ),
составляет кислородную
емкость крови. 1
г гемоглобина может связать 1,34 % мл
кислорода, следовательно, если в крови
содержится 14 % гемоглобина, то она
способна связать 19 мл кислорода. У
большинства животных кислородная
емкость крови составляет 14,2—19,8 об %.
Связывание
и перенос углекислого газа кровью.
В
венозной крови содержится 50—58 об %
двуокиси углерода, причем наибольшая
ее часть содержится в плазме и эритроцитах
в виде угольной кислоты, около 2,5 об % —
в растворенном состоянии и 4—5 об %
связано с гемоглоби: ном в виде
карбогемоглобина.
Образующаяся
в тканях двуокись углерода легко
диффундирует в кровь сосудистых
капилляров большого круга кровообращения,
так как напряжение С 0 2 в тканях значительно
выше его напряжения в артериальной
крови. Двуокись углерода, растворяясь
в плазме, диффундирует внутрь эритроцитов,
где она под влиянием фермента карбоангидразы
превращается в угольную кислоту: С 0 2 +
Н 2 О ^ Н 2 С 0 3 . Поскольку вся двуокись
углерода в эритроцитарной плазме
переходит в угольную кислоту, напряжение
С 0 2 внутри эритроцитов падает до нуля.
В
связи с этим в эритроциты постоянно
поступают новые порции СОг, концентрация
ионов НС03 , образующихся в эритроцитах,
возрастает, и эти ионы начинают
диффундировать в плазму. Здесь они
присоединяют Na, образуя ЫаНСОз,
освобождающийся хлор проникает в
эритроциты.
Оксигемоглобин
имеет константу диссоциации в 70 раз
большую, чем дезоксигемоглобин.
Оксигемоглобин — более сильная кислота,
чем угольная, а дезоксигемоглобин —
более слабая. Поэтому в артериальной
крови оксигемоглобин, вытеснивший ионы
К + из бикарбонатов, переносится в виде
соли КНЬ02 . В тканевых капиллярах часть
КНЬ02 отдает кислород и превращается в
КНЬ. Из него угольная кислота, как более
сильная, вытесняет ионы К + : КНЬ02 + Н 2 С
0 3 = КНЬ + 0 2 + -г-КНСОзТ
Таким
образом, превращение оксигемоглобина
в гемоглобин сопровождается увеличением
способности крови связывать двуокись
углерода. Это явление получило название
эффекта
Холдена. Гемоглобин
служит источником катионов К+, необходимых
для связывания угольной кислоты в форме
бикарбонатов. В эритроцитах тканевых
капилляров образуется дополнительное
количество бикарбоната калия, а также
карбогемоглобин, а в плазме крови
увеличивается количество бикарбоната
натрия.
Бикарбонат
с кровью попадает з капилляры малого
круга кровообращения, где в эритроцитах
происходит обратная реакция, и
освобождающаяся двуокись углерода из
крови поступает по законам диффузии в
альвеолярный воздух.
Газообмен
в легких.
Обмен
газов между альвеолярным воздухом и
венозной кровью малого круга кровообращения
происходит вследствие разницы парциальных
давлений кислорода (102—40 = 62 мм рт. ст.)
и двуокиси углерода (47 — 40 = 7 мм рт. ст.).
Эта разница вполне достаточна для
быстрой диффузии газов на поверхности
соприкосновения стенки капилляров с
альвеолярным воздухом . Двуокись углерода
диффундирует через альвеолы примерно
в 25 раз быстрее кислорода, поэтому
достаточно разности давлений всего в
0,03 мм рт. ст. Даже при разнице в давлении
0 2 в 30— 35 мм через 1 см2 альвеол проходит
за минуту 6,7 см3 , а через всю поверхность
альвеол человека — 6000 см3 кислорода.
Такая скорость и величина диффузии
кислорода полностью обеспечивают
максимальную интенсивную физическую
работу.
Соседние файлы в предмете Физиология животных
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Кровь переносит кислород и углекислый газ. В крови, как и во всякой жидкости, газы могут находиться в двух состояниях: в физически растворенном и химически связанном. И кислород и углекислый газ в очень небольшом количестве растворяются в плазме крови. Большая часть кислорода и углекислого газа переносится в химически связанном виде.
Основной переносчик кислорода – гемоглобин крови. 1 г гемоглобина связывает 1,34 мл кислорода. Гемоглобин обладает способностью вступать в соединение с кислородом, образуя оксигемоглобин. Чем выше парциальное давление кислорода, тем больше образуется оксигемоглобина. В альвеолярном воздухе парциальное давление кислорода 100-110 мм рт. ст. При таких условиях 97% гемоглобина крови связывается с кислородом. Кровь приносит к тканям кислород в виде оксигемоглобина. Здесь парциальное давление кислорода низкое, и оксигемоглобин – соединение непрочное – высвобождает кислород, который используется тканями. На связывание кислорода гемоглобином оказывает влияние и напряжение углекислого газа. Углекислый газ уменьшает способность гемоглобина связывать кислород и способствует диссоциации оксигемоглобина. Повышение температуры также уменьшает возможности связывания гемоглобином кислорода. Известно, что температура в тканях выше, чем в легких. Все эти условия помогают диссоциации оксигемоглобина, в результате чего кровь отдает высвободившийся из химического соединения кислород в тканевую жидкость.
Свойство гемоглобина связывать кислород имеет жизненно важное значение для организма. Иногда люди гибнут от недостатка кислорода в организме, окруженные самым чистым воздухом. Это может случиться с человеком, оказавшимся в условиях пониженного давления (на больших высотах), где в разреженной атмосфере очень низкое парциальное давление кислорода. 15 апреля 1875 г. воздушный шар “Зенит”, на борту которого находились три воздухоплавателя, достиг высоты 8000 м. Когда шар приземлился, то в живых остался только один человек. Причиной гибели людей было резкое снижение парциального давления кислорода на большой высоте. На больших высотах (7-8 км) артериальная кровь по своему газовому составу приближается к венозной; все ткани тела начинают испытывать острый недостаток в кислороде, что и приводит к тяжелым последствиям. Подъем на высоту более 5000 м обычно требует пользования особыми кислородными приборами.
При специальной тренировке организм может приспосабливаться к пониженному содержанию кислорода в атмосферном воздухе. У тренированного человека углубляется дыхание, увеличивается количество эритроцитов в крови за счет усиленного образования их в кроветворных органах и поступления из депо крови. Кроме того, усиливаются сердечные сокращения, что приводит к увеличению минутного объема крови.
Для тренировки широко применяют барокамеры.
Углекислый газ переносится кровью в виде химических соединений – бикарбонатов натрия и калия. Связывание углекислого газа и отдача его кровью зависят от его напряжения в тканях и крови.
Кроме того, в переносе углекислого газа участвует гемоглобин крови. В капиллярах тканей гемоглобин вступает в химическое соединение с углекислым газом. В легких это соединение распадается с освобождением углекислого газа. Около 25-30% выделяемого в легких углекислого газа переносит гемоглобин.
74 Дыхание, его значение. Давление в плевральной полости
Дыхание обеспечивает газообмен в организме, являющийся необходимым звеном обмена веществ.
В основе лежат процессы окисления углеводов, жиров и белков, в результате чего освобождается энергия, обеспечивающая жизнедеятельность.
Быстрое приспособление дыхания к потребностям человека регулирует центральная нервная система (в продолговатом мозге имеется дыхательный центр).
Помимо этого, кора головного мозга обеспечивает выполнение дыхательных движений, необходимых для речи, пения.
Газообмен происходит в альвеолах легких. Воздух попадает в них по дыхательным путям: сначала в носовую полость, глотку (общий путь для воздуха и пищи), затем по дыхательной системе — гортани, дыхательному горлу, бронхам. Последние, разветвляясь, несут кислород в легочные альвеолы.
Дата добавления: 2015-04-11; просмотров: 9; Нарушение авторских прав
Источник
содержание ..
60
61
62
63
64
65
66
67
68
69 70
..
Газообмен в тканях (анатомия человека)
В легких кровь из венозной превращается а артериальную, богатую О2 и
бедную СО2. Артериальная кровь направляется к тканям, где в
результате непрерывно идущих окислительных процессов потребляется О2 и
образуется СО2. В тканях напряжение О2 близко
к нулю, а напряжение СО2 около
60 мм рт. ст. Вследствие разности давления СО2 из
ткани Диффундирует в кровь, а О2- в ткани. Кровь становится
венозной и по венам поступает в легкие, где цикл обмена газов
повторяется.
Перенос газов кровью (анатомия человека)
Человек в состоянии покоя в 1 мин потребляет в среднем 250 мл О2 и
выделяет при этом 200 мл СО2. Газы очень слабо растворяются в
жидкости: 100 мл крови могут физически растворить 0,3 мл О2,
2,7 мл СО2 и 1 мл
N2. В крови имеется удивительное вещество – гемоглобин (Нb),
которое способно химически связывать О2 и
СО2 и, кроме того,
поддерживать постоянную реакцию крови. В 100 мл артериальной крови
содержится 20 мл О2, 52 мл СО2 и
1 мл N2. Как сказано выше, очень небольшая часть газов
находится в состоянии простого физического растворения. Основное
количество газов образует в крови непрочное химическое соединение, т. е.
такое, которое легко распадается, диссоциирует при понижении давления
газа над жидкостью.
Перенос кислорода. В эритроцитах находится пигмент крови – гемоглобин,
содержащий железо. Одна молекула гемоглобина присоединяет четыре
молекулы О2, при этом гемоглобин превращается в
оксигемоглобин (НbО2), а кровь из вишневой – венозной –
становится ярко-алой – артериальной:

Эта реакция обратима. В легких гемоглобин насыщается кислородом и
превращается в НbО2, в тканях кислород освобождается. Ход
реакции зависит от напряжения кислорода в среде, окружающей капилляры.
На ход реакции влияет напряжение СО2. Если в тканях
увеличивается образование СО2, то ускоряется расщепление
оксигемоглобина. В капиллярах легких снижается напряжение СО2,
так как газ переходит в альвеолы. Это способствует превращению
гемоглобина в НbО2. Каждый грамм гемоглобина способен связать
1,34 мл О2. В 100 мл крови содержится в норме около 15 г
гемоглобина. Следовательно, кислородная емкость крови, т. е. то
максимальное количество О2, которое может поглотить 100 мл
крови, равна 20,1 мл.
Гемоглобин способен соединяться не только с О2, но и с
другими газами. Особое значение имеет его способность химически
связывать окись углерода, или угарный газ,- СО, продукт неполного
сгорания угля или жидкого топлива. С ним гемоглобин образует соединение,
в 150 – 300 раз более прочное, чем с О2. Оно способно
диссоциировать, но крайне медленно. В результате даже при ничтожном
содержании СО в воздухе гемоглобин соединяется не с О2, а с
СО и превращается в карбоксигемоглобин (НbСО), при этом транспорт О2 к
клеткам прекращается. Если своевременно не принять меры (вынести
человека на свежий воздух, в тяжелом случае переливание крови), то
человек погибнет.
Перенос углекислого газа. Образовавшийся в тканях СО2 вследствие
разности напряжения диффундирует в плазму крови, а из нее – в
эритроциты. В эритроцитах примерно 10% СО2 соединяется
с гемоглобином и образует непрочное химическое соединение –
карбгемоглобин. Остальная часть соединяется с водой и превращается в
угольную кислоту:
СО2 + Н2О
= Н2СО3.
Эта реакция ускоряется в 20 000 раз особым ферментом – карбоангидразой,
находящимся в эритроцитах. Реакция обратимая. В тканевых капиллярах, где
напряжение СО2 высокое,
карбоангидраза способствует синтезу угольной кислоты, химическому
связыванию СО2 и
идет слева направо. В легочных капиллярах, где давление СО2 сравнительно
низкое, реакция идет справа налево, образуются вода и СО2,
которая диффундирует в альвеолярный воздух. Угольная кислота в тканевых
капиллярах реагирует с ионами натрия и калия и образует бикарбонаты
(NaHCO3, КНСО3).
Таким образом, СО2 транспортируется
к легким в физически растворенном виде и в непрочном химическом
соединении, в виде карбогемоглобина, угольной кислоты и бикарбонатов
натрия и калия. Две трети его находится в плазме и треть – в эритроцитах
содержание ..
60
61
62
63
64
65
66
67
68
69 70
..
Источник
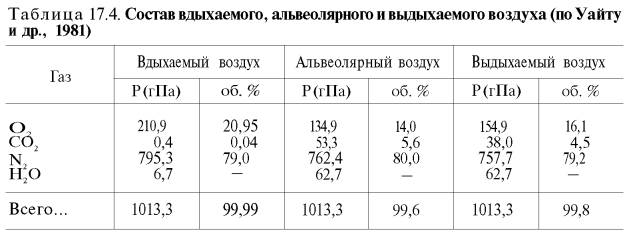
Сущность дыхательной функции крови состоит в доставке кислорода от легких к тканям и
углекислого газа от тканей к легким (табл. 17.4).
Кровь
осуществляет дыхательную функцию прежде всего благодаря наличию в ней
гемоглобина. Физиологическая функция гемоглобина как переносчика кислорода
основана на способности обратимо связывать кислород. Поэтому в легочных
капиллярах происходит насыщение крови кислородом, а в тканевых капиллярах, где
парциальное давление кислорода резко снижено, осуществляется отдача кислорода
тканям.
В состоянии
покоя ткани и органы человека потребляют около 200 мл кислорода в минуту. При
тяжелой физической работе количество потребляемого тканями кислорода возрастает
в 10 раз и более (до 2–3 л/мин). Доставка от легких к тканям такого количества
кислорода в виде газа, физически растворенного в плазме, невозможна вследствие
малой растворимости кислорода в воде и плазме крови (табл. 17.5).
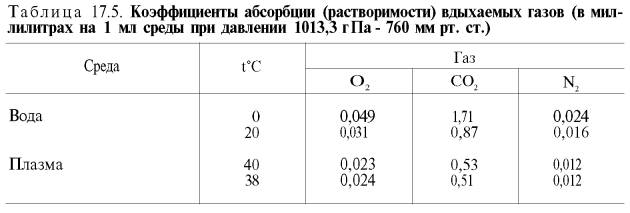
Исходя из
приведенных в табл. 17.5 данных, а также зная РO2 в артериальной
крови – 107–120 гПа (80–90 мм рт. ст.), нетрудно видеть, что количество
физически растворенного кислорода в плазме крови не может превышать 0,3 об. %.
При расчете кислородной емкости крови этой величиной можно пренебречь.
Итак, функцию
переносчика кислорода в организме выполняет гемоглобин. Напомним, что молекула
гемоглобина построена из 4 субъединиц (полипептидных цепей), каждая из которых
связана с гемом (см. главу 2). Следовательно, молекула гемоглобина имеет 4
гема, к которым может присоединяться кислород, при этом гемоглобин переходит в
оксигемо-глобин.
Гемоглобин
человека содержит 0,335% железа. Каждый грамм-атом железа (55,84 г) в составе
гемоглобина при полном насыщении кислородом связывает 1 грамм-молекулу
кислорода (22400 мл). Таким образом, 100 г гемоглобина могут связывать

В венозной
крови в состоянии покоя РО2 = 53,3 гПа, и в этих условиях гемоглобин
насыщен кислородом лишь на 70–72%, т.е. содержание кислорода в 100 мл венозной
крови не превышает
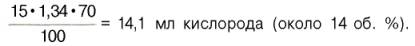
Артериовенозная
разница по кислороду будет около 6 об. %. Таким образом, за 1 мин ткани в
состоянии покоя получают 200–240 мл кислорода (при условии, что минутный объем
сердца в покое составляет 4 л).
Возрастание
интенсивности окислительных процессов в тканях, например при усиленной мышечной
работе всегда связано с более полным извлечением кислорода из крови. Кроме
того, при физической работе резко увеличивается скорость кровотока. Зависимость
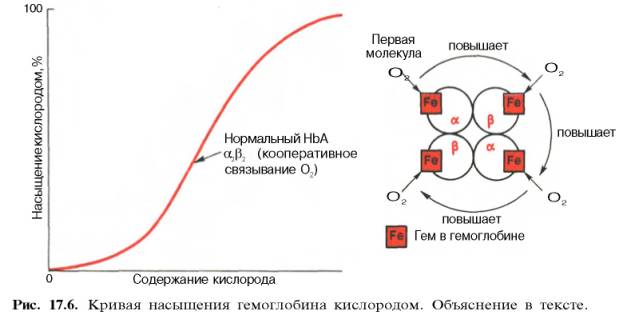
между степенью насыщения гемоглобина кислородом и РО2, можно
выразить в виде кривой насыщения гемоглобина кислородом, или кривой диссоциации
оксигемоглобина, которая имеет S-образную форму и характеризует сродство
гемоглобина к кислороду (рис. 17.6).
Характерная
для гемоглобина S-образная кривая насыщения кислородом свидетельствует, что
связывание первой молекулы кислорода одним из
гемов
гемоглобина облегчает связывание последующих молекул кислорода тремя другими
оставшимися гемами. Долгое время механизм, лежащий в основе этого эффекта,
оставался загадкой, так как, по данным рентгено-структурного анализа, 4 гема в
молекуле гемоглобина довольно далеко отстоят друг от друга и вряд ли могут
оказывать взаимное влияние. В последнее время принято следующее объяснение
происхождения S-образ-ной кривой. Считают, что тетрамерная молекула гемоглобина
способна обратимо распадаться на две половинки, каждая из которых содержит одну
α-цепь и одну β-цепь:
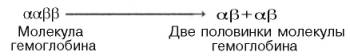
При
взаимодействии молекулы кислорода с одним из четырех гемов гемоглобина кислород
присоединяется к одной из половинок молекулы гемоглобина (допустим, к
α-цепи этой половинки). Как только такое присоединение произойдет,
α-полипептидная цепь претерпевает конформа-ционные изменения, которые
передаются на тесно связанную с ней β-цепь; последняя также подвергается
конформационным сдвигам. β-Цепь присоединяет кислород, имея уже большее
сродство к нему. Таким путем связывание одной молекулы кислорода
благоприятствует связыванию второй молекулы (так называемое кооперативное
взаимодействие).
После насыщения
кислородом одной половины молекулы гемоглобина возникает новое, внутреннее,
напряженное состояние молекулы гемоглобина, которое вынуждает и вторую половину
гемоглобина изменить конфор-мацию. Теперь еще две молекулы кислорода,
по-видимому, по очереди связываются со второй половинкой молекулы
гемоглобина, образуя оксигемоглобин.
S-образная
форма кривой насыщения гемоглобина кислородом имеет большое физиологическое
значение. При такой форме кривой обеспечивается возможность насыщения крови
кислородом при изменении РО2 в довольно широких пределах. Например,
дыхательная функция крови существенно не нарушается при снижении РО2
в альвеолярном воздухе со 133,3 до 80–93,3 гПа. Поэтому подъем на высоту до
3,0–3,5 км над уровнем моря не сопровождается развитием выраженной гипоксемии.
Численно
сродство гемоглобина к кислороду принято выражать величиной Р50 –
парциальное напряжение кислорода, при котором 50% гемоглобина связано с
кислородом (рН 7,4 температура 37°С). Нормальная величина Р50 около
34,67 гПа (см. рис. 17.6). Смещение кривой насыщения гемоглобина кислородом
вправо означает уменьшение способности гемоглобина связывать кислород и,
следовательно, сопровождается повышением Р50. Напротив, смещение
кривой влево свидетельствует о повышенном сродстве гемоглобина к кислороду,
величина Р50 снижена.
Ход кривой
насыщения гемоглобина кислородом или диссоциации оксигемоглобина зависит от
ряда факторов. Сродство гемоглобина к кислороду в первую очередь связано с рН.
Чем ниже рН, тем меньше способность гемоглобина связывать кислород и тем выше Р50.
В тканевых капиллярах рН ниже (поступает большое количество СО2), в
связи с чем гемоглобин легко отдает
кислород. В легких СО2 выделяется, рН повышается и гемоглобин
активно присоединяет кислород.
Способность
гемоглобина связывать кислород зависит также от температуры. Чем выше
температура (в тканях температура выше, чем в легких), тем меньше сродство
гемоглобина к кислороду. Напротив, снижение температуры вызывает обратные
явления.
Количество
гемоглобина в крови, а также в какой-то мере его способность связывать кислород
(характер кривой диссоциации оксигемоглобина) несколько меняются с возрастом.
Например, у новорожденных содержание гемоглобина доходит до 20–21% (вместо
обычных для взрослого 13–16%). У человека имеется несколько гемоглобинов,
которые образуются в различном количестве в разные стадии онтогенеза и
различаются по своему сродству к кислороду.
Рассмотрим
нарушения дыхательной функции крови при некоторых патологических состояниях.
Источник
