Понятие о сдвиге кривой диссоциации гемоглобина вправо эффект бора
Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
Кривые диссоциации оксигемоглобина справедливы для нормальной крови со средними показателями. Однако существует ряд факторов, которые могут сдвигать эту кривую в одну или другую сторону. На рисунке видно, что при некотором закислении крови со снижением рН от нормального уровня 7,4 до 7,2 кривая диссоциации смещается в среднем на 15% вправо, а повышение уровня рН от нормального уровня 7,4 до 7,6 смещает кривую на такое же расстояние влево.
Кроме изменений рН известны и другие факторы, которые могут сдвигать кривую диссоциации. Назовем три, действие которых сдвигает кривую вправо: (1) повышение концентрации двуокиси углерода; (2) повышение температуры крови; (3) повышение концентрации 2,3-дифосфоглицерата — метаболически важного фосфата, который в зависимости от метаболических условий присутствует в крови в разных концентрациях.
Повышение снабжения тканей кислородом в случаях, когда двуокись углерода и ионы водорода сдвигают кривую диссоциации оксигемоглобина. Эффект Бора. Сдвиг кривой диссоциации оксигемоглобина в ответ на повышение содержания двуокиси углерода и ионов водорода в крови имеет существенное влияние, выражающееся в ускорении высвобождения кислорода из крови в тканях и увеличении оксигенации крови в легких. Это называют эффектом Бора и объясняют его следующим образом.
При прохождении крови через ткань двуокись углерода диффундирует из клеток ткани в кровь. В результате в крови увеличивается Ро2, а затем концентрации угольной кислоты (Н2СО3) и ионов водорода. Эти изменения сдвигают кривую диссоциации оксигемоглобина вправо и вниз, уменьшая сродство кислорода к гемоглобину, и в результате увеличивается выход кислорода в ткани.

При диффузии двуокиси углерода из крови в альвеолы происходят процессы обратного направления — в результате в крови снижаются Рсо2 и концентрация ионов водорода, сдвигая кривую диссоциации оксигемоглобина влево и вверх. При этом’ значительно увеличивается количество кислорода, связывающегося с гемоглобином при любом существующем уровне альвеолярного Ро2, что увеличивает транспорт кислорода к тканям.
Сдвиг кривой диссоциации оксигемоглобина под влиянием дифосфоглицерата. Нормальное содержание ДФГ в крови вызывает постоянный небольшой сдвиг кривой диссоциации оксигемоглобина вправо. В случае гипоксического состояния, продолжающегося более нескольких часов, концентрация ДФГ в крови значительно возрастает, и кривая диссоциации оксигемоглобина сдвигается вправо еще больше.
В присутствии такой концентрации ДФГ кислород в тканях высвобождается при Ро2, превышающем нормальный уровень на 10 мм рт. ст., поэтому в некоторых случаях такой механизм с участием ДФГ может оказаться важным для адаптации к гипоксии, особенно если причиной гипоксии является уменьшение в ткани кровотока.
Сдвиг кривой диссоциации во время физической нагрузки. Во время физической нагрузки некоторые факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина вправо, поэтому активные, выполняющие физическую работу мышечные волокна получают дополнительное количество кислорода. В свою очередь, работающие мышцы высвобождают большое количество двуокиси углерода; это в совокупности с действием некоторых других кислот, высвобождающихся мышцами, повышает концентрацию ионов водорода в крови капилляров мышц.
Кроме того, во время работы температура мышцы часто повышается на 2-3°С, что может еще больше увеличивать доставку кислорода мышечным волокнам. Все эти факторы вызывают значительный сдвиг кривой диссоциации оксигемоглобина в крови капилляров мышц вправо. Сдвиг вправо означает высвобождение кислорода гемоглобином в мышце при достаточно высоком уровне Ро2 (40 мм рт. ст.) даже в случаях, когда из него уже высвободилось 70% кислорода. Сдвиг кривой в другую сторону показывает, что в легких присоединилось дополнительное количество кислорода из альвеолярного воздуха.
– Также рекомендуем “Участие кислорода в метаболизме. Метаболическое потребление кислорода”
Оглавление темы “Кислород и его доставка в организме”:
1. Диффузия газов через дыхательную мембрану. Дыхательная мембрана
2. Емкость дыхательной мембраны. Диффузионная емкость для кислорода
3. Вентиляционно-перфузионный коэффициент. Парциальное давление кислорода и двуокиси углерода
4. Концепция физиологического шунта. Концепция физиологического мертвого пространства
5. Обмен кислорода в организме. Транспорт кислорода из легких в ткани
6. Транспорт кислорода артериальной кровью. Диффузия кислорода
7. Гемоглобин. Роль гемоглобина в транспорте кислорода
8. Коэффициент использования кислорода. Сохранение постоянства кислорода в тканях
9. Диссоциация оксигемоглобина и ее зависимость. Эффект Бора
10. Участие кислорода в метаболизме. Метаболическое потребление кислорода
Источник
Аллостерическая регуляция насыщения гемоглобина кислородом
Кривая диссоциации кислорода для гемоглобина
Механизм насыщения гемоглобина кислородом
Гемоглобин присоединяет О2 последовательно, по одной молекуле на каждый гем.
В апогемоглобине, благодаря координационной связи с белковой частью, атом железа выступает из плоскости гема в направлении гистидина F8.
Присоединение О2 к шестой координационной связи железа вызывает его перемещение в плоскость гема, за ним перемещаются гистидин F8 и полипептидная цепь, в состав которой он входит.
Происходит изменение конформации текущего протомера и связанных с ним оставшихся протомеров. При этом у протомеров возрастает сродство к кислороду, в результате каждый следующий кислород присоединяется к гемоглобину лучше предыдущего. Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче, чем первая молекула. Обратный процесс аналогичен, чем больше О2 отдают протомеры, тем легче идет отщепление последующих молекул О2.
Кооперативность в работе протомеров гемоглобина формирует сигмовидный характер кривой насыщения его кислородом в зависимости от парциального давления кислорода.
S–образная кривая насыщения гемоглобина кислородом имеет важное биологическое значение.
Во-первых, пологий участок S–образной кривой (выше 60 мм.рт.ст.) обеспечивает максимальное насыщение гемоглобина кислородом в легких, даже если концентрация кислорода в альвеолярном воздухе заметно снижена. Например, в альвеолярной крови при РО2=95 мм.рт.ст. гемоглобин насыщается кислородом на 97%, а при РО2=60 мм.рт.ст. – на 90%.
Во-вторых, Крутой наклон среднего участка S–образной кривой (от 10 до 40 мм.рт.ст.) обеспечивает максимальный переход кислорода от гемоглобина к тканям.
В области венозного конца капилляра при РО2 = 40 мм.рт.ст. гемоглобин насыщен кислородом на 73%. При снижении РО2 на 5 мм.рт.ст. насыщение гемоглобина кислородом уменьшается на 7%.
Кроме РО2 на насыщение гемоглобина кислородом влияют и другие факторы, например, рН, температура, давление, концентрация 2,3-ДФГ, РСО2.
Увеличение температуры, присоединение к гемоглобину Н+, 2,3-ДФГ, СО2 уменьшает сродство гемоглобина к кислороду, при этом кривая диссоциации оксигемоглобина сдвигается вправо и гемоглобин легче отдает кислород тканям.
Влияние рН на характер кривой диссоциации оксигемоглобина называется эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
Гемоглобин в дезоксигенерированном состоянии имеет более высокое сродство к протонам, чем оксигемоглобин. Другими словами R – форма (оксигенерированная) является более сильной кислотой, чем Т-форма (дезоксигенерированная). Поэтому когда дезоксигемоглобин в легких присоединяет кислород, происходит переход в R – форму и разрыв некоторых связей, в результате чего и высвобождаются протоны, ответственные за эффект Бора. Наоборот, при высвобождении кислорода образуется Т-структура и разорванные связи между субъединицами должны быть восстановлены, и протоны вновь присоединяются к остаткам гистидина в b – цепях. Таким образом, протонирование гемоглобина снижает его сродство к О2 и увеличивает потребление О2 в ткани.
Эффект Бора имеет важное физиологическое значение. Образующийся в тканях СО2 должен транспортироваться в легкие. Он поступает в эритроциты по градиенту напряжения. В них фермент карбоангидраза превращает его в Н2СО3, который диссоциирует на бикарбонат, ион и протон. Последний сдвигает равновесие влево в уравнении (1).
Hb + 4 O2= Hb (О2)4 + (H+)n
Где n – величина порядка 2; число зависит от целого комплекса параметров, тем самым заставляя Hb О2 отдавать свой кислород.
НСО3- пассивно продвигается через ионный канал по градиенту концентрации в сыворотку.
Продвижение НСО3- не сопровождается перемещением Н+, поскольку нет канала, позволяющего ему пройти через мембрану эритроцитов. Для сохранения ионного равновесия при выходе НСО3- из клетки, Cl- перемещаются внутрь её через тот же ионный канал. Такое двойное перемещение известно как хлоридный сдвиг (сдвиг Хамбургера).
Растворенный НСО3- движется вместе с венозной кровью обратно в легкие. Здесь высвобождение протона из гемоглобина при оксигениции приводит к образованию НСО3- (по принципу Ле-Шателье).
НСО3-+ Н+= Н2СО3-,
что позволяет карбоангидразе образовать СО2.
Разрушение НСО3- в эритроците обуславливает вхождение в него НСО3- из сыворотки, так что в легких происходит обратный хлоридный сдвиг, приводящий к выведению СО2 с выдыхаемым воздухом.
Источник
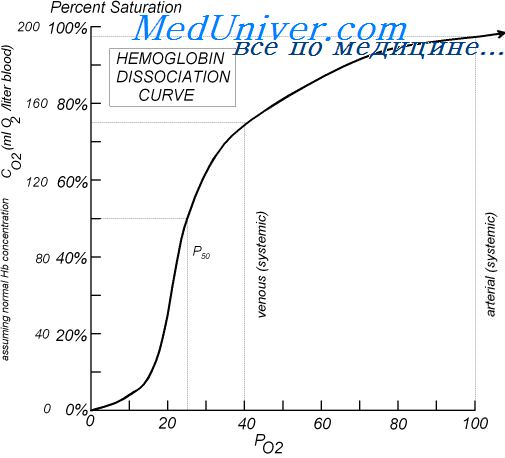
Этот график – кривая диссоциации оксигемоглобина, или сатурационная кривая, показывает, какая доля гемоглобина в данной крови связана с О2 при том или ином его парциальном давлении, а какая – диссоциирована, т.е. свободна от кислорода. КДО имеет S-образную форму. S-образный вид КДО указывает на кооперативный характер взаимодействия О2 с Hb. При соединении или отдаче одной молекулы О2 отмечаются функциональные изменения остальных субъединиц Hb в тетрамере.Такая её конфигурация, имеет определенный физиологический смысл, заключающийся в том, что оксигенация крови в легких сохраняется на высоком уровне даже при относительно низком альвеолярном pO2, а её деоксигенация существенно изменяется даже при небольшом изменении капиллярно-тканевого градиента pO2. Плато кривой характерно для сатурированной О2 (насыщенной) артериальной крови, а крутая нисходящая часть кривой – венозной, или десатурированной крови в тканях (рис. 2.4.).
В качестве показателя CГK принимается значение pО2, при котором Hb наполовину насыщается О2, обозначаемая p50, равна 26-28 мм рт.ст. При повышении СГК p50 уменьшается, а при снижении – повышается. Традиционно полагают, что сдвиг КДО вправо повышает отдачу кровью кислорода тканям, а влево затрудняет десатурацию крови в микроциркулярном русле.
На кривой выделяют 3 участка: от 0 до 10 мм рт. ст. – прямо пропорциональная зависимость, от 10 до 50 – насыщение очень быстрое, от 60 до 90 – насыщение почти не изменяется. При рО2 в артериальной крови, равном 96 мм рт. ст., % насыщения гемоглобина кислородом составляет 97%, а в венозной крови с рО2, равным 40 мм рт. ст., % насыщения гемоглобина равен 75%.
Значение S-образной формы кривой:
1) Крутой наклон среднего участка, соответствующий напряжениям О2 в тканях (35 мм рт. ст. и ниже), благоприятствует отдаче О2 в них.
2) Пологая часть, КДО соответствующая высоким напряжениям О2, обеспечивает стабильность тканевого рО2в условиях, когда рО2 артериальной крови может уменьшаться: при подъеме в горы или на самолете, при заболеваниях легких, с возрастом. Даже когда альвеолярное рО2 снижается до 60 мм рт. ст., гемоглобин в артериальной крови все еще насыщен О2 на 89%, что только на 8% ниже нормальной 97% сатурации.
3) С другой стороны, когда альвеолярное рО2 увеличивается до 500 мм рт. ст. (при вдыхании воздуха под повышенным давлением, например, на глубине моря или в компрессионных камерах), насыщение гемоглобина кислородом также изменяется мало – максимум на 3%.
Следовательно, при варьировании альвеолярного рО2 от 60 до 500 мм рт. ст. рО2 в тканях изменяется только на несколько мм рт. ст., т.е. гемоглобин буферирует сдвиги тканевого рО2.
В настоящее время принято оценивать положение КДО не по наклону кривой, а по расположению на ней двух точек. Первая соответствует 50%-ному насыщению гемоглобина кислородом – Р50 – напряжение полунасыщения (точка разрядки по Крогу). В норме при рН = 7,4 и t = 37оС, Р50 артериальной крови 26 мм рт. ст. (3,46 кПа). Оно выше у женщин, чем у мужчин. Напряжение разрядки достаточно высоко, что обеспечивает эффективный градиент рО2 между капиллярами и тканями, где рО2 не более 10-15 мм рт.ст. Вторая точка соответствует 95%-ному насыщению гемоглобина кислородом – Р97 – точка зарядки. В норме Р97 артериальной крови 70 мм рт. ст.
КДО может занимать различное положение, характеризующееся смещением ее средней части вправо или влево (рис.2.5. ).
Сдвиги кривой диссоциации
Традиционно полагают, что сдвиг КДО вправо повышает отдачу кровью кислорода тканям, а влево затрудняет десатурацию крови в микроциркулярном русле.
Смещение влево сопровождается снижением Р50 и повышением сродства гемоглобина к О2 (СГК), а вправо – увеличением Р50 и уменьшением СГК.
Сродство кислорода к гемоглобину и способность отдавать О2 в тканях зависит от метаболических потребностей клеток организма и регулируется важнейшими факторами метаболизма тканей, вызывающими смещение кривой диссоциации(рис.2.6.). К этим факторам относятся: концентрация водородных ионов, температура, парциальное напряжение углекислоты и соединение, которое накапливается в эритроцитах – это 2,3-дифосфоглицератфосфат (ДФГ).
Факторы, влияющие на СГК.
По механизму действия их делят на 2 группы: прямые и косвенные.
Прямое влияние оказывают химические вещества, которые могут взаимодействовать с гемоглобином и изменять конформацию его молекулы. Это лиганды (О2, Н+, СО2, органические и неорганические соли).
Косвенное действие оказывают физические факторы (tо, pH), которые изменяют условия взаимодействия Hb с лигандами.
Рассмотрим первую группу факторов:
I. В 1907 C.Bohru, A.Krogh установили зависимость положения КДО от содержания СО2 в крови. Сначала “эффект Бора” связывали только с СО2. Однако затем J.Barcroft (1909) показал, что подобная связь существует и при воздействии других кислот. В настоящее время эффект Бора рассматривается как влияние рН среды на взаимодействие атома Fe2+ с различными лигандами.
При снижении рН (увеличении [Н+]) СГК падает. Поэтому КДО смещается вправо. Уменьшение оксигенации Hb при снижении рН – эффект Рута.
Описанные эффекты объясняются тем, что при изменении рН происходит сдвиг константы диссоциации и конформации групп, связанных с О2 в тетрамере гемоглобина. В результате этого меняется СГК. Различают респираторный и метаболический компоненты эффекта Бора.
Метаболический – связан с изменением рН под влиянием кислых или щелочных продуктов обмена веществ.
Респираторный – связан с влиянием СО2 на КДО. Образующийся при тканевом метаболизме СО2 диффундирует внутрь эритроцитов, где под влиянием карбоангидразы образуется Н2СО3 = Н+ + НСО3־. Образующиеся при ее диссоциации Н+ приводят к снижению рН. Это рН-зависимый эффект СО2. Однако СО2 также образует карбаминовые связи с концевыми группами a и b цепей гемоглобина, способствуя таким образом стабилизации дезоксиформы гемоглобина. Это рН-независимый эффект СО2.
На выраженность эффекта Бора влияют:
1) органические фосфаты – при повышении содержания 2,3-дифосфоглицериновой кислоты (2,3-ДФГ) падает коэффициент Бора, который определяют как D log Р50 / D log рН; 2) температура; 3) насыщение крови О2;
4) электролиты; 5) свойства Hb; 6) пол – коэффициент Бора меньше у мужчин, чем у женщин.
Т.о., эффект Бора – это результат сложного взаимодействия рН, СО2, 2,3-ДФГ и всех других указанных факторов.
Биологический смысл эффекта Бора: он способствует поглощению О2 в легких и отдаче его в тканях.
В легких – поглощение О2 идет одновременно с выделением СО2, поэтому по мере насыщения гемоглобина кислородом КДО сдвигается влево (рис. 2.6), т.е. СГК возрастает. В результате скорость диффузии О2 из альвеол в кровь несколько увеличивается.
В тканях – одновременно с выходом О2 в эритроциты поступает СО2, поэтому КДО смещается вправо, что приводит к снижению СГК и благоприятствует отдаче О2 тканям.
II. В 1967 г. была описана специфическая роль органичнских фосфатов в эритроцитах. 2,3-ДФГ, значительно уступая АТФ в энергетической ценности, играет огромную роль в регуляции транспорта О2. Во-первых, он взаимодействует с b-цепями восстановленного гемоглобина благодаря соответствию зарядов некоторых аминокислотных остатков распределению зарядов в органическом фосфате. После образования связи с b-цепью 2,3-ДФГ закрывает вход в центральный канал молекулы, что уменьшает СГК. Во-вторых, 2,3-ДФГ также изменяет внутриклеточный рН.
На реакцию 2,3-ДФГ и гемоглобина влияют:
1) соотношение Hb/HbО2 – чем оно выше, тем больше связывается 2,3-ДФГ);
2) рН – снижение рН увеличивает сродство гемоглобина к 2,3-ДФГ;
3) рСО2– уменьшение рСО2 повышает сродство гемоглобина к 2,3-ДФГ;
4) tо– возрастание tо препятствует присоединению 2,3-ДФГ к гемоглобину;
5) анионы – могут конкурировать с 2,3-ДФГ за одни и те же центры связывания.
С изменением содержания 2,3-ДФГв эритроцитах связана зависимость СГК от их возраста – молодые эритроциты имеют меньшее СГК, по мере старения оно возрастает, поскольку уровень 2,3-ДФГ уменьшается.
Роль 2,3-ДФГ в качестве регулятора положения КДО заключается не только во влияниии на СГК. Он служит посредником других влияний – рН, рСО2, t, ионного состава на кислородтранспортную функцию крови.
III. Органические и неорганические соли – при увеличении их концентрации КДО сдвигается вправо. Соли влияют через эритроцитарный метаболизм.
К косвенным факторам, как уже отмечалось, относят рН, влияние которого на СГК рассмотрено выше, и tо. Уменьшение tо увеличивает интенсивность образования HbО2, т.е. при прочих равных условиях смещает КДО влево. Повышение tо, напротив, снижает СГК.
Температурный коэффициент, представляющий собой отношение D log рО2 / D tо, зависит от рН, [2,3-ДФГ], насыщения крови кислородом. Он различен у мужчин и женщин. Оксигенация гемоглобина является экзотермической реакцией, соответственно диссоциация оксигемоглобина протекает с поглощением тепла. При повышении температуры крови происходит снижение СГК и его увеличение при снижении температуры. Алкалоз и гипотермия повышают сродство гемоглобина к кислороду. В этих условиях гемоглобин жадно присоединяет к себе кислород в легких и неохотно отдает его тканям.
При ацидозе и гипертермии в эритроцитах сродство гемоглобина к кислороду снижается. При этом насыщение гемоглобина кислородом в легких ухудшается, но отделение кислорода от оксигемоглобина в капиллярах облегчается.
Особый интерес для изучения кислородсвязывающих свойств крови представляет выделение NO клетками эндотелия кровеносных сосудов.
В целом, дыхательный цикл можно рассматривать как механизм транспорта “трех газов”: NO/О2/CО2 . Характерной особенностью NO является способность быстро (менее чем за 5 секунд) диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и легко (без участия рецепторов) проникать в клетки-мишени. В результате взаимодействия NO и гемоглобина происходит образование его различных NO-форм: метгемоглобин, нитрозилгемоглобин, нитрозогемоглобин, которые играют роль своеобразного аллостерического регулятора функциональной активности гемоглобина на уровне отдельных его тетрамеров. Присутствие этих соединений гемоглобина с NO может по-разному влиять на СГК всей крови: метгемоглобин и нитрозогемоглобин его повышают, а нитрозилгемоглобин снижает. В ходе одного цикла движения эритроцита в сосудистой системе происходят последовательные реакции гемоглобина с NO, модулирующиеся его структурными переходами из R– в Т-состояние. На уровне капилляров малого круга кровообращения это может быть дополнительным механизмом, способствующим оксигенации крови, а на уровне микроциркуляции большого круга – оптимизирующим десатурацию крови, и, соответственно, доставку кислорода в ткани.
Транспорт углекислого газа кровью
Химические реакции связывания СО2 несколько сложнее, чем О2. Это обусловлено тем, что механизмы, отвечающие за транспорт СО2, должны одновременно обеспечивать поддержание кислотно-щелочного равновесия крови и тем самым – внутренней среды организма.
I. Первый способ связывания СО2 – прежде всего происходит гидратация молекул СО2 с образованием Н2СО3
СО2 + Н2О ® Н2СО3
В плазме эта реакция протекает очень медленно. В эритроцитах она ускоряется в 20 тысяч раз, что связано с действием карбоангидразы – фермента, расположенного только внутри клеток. Его существование предполагал еще И.М.Сеченов, но открыт он был в 1932 г. Мелдрумом и Рафтоном.
Следующая реакция в цепи химических превращений СО2 заключается в диссоциации слабой кислоты Н2СО3 на бикарбонат-ионы и Н+.
Н2СО3 ® НСО3־ + Н+
Накопление НСО3־ в эритроцитах приводит к тому, что между его внутренней средой и плазмой крови создается градиент концентрации этого иона. НСО3 могут передвигаться по этому градиенту лишь в том случае, если при этом не будет нарушаться равновесное распределение электрических зарядов. Т.е., одновременно с выходом НСО־3 должен происходить либо выход из эритроцитов одного катиона, либо вход одного аниона(рис.2.7.). Поскольку мембрана эритроцитов практически непроницаема для катионов, но проницаема для небольших анионов, взамен НСО3 в эритроциты поступает Cl-. Этот обменный процесс называется хлоридным сдвигом Хамбургера.
Участие эритроцитов в обмене О2 и СО2 в тканях и в легких
А- между тканями и кровью; Б- между кровью и альвеолярным воздухом
Накопление анионов внутри эритроцитов приводит к повышению осмотического давления, что вызывает поступление в них воды. В результате этого объем эритроцитов в венозной крови больше, чем в артериальной. Поэтому эритроциты занимают 40% объема артериальной крови и 40,4% – венозной. Образующиеся при реакции диссоциации Н2СО3 протоны не изменяют рН, поскольку гемоглобин, будучи амфолитом, обладает значительной буферной емкостью. Кроме того, восстановленный гемоглобин является более слабой кислотой, чем оксигемоглобин, поэтому может присоединять дополнительное количество Н+. В тканях Hb ведет себя как основание:
KHbO2 ® O2 = KHb +H2CO3 ® H Н b H+
(HСО3 + H+)
II. Второй способ связывания СО2 – непосредственное его присоединение к аминогруппам белкового компонента гемоглобина за счет образования карбаминовой связи. В легких Hb выполняет функцию кислоты:
HbNH2 + CO2 ® HbNHCOO- + H+
Соединение гемоглобина с СО2 называется карбаминогемоглобином. На количество связываемого таким образом СО2 влияет оксигенация гемоглобина. Присоединение О2 к гемоглобину уменьшает количество связываемого в виде карбаминового соединения СО2.
Еще в 1892 г. Вериго было установлено, что газовая емкость по отношению к СО2 крови, содержащей восстановленный гемоглобин, значительно выше, чем в условиях полной оксигенации гемоглобина. Это явление, затем подробно изученное Холденом (1914), обусловлено тем, что, во-первых, оксигемоглобин является более сильной кислотой, чем восстановленный гемоглобин, и, следовательно, когда реакция происходит между КНbO2 и Н2СО3, равновесие наступает при образовании меньшего объема КНСО3, чем в случае, когда реакция течет между КНb и Н2СО3. Во-вторых, оксигенация гемоглобина ведет к снижению образования карбаминогемоглобина, поскольку уменьшает количество свободных NH2 групп глобина, способных связывать СО2. Следовательно, оксигенация гемоглобина влияет на способность крови связывать СО2. Это явление получило название эффекта Вериго-Холдена.
Соотношение между фракциями СО2 в крови. Каждый мл крови, протекая через ткани, захватывает примерно 2 мМоль СО2. 5-10% этого количества остается в физически растворенном виде, 10% образует карбаминовую связь с гемоглобином, 35% транспортируется в виде бикарбонатов в эритроцитах, а остальные 45% – в виде бикарбонатов натрия – в плазме. При прохождении крови через легкие СО2 выделяется из этих фракций точно в таком же соотношении.
Таким образом, дыхательная функция крови является важной составной частью функциональной системы транспорта газов и необходима для следующего этапа дыхания – газообмена между кровью и тканями.
Источник
