Последовательность аминокислот в молекулах гемоглобина
Макеты страниц
В конце 40-х годов Лайнус Полинг и Гарвей Итано обнаружили, что серповидноклеточный и нормальный гемоглобины, помещенные в электрическом поле, т.е. подвергнутые электрофорезу (разд. 6.6), мигрируют к положительно заряженному электроду с разными скоростями: гемоглобин S немного отстает от гемоглобина А.
Исследователи сделали вывод, что гемоглобин S должен содержать несколько меньше отрицательно заряженных R-групп, чем гемоглобин А. Позднее Вернон Инграм придумал довольно простой экспериментальный способ, позволяющий более точно локализовать различия в полипептидных цепях гемоглобина S и гемоглобина А. Предложенный им метод пептидных карт и поныне широко используется для выявления генетических разновидностей не только гемоглобинов, но и других белков. Инграм обработал оба гемоглобина, S и А, трипсином, который разрывает только те пептидные связи, в которых карбоксильная группа принадлежит остаткам аргинина или лизина (разд. 6.7, в). Это привело к образованию пептидных фрагментов 28 сортов, поскольку в и -цепях содержится в общей сложности 27 остатков лизина и аргинина. Смесь пептидов, полученных при расщеплении каждого гемоглобина, была нанесена на фильтровальную бумагу, смоченную буферным раствором, и подвергнута электрофорезу, в результате чего пептидные фрагменты разделились, хотя и не полностью, на отдельные зоны. После того как фильтровальная бумага была высушена, через нее пропустили буферный раствор с другим значением pH для хроматографического разделения пептидных фрагментов в направлении, перпендикулярном направлению электрофореза (разд. 5.21). Когда бумага была снова высушена и в прогретом состоянии обработана нингидрином (разд. 5.19), получилась характерная двумерная пептидная карта со всеми пептидными фрагментами. Как видно из рис. 8-22, гемоглобин S отличается от гемоглобина А по положению на пептидных картах только одного пятна, из чего следует, что в гемоглобине S содержится всего лишь один пептид, отличающийся по своему заряду от соответствующего пептида гемоглобина А. Анализ элюированных из бумаги пептидов позволил Инграму сделать вывод, что они различаются только по одному аминокислотному остатку: в том положении полипептидной цепи, в котором пептид из нормального гемоглобина А содержит остаток глутаминовой кислоты, в смещенном пептиде из гемоглобина S находится остаток валина (рис. 8-22).
Рис. 8-22. Пептидные карты трипсиновых пептидов гемоглобина А и гемоглобина S. На карте гемоглобина S смещено положение всего одного пептида (показанного красным цветом), содержащего генетически измененную аминокислоту.
Все остальные аминокислотные остатки в цепях гемоглобина S идентичны остаткам гемоглобина А. Оказалось, что «неправильный» остаток находится в положении 6 -цепей. Поскольку -группа валина не имеет электрического заряда, а -группа глутаминовой кислоты несет при pH 8 отрицательный заряд (рис. 8-23), ясно, что серповидноклеточный гемоглобин должен содержать на два отрицательных заряда меньше, чем гемоглобин А – по одному на каждую из двух -цепей молекулы гемоглобина.
Из-за этой разницы гемоглобин S движется в электрическом поле несколько медленнее гемоглобина А.
Эволюцию этого соединения можно проследишь, сравнивая последовательность аминокислотных остатков в различных цепях гемоглобинов человека и в молекулах гемоглобина животных
Э. Цукеркандль
В каждом живом организме подробно записано его прошлое, начиная с момента возникновения жизни на Земле. Эта запись в закодированной форме хранится в гигантских молекулах дезоксирибонуклеиновой кислоты (ДНК), составляющей геном организма, или полный запас его генетической информации. В более осязаемой форме генетическая информация воплощается в белковых молекулах, которые определяют форму и функции организма.
ДНК и белок служат живыми документами эволюционной истории. Они сильно различаются по своему химическому строению, но вместе с тем имеют один очень существенный общий признак: их молекулы представляют собой линейные последовательности субъединиц, различающихся между собой лишь незначительно, подобно разноцветным бусинкам в ожерелье. За каждой такой «бусинкой» закреплено определенное место; в результате мутации (наследуемые изменения) может либо произойти изменение цвета «бусинки», либо замена, исчезновение или добавление лишней «бусинки». Белковые молекулы имеют определенную пространственную конфигурацию, что позволяет им выполнять специфические функции.
Молекулярные документы эволюционной истории изучает недавно возникшая наука — химическая палеогенетика. Она стремится выяснить следующий вопрос: как протекала эволюция на молекулярном уровне? Эта новая наука находится на заре своего развития: ведь о линейной последовательности субъединиц, которыми записан код в отдельном гене молекулы ДНК, пока еще почти ничего неизвестно. В вирусах — самых малых структурах, несущих информацию для собственного воспроизведения,— содержится от нескольких генов до нескольких сотен генов. В свою очередь каждый ген состоит из нескольких сотен кодирующих «букв». До сих пор не удалось выделить из какого-либо организма отдельный ген и подвергнуть его химическому анализу.
Что же касается химической структуры отдельных полипептидных цепей, в которых воплощена информация, закодированная в соответствующих генах, то она вполне поддается изучению.
Основная цепь белковой молекулы, то есть последовательность аминокислотных молекул, соединенных пептидными связями, называется полипептидом. Пептидная связь возникает при соединении двух молекул аминокислот с выделением одной молекулы воды.
«Молекулы и клетки», под ред. Г.М.Франка

Объединив информацию, полученную на основании анализа молекулярных филогенетических древес, составленных для отдельных аминокислотных субъединиц, можно восстановить полную аминокислотную последовательность предковой полипептидной цепи. Смотрите рисунок – Родоначальный аминокислотный остаток (6) Смотрите рисунок – Установить родоначальный аминокислотный остаток (7) Обобщая данные по построению эволюционных древес для отдельных аминокислотных остатков Обобщая данные по построению эволюционных древес для отдельных…

Схема эволюции цепей гемоглобина и миоглобина от общего предка Схема эволюции цепей гемоглобина и миоглобина от общего предка, составленная на основании числа различий между этими цепями. Кружки показывают моменты предполагаемой дупликации родоначальных генов, дававшей каждый раз начало новой линии гена; м—цепь миоглобина. На рисунке выше схематически показаны вероятные родственные взаимоотношения известных цепей гемоглобина и миоглобина…

Представление о происхождении от общего предка подтверждается еще одним фактом. Дело в том, что в гемоглобине человека вместо р-цепи присутствуют иногда другие цепи (так называемые γ-, δ- или ε-цепи), отличающиеся от нее по своей аминокислотной последовательности. ε -Цепь встречается лишь на самых ранних этапах эмбрионального развития; γ -цепь присутствует в гемоглобине на протяжении почти всего…

Дупликатные гены, по-видимому, очень ценны для организма. Так, они способны вызывать удвоенный (по сравнению с тем, что имело место до дупликации) синтез данной полипептидной цепи. Однако их функция выяснена еще не до конца. Например, γ-цепь, входящая в состав гемоглобина плода, приспособлена, очевидно, специально для внутриутробного развития, а β-цепь, замещающая ее вскоре после рождения,— для постнатального…

Часто говорят, что эволюция длилась одинаково долго как для организмов, которые, казалось бы, мало отличаются от своих предков, так и для тех организмов, которые сильно изменились. Отсюда ученые делают вывод, что по своим биохимическим свойствам все эти «живые ископаемые» также должны резко отличаться от своих далеких предков. С моей точки зрения, маловероятно, чтобы в процессе…

Каждая аминокислота закодирована в ДНК «словом» из трех «букв»; следовательно, в полипептидной цепи происходит своего рода «сжатие» информации по сравнению с кодирующим эту цепь геном. Для того чтобы закодировать полипептид из 200 аминокислотных остатков, требуется структурный ген, состоящий из 600 кодирующих букв. Отношение три к одному возникает потому, что существует 20 видов аминокислот и всего…

По своей аминокислотной последовательности миоглобин кашалота и α- и β-цепи гемоглобина человека далеки друг от друга. Последовательность аминокислот в миоглобине человека установлена еще не до конца, однако уже сейчас ясно, что он в этом отношении окажется гораздо ближе к миоглобину кашалота, чем к какой-либо из цепей гемоглобина человека. В 37 положениях миоглобина кашалота и ос-цепи…

Считается, что сдвиг произведен правильно, если при этом достигается максимальное совпадение между сегментами двух цепей. Получается, как видите, заколдованный круг: сдвиги оправдывают гипотетическими делециями (или добавлениями) аминокислот, а делеции (или добавления) — сдвигами. Как же найти выход из этого положения? Дело в том, что путем немногих сдвигов можно добиться прекрасного совпадения — но только у…

Например, было высказано предположение, что различия в скорости и согласованности процессов связаны с определенными последовательностями оснований в ДНК, которые не кодируют полипептидных цепей. Однако создается впечатление, что в конечном счете различия между организмами — при постоянных условиях окружающей среды — определяются различиями в молекулярных последовательностях. Это могут быть различия в чередовании оснований в генах, которые…

Сравнение цепей гемоглобина, позволяющее установить время, необходимое для возникновения эволюционно эффективного замещения одной аминокислоты в полипептидной цепи Животное Число различий * Среднее число различий во всех цепях Время, прошедшее с момента отхождения от общего предка α-цепь β-цепь Лошадь 17 26 – – Свинья ~18 ~14 ~22 80 млн. лет Бык 27 – – – Кролик…
К группе
гемопротеинов относятся гемоглобин и его производные, миогло-бин,
хлорофиллсодержащие белки и ферменты (вся цитохромная система, каталаза и
пероксидаза). Все они содержат в качестве небелкового компонента структурно
сходные железо- (или магний)порфирины, но различные по составу и структуре
белки, обеспечивая тем самым разнообразие их биологических функций. Далее более
подробно рассмотрено химическое строение гемоглобина, наиболее важного для
жизнедеятельности человека и животных соединения.
Гемоглобин в
качестве белкового компонента содержит глобин, а небелкового – гем. Видовые
различия гемоглобина обусловлены глобином, в то время как гем одинаков у всех
видов гемоглобина.
Основу
структуры простетической группы большинства гемосодержащих белков составляет
порфириновое кольцо, являющееся в свою очередь производным тетрапиррольного
соединения – порфирина. Последний состоит из четырех замещенных пирролов:
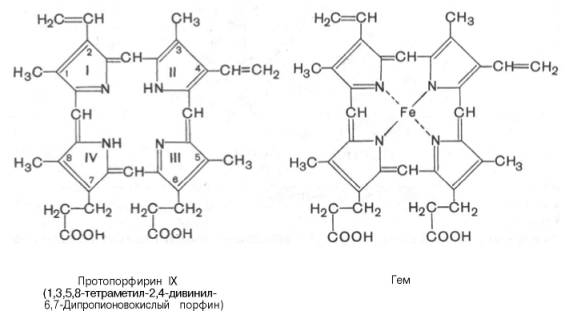
соединенных
между собой метиновыми мостиками (—СН=). Незамещенный порфирин называется
порфином. В молекуле гема порфин представлен в виде протопорфирина IX,
содержащего четыре метильные группы (—СН3), две винильные группы
(—СН=СН2) и два остатка пропионовой кислоты. Протопорфирин,
присоединяя железо, превращается в гем.
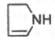
Из формулы
видно, что железо связано с двумя атомами азота молекулы протопорфирина
ковалентно и с двумя другими – координационными связями, обозначенными
пунктирными линиями. В зависимости от химической природы групп, находящихся в
боковой цепи, порфирины классифицируют на этио-, мезо-, копро- и
протопорфирины. Последние наиболее распространены в природе. Из возможных 15
изомеров протопорфиринов благодаря наличию трех разных заместителей самым
распространенным оказался протопорфирин IX.
Гем в виде
гем-порфирина является простетической группой не только гемоглобина и его
производных, но и миоглобина, каталазы, пероксидазы и цитохромов b, с и c1
(см. главу 9); в то же время в цитохромах а и
a3, входящих
в состав интегрального комплекса, названного цитохромокси-дазой, содержится гем
а, называемый также формилпорфирином:
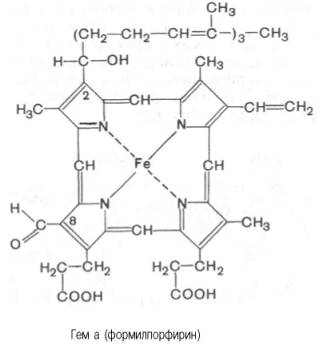
Гем а вместо
метильной группы содержит формильный остаток (в 8-м положении) и вместо одной
винильной группы (во 2-м положении) – изопре-ноидную цепь. Железо своими
четырьмя связями образует комплекс с порфирином, а оставшиеся 5-я и 6-я
координационные связи железа в молекулах гемоглобина и цитохромов связываются с
белковыми компонентами по-разному. В частности, в гемоглобинах (и миоглобине)
благодаря 5-й координационной связи железо соединяется с атомом азота
имидазольной группы гистидина белковой молекулы. Шестая координационная связь
железа предназначена для присоединения кислорода (с образованием
оксигемоглобина и оксимиоглобина) или других лигандов: СО, цианидов и др. (рис.
2.1). В цитохромах, напротив, и 5-я, и 6-я координационные связи железа
соединены с остатками гистидина и метио-нина (в цитохроме с обе винильные группы соединены еще и с
остатками цистеина) белковой молекулы. Этим, вероятнее всего, могут быть объяснены
функции железа в гемоглобине, валентность которого не изменяется при
присоединении кислорода (в отличие от валентности железа в цитохромах): в
гемоглобине железо остается двухвалентным независимо от присоединения или
отдачи кислорода.
Структурная
организация гемоглобина (и миоглобина) была описана в главе 1. Дж. Кендрью и М.
Перутц расшифровали конформацию этих молекул (Нобелевская премия 1962 г.).
Дыхательная функция гемоглобина крови подробно рассматривается в курсе
физиологии. Здесь следует указать на уникальную роль гемоглобина в траспорте
кислорода от легких к тканям и диоксида углерода от тканей к легким. Это
элементарное проявление жизни – дыхание, хотя и выглядит простым, основано на
взаимодействии многих типов атомов в гигантской молекуле гемоглобина.
Подсчитано, что в одном эритроците содержится около 340000000 молекул
гемоглобина, каждая из которых состоит примерно из 103атомов С, Н,
О, N, S и 4 атомов железа.
Атом железа
расположен в центре гема-пигмента, придающего крови характерный красный цвет.
Каждая из 4 молекул гема «обернута» одной полипептидной цепью. В молекуле
гемоглобина взрослого человека HbА (от англ. adult –
взрослый) содержатся четыре полипептидные цепи, которые вместе составляют
белковую часть молекулы – глобин. Две из них, называемые α-цепями, имеют
одинаковую первичную структуру и по 141 аминокислотному остатку. Две другие,
обозначаемые β-цепями, также идентично построены и содержат по 146
аминокислотных остатков. Таким образом, вся молекула белковой части гемоглобина
состоит из 574 аминокислот. Во многих положениях α- и β-цепи
содержат разные аминокислотные последовательности, хотя и имеют почти
одинаковые пространственные структуры. Получены доказательства, что в структуре
гемоглобинов более 20 видов животных 9 аминокислот в последовательности
оказались одинаковыми, консервативными (инвариантными), определяющими функции
гемоглобинов; некоторые из них находятся вблизи гема, в составе участка
связывания с кислородом, другие – в составе неполярной внутренней структуры
глобулы.
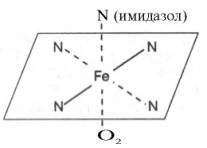
Рис. 2.1. Координационные
связи атома железа в молекуле гема. Все 4 связи с атомами азота пиррольных
колец расположены в одной плоскости, 5-я и 6-я координационные связи (с атомом
азота имидазольного кольца гистидина и с кислородом соответственно) – по разные
стороны перпендикулярно к этой плоскости.
В дополнение
к основному гемоглобину HbA1в крови
взрослого человека доказано существование мигрирующего с меньшей скоростью при
электрофорезе гемоглобина НbА2, также состоящего из 4 субъединиц:
двух α-цепей и двух δ-цепей. На долю НbА2 приходится около
2,5% от всего гемоглобина. Известен, кроме того, фетальный гемоглобин
(гемоглобин новорожденных), обозначаемый HbF и состоящий
из двух α-цепей и двух γ-цепей. Фетальный гемоглобин отличается от HbA1не только составом аминокислот, но и физико-химическими свойствами:
спектральным показателем, электрофоретической подвижностью, устойчивостью к
щелочной денатурации и др. Кровь новорожденного содержит до 80% HbF, но
к концу 1-го года жизни он почти целиком заменяется на НbА (все же в крови
взрослого человека открывается до 1,5% HbF от общего
количества гемоглобина). Последовательность аминокислот в γ- и
δ-цепях гемогло-бинов окончательно не расшифрована.
Установление
первичной структуры субъединиц молекулы гемоглобина стимулировало исследования
по расшифровке структуры так называемых аномальных гемоглобинов. В крови
человека в общей сложности открыто около 150 различных типов мутантных
гемоглобинов. Появляются мутантные формы гемоглобинов в крови вследствие мутации
генов. Обычно мутации делят на 3 класса в соответствии с топографией
измененного участка молекулы. Если замена аминокислоты происходит на
поверхности молекулы гемоглобина, то это мутация первого класса; подобные
мутации обычно не сопровождаются развитием тяжелой патологии, и болезнь
протекает бессимптомно; исключение составляет серповидно-клеточная анемия. При
замене аминокислоты вблизи гема нарушается связывание кислорода –
это мутация второго класса, сопровождающаяся развитием болезни. И наконец, если
замена происходит во внутреннем участке молекулы гемоглобина, говорят о третьем
классе мутации; подобные мутации приводят к нарушению пространственной
структуры и соответственно функции гемоглобина.
Аномальные
гемоглобины, различающиеся по форме, химическому составу и величине заряда,
были выделены при помощи электрофореза и хроматографии. Передающиеся по
наследству изменения чаще всего являются результатом мутации единственного
триплета, приводящей к замене одной какой-либо аминокислоты в полипептидных
цепях молекулы гемоглобина на другую. В большинстве случаев происходит замена
кислой аминокислоты на основную или нейтральную (табл. 2.1). Поскольку это
замещение осуществляется в обеих полипептидных цепях одной из пар (α или
β), образовавшийся аномальный гемоглобин будет отличаться от
нормального величиной заряда и соответственно электрофоретической подвижностью.

В табл. 2.1
представлены некоторые типы аномальных гемоглобинов, составы их полипептидных
цепей с указанием известной или вероятной локализации замены либо в α-, либо
в β-цепях. Замены необычной аминокислотой в аномальных гемоглобинах имеют
место как в α-, так и в β-цепях. Исключение
составляет гемоглобин Н, все 4 полипептида которого представлены β-цепями,
идентичными по структуре β-цепям нормального гемоглобина A1.
Следует
указать, что некоторые мутации, вызывающие существенное изменение структуры и
соответственно функции гемоглобина, оказываются летальными, и индивидуумы с
подобным гемоглобином умирают в раннем возрасте. Однако при ряде мутаций замена
аминокислот не вызывает заметного изменения функции гемоглобина, в этих случаях
болезнь протекает бессимптомно.
Болезни
гемоглобинов (их насчитывают более 200) называют гемогло-бинозами. Принято делить их на гемоглобинопатии, в
основе развития которых лежит
наследственное изменение
структуры какой-либо цепи нормального
гемоглобина (часто их относят также к «молекулярным болезням»), и талассемии,
обусловленные наследственным нарушением синтеза какой-либо нормальной цепи
гемоглобина. Различают также же-лезодефицитные анемии.
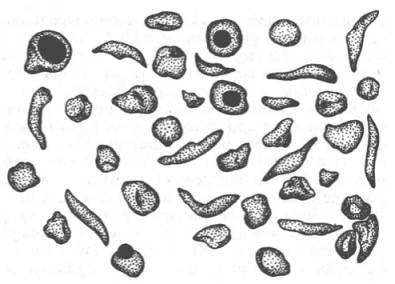
Рис. 2.2. Нормальные
и серповидные эритроциты.
Классическим
примером наследственной гемоглобинопатии является серповидно-клеточная анемия,
широко распространенная в странах Южной Америки, Африки и Юго-Восточной Азии.
При этой патологии эритроциты в условиях низкого парциального давления
кислорода принимают форму серпа (рис. 2.2). Гемоглобин S, как
показали Л. Полинг и др., отличается рядом свойств от нормального гемоглобина:
в частности, после отдачи кислорода в тканях он превращается в плохо
растворимую дез-окси-форму и начинает выпадать в осадок в виде веретенообразных
кристаллоидов, названных тактоидами. Последние деформируют клетку и приводят к
массивному гемолизу. Болезнь протекает остро, и дети, гомозиготные по
мутантному гену, часто умирают в раннем возрасте.
Химический
дефект при серповидно-клеточной анемии был раскрыт В. Ингремом и сводится к
замене единственной аминокислоты, а именно глутаминовой, в 6-м положении с
N-конца на валин в β-цепях молекулы гемоглобина HbS (см.
табл. 2.1, рис. 2.2). Это результат мутации в молекуле ДНК, кодирующей синтез
β-цепи гемоглобина. Все остальные аминокислоты располагаются в той же
последовательности и в таком же количестве, как и в нормальном гемоглобине НbА:
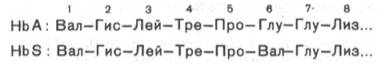
Одной этой
замены оказалось достаточно не только для нарушения формы эритроцита, но и для
развития тяжелой наследственной болезни – серповидно-клеточной анемии.
Талассемии,
строго говоря, не являются гемоглобинопатиями. Это генетически обусловленное
нарушение синтеза одной из нормальных цепей гемоглобина. Если угнетается синтез β-цепей, то
развивается β-талассемия; при
генетическом дефекте синтеза α-цепей развивается α-талас-семия. При
β-талассемии в крови наряду с HbA1появляется
до 15% НbА2 и резко повышается содержание HbF – до 15–60%.
Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением
печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической
анемией. Эритроциты при талассемии приобретают мишеневидную форму. Механизм
изменения формы эритроцитов объяснить пока не удалось.
В медицинской
практике часто проводят анализ кровяных пигментов, который основан на
исследовании спектроскопических свойств гема гемоглобина, точнее продуктов его
окисления (хлорида гемина и гематина, образующихся соответственно при обработке
гемоглобина уксусной кислотой в присутствии хлорида натрия или разведенными
растворами щелочей). При восстановлении гематина сульфитом аммония в
присутствии глобина образуется производное гемоглобина – гемохромоген,
в котором денатурированный глобин соединен с гемом. Полученный комплекс
имеет характерный спектр поглощения. Этот метод широко применяется в
судебно-медицинской практике при исследовании кровяных пятен.
Из
многообразия производных гемоглобина, представляющих несомненный интерес для
врача, следует прежде всего указать на оксигемоглобин НbО2 –
соединение молекулярного кислорода с гемоглобином. Кислород присоединяется к
каждому гему молекулы гемоглобина при помощи координационных связей железа,
причем присоединение одной молекулы кислорода к тетрамеру облегчает
присоединение второй молекулы, затем третьей и т.д. Поэтому кривая насыщения
гемоглобина кислородом имеет сиг-моидную форму, свидетельствующую о
кооперативности связывания кислорода. Эта кооперативность обеспечивает не
только связывание максимального количества кислорода в легких, но и
освобождение кислорода в периферических тканях; этому способствует также
наличие Н+ и СО2 в тканях с интенсивным обменом. В свою
очередь кислород ускоряет высвобождение СО2 и Н+ в
легочной ткани. Эта аллостерическая зависимость между присоединением Н+,
О2 и СО2 получила название эффекта Бора.
Помимо
кислорода, гемоглобин легко соединяется с другими газами, в частности с СО, NO и
др. Так, при отравлении оксидом углерода гемоглобин прочно с ним связывается с
образованием карбоксигемо-глобина (НbСО). При этом вследствие высокого сродства
к СО гемоглобин теряет способность связывать кислород и наступает смерть от
удушья, недостаточного снабжения тканей кислородом. Однако при быстром
повышении парциального давления кислорода во вдыхаемом воздухе можно добиться
частичного вытеснения СО из связи с гемоглобином и предотвратить летальный
исход.
При
отравлении оксидами азота, парами нитробензола и другими соединениями часть
гемоглобина окисляется в метгемоглобин (НbОН), содержащий трехвалентное железо.
Метгемоглобин также теряет способность к переносу кислорода от легких к тканям,
поэтому при метгемо-глобинемии (вследствие отравления окислителями) в
зависимости от степени отравления может наступить смерть от недостатка
кислорода. Если вовремя оказать помощь, т.е. повысить парциальное давление
кислорода (вдыхание чистого кислорода), то и в этом случае можно вывести
больного из опасного состояния.
Следует
отметить, что самым надежным методом качественного определения различных
производных гемоглобина является исследование их спектров поглощения.
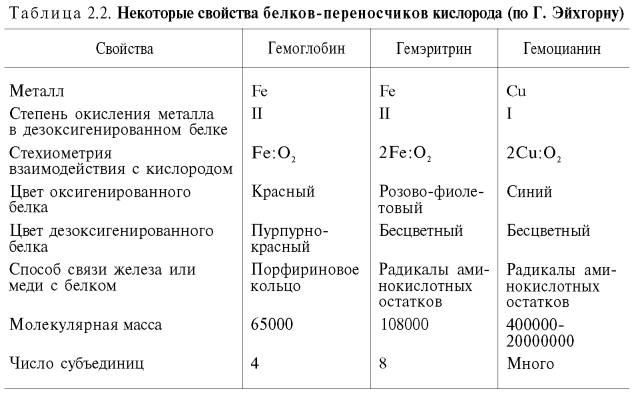
У
беспозвоночных роль переносчика кислорода часто выполняют пигменты негеминовой
природы – гемэритрин и гемоцианин. Они не относятся к гемсодержащим хромопротеинам,
хотя в их названиях содержится корень «гем». Эти белки, как и гемоглобин,
несмотря на то что выполняют одну и ту же функцию, сильно различаются между
собой по молекулярной массе и четвертичной структуре, химической природе
активного центра, характеру связывания железа (гемэритрин) и меди (гемоцианин)
с кислородом и др. (табл. 2.2).
Трансферрины
(сидерофилины) – группа сложных белков, полученных из разных источников и
характеризующихся способностью специфично, прочно и обратимо связывать ионы
железа Fe (III) и других переходных металлов. Наиболее
подробно из этой группы белков изучен трансферрин сыворотки крови. Функция
трансферрина заключается в транспорте ионов железа в ретикулоциты, в которых
осуществляется биосинтез гемоглобина. Система трансферрин–ретикулоцит считается
весьма перспективной для изучения взаимодействия металла с белком и белковой
молекулы с клеткой.

