Построение контрольной карты гемоглобина

1. Проводим 20 измерений:
1. 117
2. 118
3. 119
4. 120
5. 115
6. 120
7. 125
8. 117
9. 113
10. 116
11. 123
12. 124
13. 121
14. 119
15. 125
16. 115
17. 110
18. 115
19. 117
20. 119
2. Рассчитываем среднее арифметическое по формуле:
Складываем все значения (2368) и делим на 20 (количество измерений). Получаем 118.
3. Рассчитываем среднее квадратичное отклонение по формуле:
Сумма квадратов — 298,8. Делим на 19 (количество измерений минус один). Берем квадратный корень из этого числа. Получаем 4.
4. Рассчитываем коэффициент вариации по формуле:
Делим 4 на 118 и умножаем на 100%. Получаем 3,35.
5. Находим границы карты:
Среднее арифметическое плюс среднее квадратичное отклонение (122)
Среднее арифметическое минус среднее квадратичное отклонение (114)
Среднее арифметическое плюс удвоенное среднее квадратичное отклонение (126)
Среднее арифметическое минус удвоенное среднее квадратичное отклонение (110)
Среднее арифметическое плюс утроенное среднее квадратичное отклонение (130)
Среднее арифметическое минус утроенное среднее квадратичное отклонение (106)
6. Строим график
Задача
Вам поручено организовать контроль качества подсчета лейкоцитарной формулы.
1. Как готовятся контрольные мазки для подсчета лейкоцитарной формулы?
2. Какие требования предъявляются к правильному приготовления мазков?
3. Почему не подходит неравномерно (волнообразно) сделанный мазок?
4. Какова методика ведения контроля качества подсчета лейкоцитарной формулы?
1. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом не предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются.
2. Хорошо сделанный мазок крови должен отвечать следующим условием:
2.1. Он начинается на 1-1,5 см от узкого края предметного стекла и кончаться в 2-3 см от его другого края.
2.2. Мазок должен быть равномерной толщины, а не волнообразным.
2.3. Мазок должен быть «свободным с края». Другими словами, слой крови не должен достигать длинного края стекла, а между ним к краем должно остаться расстояние в несколько миллиметров.
3. Распределение клеток неудовлетворительно: толстые участки содержат больше лимфоцитов, тонкие — больше моноцитов и сегментоядерных клеток.
4. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом не предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются. Затем контрольные мазки многократно просчитываются (не менее 20 раз) по 200 клеток. Из полученных данных статистически рассчитываются критерии определения правильности подсчета мазка путем расчета среднего арифметического.
Моноциты — самые большие, без зернистости
Лимфоциты — самые маленькие
Базофилы — зернистость, почти черные
Эозинофилы — круглые ядра, кирпично-красная зернистость
Нейтофилы — палочкоядерные и сегментоядерные, фиолетовая зеернистость, цельное или сигментированное ядро.
Подсчет клеток крови в мазке, практическая работа
Моноциты — 13
Палочкоядерные — 36+10
Сегментоядерные — 47
Базофил — 1
Лимфоцит — 3
Эозинофил — 0
Контрольная карта по гемоглобину (округление до целых)
2. Рассчитываем среднее арифметическое по формуле:
Складываем все значения (2368) и делим на 20 (количество измерений). Получаем 118.
3. Рассчитываем среднее квадратичное отклонение по формуле:
Сумма квадратов — 298,8. Делим на 19 (количество измерений минус один). Берем квадратный корень из этого числа. Получаем 4.
4. Рассчитываем коэффициент вариации по формуле:
Делим 4 на 118 и умножаем на 100%. Получаем 3,35.
Среднее арифметическое плюс среднее квадратичное отклонение (122)
Среднее арифметическое минус среднее квадратичное отклонение (114)
Среднее арифметическое плюс удвоенное среднее квадратичное отклонение (126)
Среднее арифметическое минус удвоенное среднее квадратичное отклонение (110)
Среднее арифметическое плюс утроенное среднее квадратичное отклонение (130)
Среднее арифметическое минус утроенное среднее квадратичное отклонение (106)
Вам поручено организовать контроль качества подсчета лейкоцитарной формулы.
1. Как готовятся контрольные мазки для подсчета лейкоцитарной формулы?
2. Какие требования предъявляются к правильному приготовления мазков?
3. Почему не подходит неравномерно (волнообразно) сделанный мазок?
4. Какова методика ведения контроля качества подсчета лейкоцитарной формулы?
1. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом не предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются.
2. Хорошо сделанный мазок крови должен отвечать следующим условием:
2.1. Он начинается на 1-1,5 см от узкого края предметного стекла и кончаться в 2-3 см от его другого края.
2.2. Мазок должен быть равномерной толщины, а не волнообразным.
2.3. Мазок должен быть «свободным с края». Другими словами, слой крови не должен достигать длинного края стекла, а между ним к краем должно остаться расстояние в несколько миллиметров.
3. Распределение клеток неудовлетворительно: толстые участки содержат больше лимфоцитов, тонкие — больше моноцитов и сегментоядерных клеток.
4. Контрольные мазки готовятся из капиллярной крови доноров и больных обычным способом не предметных стеклах, выполняя требования к правильному приготовлению мазков, фиксируются и окрашиваются. Затем контрольные мазки многократно просчитываются (не менее 20 раз) по 200 клеток. Из полученных данных статистически рассчитываются критерии определения правильности подсчета мазка путем расчета среднего арифметического.
Моноциты — самые большие, без зернистости
Лимфоциты — самые маленькие
Базофилы — зернистость, почти черные
Эозинофилы — круглые ядра, кирпично-красная зернистость
Нейтофилы — палочкоядерные и сегментоядерные, фиолетовая зеернистость, цельное или сигментированное ядро.
Подсчет клеток крови в мазке, практическая работа
источник
Приложение 2. Методические указания по осуществлению контроля качества гематологических исследований
от 23 апреля 1985 г. N 545
Методические указания
по осуществлению контроля качества гематологических исследований
Одним из важных условий получения достоверных результатов гематологических исследований является внедрение в практику работы клинико-диагностических лабораторий контроля качества гематологических исследований, который представляет собой эффективную систему повышения качества определений.
При осуществлении контроля качества гематологических исследований следует руководствоваться методическими указаниями по осуществлению контроля качества работы клинико-диагностических лабораторий, которые даны в приложении к приказу МЗ СССР N 380 от 16 апреля 1975 года «О состоянии и перспективах развития лабораторной клинико-диагностической службы в стране».
В связи со спецификой гематологических исследований контроля качества их предполагает наличие определенных контрольных средств и материалов, которые не используются в других видах лабораторных исследований.
Внутри- и межлабораторный контроль качества гематологических исследований осуществляется под методическим руководством Всесоюзного научно-методического и контрольного центра по лабораторному делу, а также республиканских, краевых и областных организационно-методических и контрольных центров по лабораторному делу.
Врачи-лаборанты, выделенные для работы по контролю качества лабораторных исследований, внедряют внутри- и межлабораторный контроль качества в практику работы всех клинико-диагностических лабораторий на установленной территории.
II. Внутрилабораторный контроль качества
Внутрилабораторный контроль качества гематологических исследований может осуществляться с помощью методов, использующих специальные контрольные материалы или средства, и ряда методов, не требующих контрольных материалов:
1. Исследование параллельных проб.
2. Исследование случайных проб.
3. Исследование повторных проб.
4. Исследование смешанной пробы.
5. Метод средней нормальных величин (по данным больных).
6. Межлабораторный контроль качества.
Методы, основанные на использовании специальных контрольных материалов. Методы, использующие специальные контрольные материалы, дают возможность проводить контроль правильности и воспроизводимости результатов гематологических исследований. Основным требованием к контрольным материалам является их стабильность во времени. Приготовление контрольных материалов для гематологических исследований связано с трудностями, обусловленными кратким сроком жизнедеятельности клеток крови вне организма и быстрым нарушением их функциональных и физико-химических свойств в течение времени. По этой объективной причине срок годности контрольного материала ограничен.
В настоящее время рекомендуются следующие контрольные материалы:
1. Стандартный раствор гемиглобинцианида (производство ВНР).
3. Раствор гемолизированной крови.
5. Фиксированные клетки крови (суспензия).
6. Клетки синтетических и других материалов, имитирующие клетки крови.
7. Контрольные мазки (окрашенные и неокрашенные, нормальные и патологические).
Контроль воспроизводимости (или сходимости) результатов гематологических исследований осуществляют с помощью контрольных материалов и расчета статистических параметров для оценки качества _ работы: средней арифметической величины (Х), среднеквадратического отклонения (S) и коэффициента вариации (V). Для этого в течение 20 рабочих дней в контрольном материале исследуют выбранный компонент методом, применяемым в данной лаборатории. Если какой-либо из результатов резко отличается от остальных, то его оценивают с помощью критерия Т.
После установления статистических критериев строится карта контроля качества, представляющая собой систему координат, на оси абсцисс которой откладывают дни исследований, а на оси ординат — концентрацию компонента в соответствующих единицах. Через середину оси ординат параллельно абсциссе проводят прямую (обозначает среднюю арифметическую) и вверх и вниз от средней и параллельно ей проводят в соответствии с выбранным _ _ масштабом прямые, которые обозначают контрольные пределы Х + 2S и Х — 2S.
Контрольная карта строится на каждый компонент и на одну серию контрольного материала. При перемене серии контрольного материала нужно провести 20-дневные исследования и построить новую контрольную карту.
Каждый результат, полученный в дальнейшем при исследовании контрольного материала той же серии в последующие дни, отмечается на карте в виде точки и служит для оценки воспроизводимости результатов данного компонента.
Пример 1. Построение контрольной карты для гемоглобина. В течение 20 дней определения содержания гемоглобина в контрольном растворе получены следующие результаты:
При использовании контрольных карт целесообразно пользоваться предупредительными и контрольными критериями, ориентируясь на которые можно обнаружить недостатки в работе лаборатории.
Контроль правильности результатов гематологических исследований осуществляют с помощью контрольных материалов с исследованным содержанием компонентов, расчета статистических параметров и определения достоверности различий между полученным и паспортным значением.
При этом следует сделать 10 параллельных исследований компонента в контрольном материале, рассчитать из полученных результатов среднюю арифметическую величину и сравнить с паспортными данными этого компонента. Если полученный результат укладывается в пределы допустимых отклонений, имеющихся в паспорте контрольного материала, то правильность исследований — удовлетворительная. В противном случае следует оценить достоверность различий результатов с помощью статистических критериев (например, по тесту Стьюдента).
Методы, не требующие контрольных материалов
Исследование параллельных проб позволяет оценить воспроизводимость результатов исследований с помощью образцов крови больных. Для этого отбирают 10 случайных проб и каждую пробу исследуют дважды. Результаты таких дублированных анализов используются для характеристики качества исследований.
Пример 2. Для оценки воспроизводимости результатов подсчета лейкоцитов исследовали параллельно 10 образцов цельной крови с антикоагулянтом. Результаты представлены в табл. 5.
Определение воспроизводимости с помощью
дублированного подсчета количества лейкоцитов (10 проб)
Сначала находят разницу между значениями каждой пары, опуская знаки; затем разницу возводят в квадрат, все складывают и делят на 2n (где n — число пар), так как каждая пара представляет собой индивидуальную переменную и каждый член пары имеет свою собственную вариабельность.
Затем рассчитывают среднеквадратическое отклонение различий и строят контрольную карту для оценки воспроизводимости, аналогичную описанной выше для контрольных проб. Разницу между двумя анализами, сделанными для одной и той же пробы, отмечают каждый день на карте. Контрольные пределы карты — 0 +- 2S (в примере для подсчета лейкоцитов — от -1,157 до +1,157). Результаты, попадающие вне контрольных пределов, с 95% вероятностью покажут существование каких-то нарушений в аналитической системе. В этом случае выявляют возможную причину большого разброса результатов и исследование повторяют более тщательно.
Исследование случайной пробы. Метод этот аналогичен предыдущему методу параллельных проб. Разница заключается в том, что вместо анализа всех проб лаборант выборочно исследует повторно пробы (одну или две пробы). Эти пробы могут также случайно выбираться заведующим лабораторией без ведома лаборанта. Таким путем зав. лабораторией оценивает воспроизводимость результатов, получаемых лаборантами.
Исследование повторных проб. Принцип метода состоит в повторном исследовании нескольких случайно выбранных проб, число которых пропорционально количеству проводимых исследований.
Сравнивая соответствующие пары результатов, получают объективные данные о качестве проведенных исследований. Повторные исследования проб должны проводиться после выполнения анализов текущего дня.
При применении этого метода 5% образцов должны исследоваться повторно.
Метод повторных определений дает возможность оценить качество работы аппаратуры и лаборанта во время исследований. Метод может использоваться в любой лаборатории вне зависимости от количества производимых анализов. Недостатком его является невозможность контроля правильности полученных результатов.
Пробы, выдранные для повторных исследований, могут исследоваться и на следующий день с целью калибровки аппаратуры. Для консервации клеток крови добавляют ЭДТА из расчета 1 — 2 мг на 1 мл крови. Хранить пробы необходимо при 4 град.С.
Исследование смешанной пробы. При оценке воспроизводимости методом дублированных проб получают более близкие значения, чем обычно получают при наличии случайных ошибок. В методе смешанной пробы это исключено. Метод состоит в следующем: из группы образцов случайно выбирают два (А и В); из каждого образца А и В берут равные объемы и смешивают (образец С); исследуют все три образца.
Определение воспроизводимости по смешанным пробам
КУПИТЬ
Инструкция для печати (в формате pdf)
УТВЕРЖДАЮ
Руководитель Департамента государственного контроля качества, эффективности, безопасности лекарственных средств и медицинской техники МЗ РФ Р.У. Хабриев 17.03.2000 г.
Рекомендована к утверждению Комиссией по лабораторным реагентам Комитета по новой медицинской технике МЗ РФ (протокол № 8 от 25.10.1999 г.) ИНСТРУКЦИЯ по применению набора контрольных растворов гемоглобина
НАЗНАЧЕНИЕ
Набор контрольных растворов гемоглобина предназначен для контроля правильности и воспроизводимости определения гемоглобина в крови унифицированным гемиглобинцианидным методом. Набор может быть также использован для контроля правильности и воспроизводимости других методов определения гемоглобина, основанных на принципе трансформирования, то есть на переводе всех форм гемоглобина в одну: пиридин-гемхромогеновый, гемихромный (под действием поверхностно-активных веществ), метод с образованием щелочного гематина D-575 и других. Набор предназначен для использования в клинико-диагностических и биохимических лабораториях. Содержимое набора «Гемоглобин-Контроль» должно обеспечить проведение 250 определений по контролю качества.
ПРИНЦИП МЕТОДА
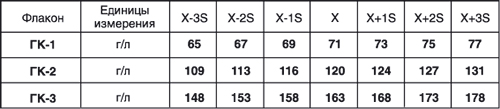
Принцип действия набора «Гемоглобин-Контроль» основан на выявлении погрешности в результатах определения концентрации гемоглобина путем сравнения полученных опытных результатов с приведенными в паспорте значениями. В паспорте для каждого диапазона концентраций указаны: — точные средние значения концентрации гемоглобина; — 95% доверительные интервалы; — параметры для построения контрольной карты.
ХАРАКТЕРИСТИКА НАБОРА
Набор контрольных растворов гемоглобина поставляется в двух вариантах комплектации: Комплектация № 1 состоит из трех флаконов, содержащих по 5,0 мл контрольного раствора гемоглобина каждый: Флакон 1 — с содержанием гемоглобина 65–75 г/л (ГК-1); Флакон 2 — с содержанием гемоглобина 110–130 г/л (ГК-2); Флакон 3 — с содержанием гемоглобина 145–175 г/л (ГК-3).
Комплектация № 2 состоит из 3 флаконов, содержащих по 5,0 мл контрольного раствора гемоглобина с содержанием гемоглобина 110–130 г/л (ГК-2).
АНАЛИТИЧЕСКИЕ ХАРАКТЕРИСТИКИ НАБОРА
Диапазон определяемых концентраций гемоглобина — от 65 до 175 г/л. Коэффициент вариации результатов определения концентрации гемоглобина в одной и той же пробе — не более 2%. Отклонение концентрации контрольного раствора гемоглобина от паспортной величины — не более 2%.
МЕРЫ ПРЕДОСТОРОЖНОСТИ
Контрольные растворы гемоглобина «Гемоглобин-Контроль» изготовлены на основе крови доноров, прошедшей медицинское освидетельствование согласно приказу МЗ СССР № 408 от 12.07.89 г., в том числе на отсутствие антител к возбудителям гепатита и СПИДа. В качестве консерванта контрольный раствор гемоглобина содержит этиленгликоль. Применяется только «ин витро». При работе с данным набором необходимо соблюдать правила техники безопасности, рекомендуемые при работе с кровью в соответствии с «Инструкцией по мерам профилактики распространения инфекционных заболеваний при работе в клинико-диагностических лабораториях лечебных и профилактических учреждений» утвержденной Минздравом СССР 17.01.91 г. При работе с набором следует надевать одноразовые резиновые или пластиковые перчатки, так как образцы крови человека следует рассматривать как потенциально инфицированные, способные длительное время сохранять или передавать ВИЧ, вирус гепатита или любой другой возбудитель вирусной инфекции.
ОБОРУДОВАНИЕ
Спектрофотометр, фотоэлектроколориметр или гемоглобинометр.
ПРОВЕДЕНИЕ КОНТРОЛЯ
1. Контроль правильности определения гемоглобина крови. Определение концентрации гемоглобина в контрольном растворе проводят так же, как и анализ проб крови. Если полученный результат по контрольным растворам входит в указанный в паспорте 95% доверительный интервал, то результаты исследования проб считаются правильными.
2. Контроль воспроизводимости определения гемоглобина крови методом контрольных карт. Карты контроля качества (для каждого диапазона концентраций) строят, откладывая на оси абсцисс дни исследования, а на оси ординат — концентрацию гемоглобина в г/л. Параллельно абсциссе проводят прямые, соответствующие среднему значению (Х) и отклонениям (-3SD, −2SD, −1SD, +1SD, +2SD, +3SD), величины которых приведены в паспорте. Ежедневно проводят по одному определению для каждого диапазона концентраций, и результаты наносятся на графики в виде точек. Интерпретация результатов контрольных исследований производится в соответствии с Приказом Минздрава № 545 от 23.04.85 г и соответствующими методическими рекомендациями.
УСЛОВИЯ ХРАНЕНИЯ И ЭКСПЛУАТАЦИИ НАБОРА
Набор следует хранить в упаковке предприятия-изготовителя при температуре +2–8° С в течение всего срока годности. Допускается хранение наборов при температуре до +25° С не более 5 суток. Срок годности — 2 года. После вскрытия контрольные растворы устойчивы в течение 6 месяцев, но не более указанного срока годности набора при хранении в укупоренном виде при температуре +2–8° С.
По вопросам, касающимся приобретения наборов и их качества, просим обращаться по адресу: 105173, г. Москва, ул. Западная, д. 2, стр. 1, ООО «Агат—Мед». Телефон для справок: (495) 777-41-92.
Инструкция составлена: к.б.н. И.В. Смирновым — ст.н.с. Гематологического научного центра РАМН, к.б.н. Н.Н. Контугановым, В.В. Майоровой — сотрудниками ООО «Агат—Мед».
ПРИМЕР АТТЕСТАТА
набора контрольных растворов гемоглобина
Сер. Годен до

Регистрационные удостоверения
Назад к списку инструкций
