Причины анемии при опухоли
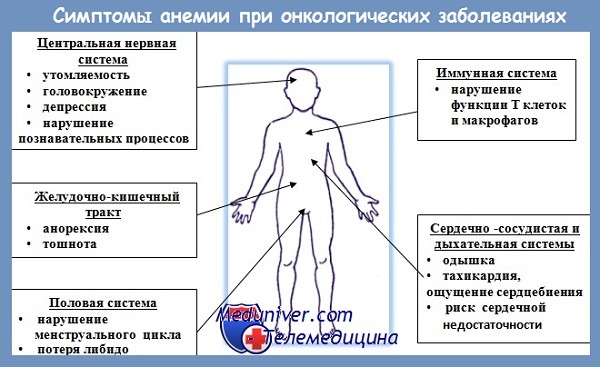

Анемия представляет собой патологическое состояние, для которого характерно снижение эритроцитов и/или концентрации гемоглобина в единице объема крови. Анемия не является самостоятельным заболеванием, это симптом, который характерен для самых разнообразных заболеваний, в том числе и для злокачественных опухолей.
Согласно статистике, данное состояние выявляется у каждого третьего онкологического пациента, а при прохождении химиотерапии — более чем в 90% случаев. Опасность анемии в онкологии заключается в том, что вместе с уменьшением уровня гемоглобина и эритроцитов, уменьшается и кислородная емкость крови. Этот фактор неблагоприятно сказывается на течении ракового процесса, снижает эффективность лечения и ухудшает дальнейший прогноз.
Основные причины развития анемии у онкологических пациентов
Снижение уровня эритроцитов и гемоглобина может развиваться вследствие снижения их образования, ускоренного разрушения или в результате потери. Каждой из этих причин способствуют собственные факторы, которые рассмотрим подробнее:
- Недостаточная выработка форменных элементов крови и гемоглобина может развиваться при поражении костного мозга, недостатке железа в организме или некоторых витаминов (фолиевая кислота, витамин В12). Данные состояния могут быть напрямую связаны с напрямую с онкологическим заболеванием. Например, потеря железа может развиваться в результате постоянной рвоты, отсутствия аппетита и нарушения его всасывания в кишечнике, который поражен опухолевым процессом. Некоторые виды препаратов, которые назначают при злокачественных опухолях, подавляют рост не только раковых клеток, но и клеток крови, которые активно делятся. Также анемия может развиваться при непосредственном поражении костного мозга опухолевым процессом.
- Ускоренное разрушение эритроцитов отмечается при воздействии различных лекарственных препаратов и при аномальной активности иммунной системы. Разрушение эритроцитов непосредственно в сосудах называется внутрисосудистым гемолизом. Этот процесс протекает в норме после завершения жизненного цикла эритроцитов, который составляет 120 дней. Однако при воздействии различных факторов (прием антибиотиков, цитостатиков, присоединение вторичной инфекции и др.), этот срок значительно уменьшается, что и приводит к развитию анемии.
- Кровопотеря у онкологических пациентов может быть как острой, так и хронической. Первый вариант встречается при проведении хирургического лечения рака, а также при развитии внутренних кровотечений, которые являются частым осложнением основного заболевания. Развитие анемии при хронической кровопотере отмечается в тех случаях, когда имеется скрытый источник незначительного кровотечения. Например, при колоректальном раке кровь может выделяться с калом незаметно для пациента.
Установление точной причины анемии играет решающее значение при выборе метода лечения. Кроме того, врач учитывает степень тяжести, тип анемии, общее состояние пациента и другие параметры. Получить эту информацию можно на диагностическом этапе.
Как выявить анемию
Обследование традиционно начинается с опроса пациента и сбора анамнеза. Врач должен помнить, что не всегда анемия развивается вследствие основного заболевания. Возможны наследственные или любые другие причины, которые не связаны с опухолевым процессом. Также необходимо установить вид предшествующего противоопухолевого лечения, продолжительность и количество курсов, наименование препаратов, которые применялись. На следующем этапе врач проводит общий осмотр. Анемия может проявляться бледностью кожных покровов, слабостью, потерей аппетита, головокружением и другими симптомами. Очень часто эти проявления отмечаются при различных видах рака, который протекает без анемии, поэтому поставить диагноз исходя только из жалоб пациента невозможно.
Объективную информацию можно получить только при помощи лабораторных исследований. Анемия диагностируется по следующим анализам:
- Количество ретикулоцитов.
- Уровень железа сыворотки крови.
- Уровень белка трансферрина и ферритина.
- Уровень витамина В12 и фолиевой кислоты.
Отдельное внимание уделяется общему анализу крови. В нем определяется уровень гемоглобина, количество эритроцитов и гематокрит (отношение форменных элементов к жидкой составляющей крови). Также определяют средний объем эритроцита, среднее содержание гемоглобина в эритроците и среднее содержание гемоглобина во всей эритроцитарной массе.
При необходимости в программу комплексного обследования при анемии могут включаться и другие лабораторные анализы или специальные методы.
Как классифицируется анемия
В зависимости от значения цветового показателя, степени тяжести и механизма развития, анемия разделяется на несколько категорий. Цветовой показатель крови отражает степень насыщения эритроцитов гемоглобином. Его значение в норме колеблется от 0,85 до 1,05 единиц. Снижение показателя отмечается при гипохромной анемии, а повышение — при гиперхромной. Если цветовой показатель в норме, но уровень гемоглобина все равно низкий, то говорят о нормохромной анемии.
По степени тяжести, анемия разделяется на три группы, в зависимости от концентрации гемоглобина:
- При легкой степени анемии уровень гемоглобина не опускается ниже отметки в 90 г/л.
- При средней степени анемии показатель колеблется в пределах 90-70 г/л.
- Тяжелая анемия характеризуется падением гемоглобина ниже 70 г/л.
Классификация анемии по механизму развития наиболее обширна. Среди распространенных форм отмечаются:
- Железодефицитная анемия. Развивается в результате нарушения всасывания, усиленной потери или недостаточного поступления железа в организм.
- Гемолитическая анемия. Характеризуется разрушением эритроцитов в сосудистом русле или за его пределами. Наиболее частые причины — недостаточность специфических ферментов, аутоиммунные заболевания, воздействие лекарственных препаратов.
- Постгеморрагическая анемия. Данное состояние характерно для острой или хронической кровопотери
- Апластическая анемия. Характеризуется снижением уровня клеток-предшественников эритроцитов в костном мозге. Обычно отмечается снижение и других форменных элементов — тромбоцитов и лейкоцитов.
- В12-дефицитная анемия. При недостатке витамина В12 нарушается процесс образования эритроцитов, снижается их продолжительность жизни. Дефицит витамина может быть связан как с нарушением его всасывания в кишечнике, так и с недостаточным поступлением в организм.
В большинстве случаев определить точный вид анемии можно после нескольких лабораторных тестов, но иногда приходится применять более сложные методы диагностики, например, генетическое исследование. Понимание механизма развития анемии и получение максимально полной информации об изменениях в показателях крови являются важным компонентом эффективной терапии данного симптома.
Методы лечения анемии
Устранить анемию у онкологических пациентов можно тремя способами: переливание эритроцитарной массы, введение эритропоэтина, назначение препаратов, содержащих железо. В отдельных случаях может применяться комбинация этих методов.
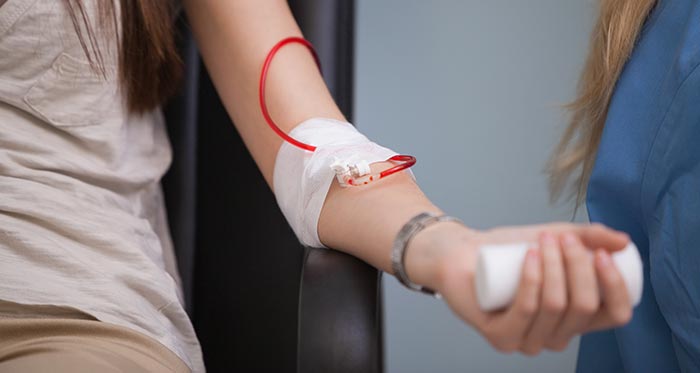
Переливание эритроцитарной массы при анемии
Переливание эритроцитарной массы является самым действенным методом, при помощи которого можно быстро восполнить дефицит эритроцитов, восстановить уровень гемоглобина и гематокрита. Однако без устранения причины анемии, этот способ даст лишь временный эффект. Поэтому переливание эритроцитарной массы не является альтернативой другим методикам и применяется только при наличии показаний. Одним из них является снижение уровня гемоглобина ниже 90 г/л. Переливание проводят при развитии у пациента характерных признаков анемии, среди которых отмечаются:
- Головокружение.
- Потеря сознания.
- Тахикардия.
- Быстрая утомляемость.
- Боль в груди.
- Одышка.
Данный метод лечения анемии также может применяться у пациентов, которые прошли курс химиотерапии или лучевой терапии и у которых отмечается быстрое снижение уровня гемоглобина или эритроцитов.
Применение стимуляторов эритропоэза
Стимуляторы эритропоэза при анемии увеличивают концентрацию гемоглобина и эритроцитов за счет усиления их образования в костном мозге. При сочетании с гемотрансфузиями, данный метод показывает очень хорошие результаты, но при этом имеет и ряд недостатков, которые касаются осложнений. В частности, применение стимуляторов эритропоэза для лечения анемии повышает риск развития тромботических осложнений, который и так является высоким у онкологических пациентов. По данным, полученным в ходе нескольких научных исследований, этот риск увеличивается в 1.4-1.7 раз.
В последнее время обсуждается вопрос о влиянии стимуляторов эритропоэза на выживаемость онкологических пациентов. В частности, специалисты установили, что применение препаратов данной группы при лечении анемии у пациентов с распространенным опухолевым процессом головы и шеи, шейки матки, молочной железы и других диагнозах снижает продолжительность жизни на 10-17%. В связи с этим специалисты предлагают придерживаться следующих правил:
- Если уровень гемоглобина составляет менее 100 г/л и пациент при этом проходит лечение химиопрепаратами, то стимуляторы эритропоэза могут назначаться с целью коррекции анемии и профилактики дальнейшего снижения показателей.
- Если уровень гемоглобина падает до 100 г/л и ниже, но химиотерапия при этом не проводится, то применять стимуляторы эритропоэза не рекомендуется ввиду повышенного риска развития осложнений и снижения продолжительности жизни.
- Во всех остальных случаях применять стимуляторы эритропоэза для лечения анемии у онкологических пациентов следует с осторожностью.
Также на протяжении всего времени лечения важно контролировать динамику лабораторных показателей и при увеличении уровня гемоглобина постепенно снижать дозировку стимуляторов эритропоэза.
Препараты железа при лечении анемии
Препараты железа применяются с целью лечения железодефицитных анемий, которые выявляются у 30-60% онкологический больных. При этом снижение уровня железа может быть связано как с самим опухолевым процессом или проводимым лечением, так и с другими факторами. Например, при назначении стимуляторов эритропоэза, существующего запаса железа в организме становится недостаточно для того, чтобы покрыть потребность, которая возникает в результате активного синтеза гемоглобина в костном мозге.

Для лечения анемии могут применяться как внутривенные, так и пероральные препараты. Второй вариант более удобен для пациента, так как таблетки проще принимать, но при этом данная форма действует медленнее и чаще приводит к осложнениям со стороны ЖКТ. Внутривенное введение позволяет добиться быстрого эффекта, что актуально при проведении химиотерапии.
Таким образом, для лечения анемии современная онкология может предложить различные методы, которые воздействуют на механизмы развития данного симптома. Точный план терапии подбирается индивидуально для каждого пациента, с учетом лабораторных показателей крови, особенностей лечения основного заболевания и других параметров.
Лечение анемии народными способами
Некоторые пациенты по разным причинам отказываются от приема описанных выше препаратов и обращаются к народной медицине. Безусловно, некоторые растения или продукты могут оказывать стимулирующее действие на систему кроветворения. Однако, учитывая основной диагноз и тяжесть анемии, этого действия крайне недостаточно для восстановления уровня гемоглобина и кислородной функции крови. В результате снижается эффективность противоопухолевого лечения, ухудшается прогноз и существенно повышается риск неблагоприятного исхода. Устранить выраженную анемию в домашних условиях при помощи народных методов невозможно. Этим должны заниматься врачи соответствующего профиля, в распоряжении которых имеются современные лекарственные препараты.
Источник
Анемия при опухолях (онкологических заболеваниях) – причины, механизмы развитияАнемия нередко осложняет течение различных новообразований. До 40 % больных со злокачественными лимфомами и более половины больных с множественной миеломой уже к моменту постановки диагноза имеют выраженную анемизацию. У 1/4 больных с миеломой содержание гемоглобина не превышает 80 г/л, а количество больных с анемией среди больных с лимфомами по окончании лечения увеличивается до 70 %. Считается, что эта проблема менее значима при солидных опухолях. Тем не менее анализ данных донорских регистров США свидетельствует, что до 50— 60 % больных с опухолями гинекологической сферы, мочеполовых органов и легкого получали заместительные гемотрансфузии в период проведения химиотерапии. Более половины из 7000 больных с анемией, включенных в контролируемые популяционные исследования по применению эритропоэтина у больных с неоплазиями, имели солидные опухоли. В 2001 г. проведено проспективное изучение частоты анемии у больных с опухолевыми заболеваниями в Европе (ECAS). Содержание гемоглобина было сниженным у 31 % первичных больных, не получавших лечения, и у 42 % больных, которым проводили химио- или радиотерапию. Если у больных не было анемии на момент постановки диагноза, то в большинстве случаев (62 %) она развивалась в процессе лечения. Анемия возникала у 63 % больных, получавших химиотерапию (у 75 % после режимов, содержащих препараты платины, и у 54 % после прочих), у 42 % больных после сочетанного применения химио- и радиотерапии и у 20 % больных только после лучевого воздействия. Лишь 40 % больных с анемией, выявленной исходно или на протяжении лечения, получали заместительные гемотрансфузии или эритропоэтин.
Патогенез анемий при опухоляхПри опухолевых заболеваниях патогенез анемии многообразен. Основные причины — кровотечение, дефицит витаминов и железа, аутоиммунный гемолиз, метастазирование в костный мозг, токсичность цитостатиков и др. Анемия нередко развивается у больных, не имеющих для этого видимых причин. Такая «не спровоцированная» анемия может определяться гиперпродукцией провоспалительных цитокинов (ИЛ-1, ФНО и ИФН-у) при опухолевых заболеваниях. Повышение концентрации этих соединений обычно наблюдается при заболеваниях, сопровождающихся хроническим воспалением, например при ревматоидном артрите, и также сопровождается анемизацией. Возникающая при этом анемия называется анемией опухолевого или хронического заболевания. Отрицательное влияние анемии на качество жизниПри исследовании качества жизни больных с опухолевыми заболеваниями слабость выделена как одна из наиболее распространенных жалоб. В частности, слабость осложняет проведение химиотерапии у 76 % больных, тошнота — у 54 % и боль у 24 % больных. В генезе слабости могут играть роль такие факторы, как нарушение нейромышечной проводимости, повышение уровня метаболизма белков, снижение питания и аффективные расстройства (депрессия). В то же время при многовариантном статистическом анализе одним из самых значимых независимых прогностических факторов слабости была анемия. Современные данные свидетельствуют о появлении слабости, снижающей показатели качества жизни, при содержании гемоглобина менее 120 г/л. В контролируемых исследованиях по лечению анемии максимальное снижение слабости и прирост показателей качества жизни наблюдались при повышении содержания гемоглобина до 120 г/л. Слабость, снижение физической и социальной активности часто недооцениваются врачами, которые не склонны считать эти проблемы важными по сравнению с болью, рвотой или инфекцией. В современных работах по выявлению значимости основных жалоб больных с опухолевыми заболеваниями слабость и социальная дезадаптация занимают лидирующее место. В одном из исследований на вопрос, что следует лечить в первую очередь: слабость или боль, большинство больных выбрали слабость. На тот же самый вопрос 95 % врачей ответили противоположным образом. Снижение эффективности противоопухолевого лечения при анемииАнемия и как следствие тканевая гипоксия могут сказаться на эффективности лекарственного и лучевого противоопухолевого лечения. Противоопухолевый эффект радиации связан с образованием свободных радикалов, которые взаимодействуют с основаниями ДНК в присутствии молекулярного кислорода, что останавливает клеточную пролиферацию и вызывает гибель клеток. Недостаток кислорода замедляет этот процесс. В клетке, находящейся в состоянии гипоксии, свободные радикалы не фиксируются к ДНК и мембранам и, таким образом, смерть клетки может не наступить. Впервые снижение эффекта облучения при гипоксии описал врач из Вены Готвальд Шварц в 1909 г.. Он обратил внимание на то, что при наложении на кожу радиоактивной пластины лучевая реакция непосредственно под ней значительно снижена. Исследователь объяснил свое наблюдение тем, что сдавление сосудов под тяжестью радиоаппликатора вызывает анемизацию подлежащей области и снижает эффект облучения. В последующем эта гипотеза была подтверждена в эксперименте с облучением культур бактерий, находящихся в гипоксическом состоянии, и в клинических наблюдениях. Так, в исследовании D. М. Brizel непосредственная эффективность радиотерапии и долговременная выживаемость больных с опухолями головы и шеи были в 2 раза ниже при напряжении кислорода в опухоли менее 10 мм рт. ст.. Было отмечено, что гипоксическое состояние опухоли коррелировало с содержанием гемоглобина в крови. В других исследованиях показано, что ткани опухоли находятся в более гипоксическом состоянии, чем окружающие нормальные ткани. Обычно гипоксия опухоли возникает в тот момент, когда ее рост превышает способность локальной микрососудистой сети доставлять достаточное количество кислорода к опухолевым клеткам. Оксигенация опухоли в основном определяется объемом кровотока, степенью развитости микроциркуляции и содержанием гемоглобина; таким образом, снижение количества гемоглобина крови может ухудшить оксигенацию опухоли. Изучали влияние собственно анемии на чувствительность опухоли к радиотерапии. В одном из ретроспективных исследований прослежена долговременная выживаемость 889 больных с чешуйчато-клеточным раком головы и шеи, получавших радиотерапию. Пятилетняя выживаемость мужчин с содержанием гемоглобина более 130 г/л и женщин более 120 г/л составила 58,2 %, что контрастировало с уровнем этого показателя (28,4 %) для больных, у которых содержание гемоглобина оказалось ниже. На модели фибросаркомы у мышей на опухолевые клетки, находящиеся в состоянии гипо- и нормоксии, воздействовали различными цитотоксичными препаратами. Оказалось, что клетки, находящиеся в состоянии гипоксии, были в 2—6 раз более резистентными к таким цитостатикам, как циклофосфамид, кармустин (BCNU), карбоплатин и мелфалан, чем опухолевые клетки, находящиеся в состоянии нормальной оксигенации. Клиническая значимость этих наблюдений неясна, однако данные, полученные в последние годы у больных раком шейки матки, подтверждают концепцию о способности гипоксии индуцировать селекцию клеток, резистентных к апоптозу, и то, что данный механизм определяет злокачественную прогрессию опухоли. – Также рекомендуем “Лечение анемии при опухолях (онкологических заболеваниях) – эффективность эритропоэтина” Далее рекомендуем для ознакомления следующие статьи:
|
Источник
