Принципы лечения аутоиммунных гемолитических анемий
Разделяют идиопатические аутоиммунные анемии и вторичные аутоиммунные анемии.
Вторичные аутоиммунные гемолитические анемии развиваются на фоне следующих заболеваний: ревматоидного артрита, склеродермии, синдроме Сьегрена, лимфопролиферативных заболеваниях, других злокачественных заболеваниях, грибковых инфекциях, тимомах, язвенном колите, В12-дефицитной анемии, болезни Кавасаки, первичном биллиарном циррозе печени.
При отсутствии причин для аутоиммунной гемолитической анемии верифицируют идиопатическую АИГА.
АИГА — гемолитическая анемия, возникающая в результате изменения функции иммунной системы организма, вследствие чего против собственных неизмененных антигенов эритроцитов вырабатываются AT.
Этиология.
Причины развития АИГА, как и многих других аутоиммунных заболевании, не ясны. Обсуждается воздействие некоторого триггерного агента (возможно, вируса или микроорганизма), вследствие которого происходит срыв иммунологической толерантности к собственному антигену.
Патогенез.
Характер патогенетических механизмов при АИГА зависит, главным образом, от характера AT, вырабатывающихся против собственных неизмененных антигенов эритроцитов.
Нагруженные антителами (агглютининами или преципитинами) эритроциты разрушаются в селезенке, печени и костном мозге, гемолиз осуществляется по внутриклеточному типу.
AT класса гемолизинов при фиксации на поверхности эритроцита вызывают гибель клетки внутри сосуда.
Проявления заболевания будут в первую очередь определяться механизмом разрушения эритроцитов — внутриклеточным или внутрисосудистым.
Классификация AT: по механизму действия (агглютинины, гемолизины, преципитины); по температурному оптимуму активности (тепловые, холодовые); по серологической характеристике (полные, неполные).
Клиническая картина.
Наиболее частым вариантом является АИГА, обусловленная неполными тепловыми агглютининами (анемия с внутриклеточной гибелью эритроцитов).
Жалобы вызваны развитием гипоксии тканей (резкая слабость, сонливость, обмороки, одышка, сердцебиение).
Часто отмечается субфебрильная или фебрильная температура тела.
У некоторых больных, особенно пожилых, возможно развитие анемической прекомы и комы.
У больных с поражением сердца высока вероятность острой левожелудочковой недостаточности.
При осмотре: резкая бледность кожи и видимых слизистых оболочек. Образование из НЬ разрушающихся эритроцитов большого количества непрямого билирубина ведет к развитию желтухи.
У 2/3 больных выявляется увеличение селезенки и более чем у половины больных — печени.
При АИГА, обусловленной образованием AT класса гемолизинов (анемия с внутрисосудистой гибелью эритроцитов), больные жалуются на боли в поясничной области, повышение температуры тела, появление мочи черного цвета, а также предъявляют жалобы, связанные со снижением содержания НЬ (анемический синдром).
Кожа и видимые слизистые оболочки бледные.
Увеличение селезенки встречается нечасто, и размеры ее невелики. Диагностика.
Сочетание анемического синдрома, желтушности кожи и (или) слизистых оболочек, а также увеличение селезенки должно заставить врача в первую очередь заподозрить АИГА с внутриклеточным механизмом разрушения эритроцитов.
Такое предположение требует незамедлительного исследования периферической крови с обязательным определением количества ретикулоцитов.
В крови отмечается значительное снижение содержания эритроцитов и НЬ. Цветовой показатель близок к единице, СКО эритроцитов находится в пределах 80—95 фл (нормоцитоз).
Содержание ретикулоцитов значительно увеличено.
В тяжелых случаях возможно появление в периферической крови нормобластов.
Количество лейкоцитов и тромбоцитов находится в пределах нормы. Лейкоцитарная формула не изменена, хотя могут наблюдаться и лейкемоидные реакции по нейтрофильному типу.
СОЭ значительно увеличена. При исследовании мочи может быть зафиксировано появление уробилина.
Кал у больных с АИГА с внутриклеточным механизмом разрушения эритроцитов приобретает более темную, по сравнению с обычной, окраску.
Для верификации диагноза АИГА с внутриклеточным механизмом разрушения эритроцитов используют тест, определяющий наличие AT на поверхности эритроцитов — положительная прямая проба Кумбса (проба Кумбса: антиглобу- линовую сыворотку кролика, полученную путем его сенсибилизации у-глобулином человека, добавляют к исследуемым эритроцитам.
Сыворотка не вызывает агглютинацию нормальных отмытых эритроцитов, но при присоединении антиглобулиновой сыворотки к эритроцитам, содержащим на своей поверхности неполные AT, белковые молекулы укрупняются и эритроциты агглютинируют).
Более чувствительная проба — реакции агрегатогемагтлютинации.
При появлении у больного мочи черного цвета, боли в поясничной области и анемических жалоб необходимо предположить наличие АИГА с внутрисосудистым вариантом разрушения эритроцитов.
Это предположение усиливается при выявлении нормохромной (нормоцитарной) анемии с увеличением количества ретикулоцитов.
При исследовании мочи выявляется свободный гемоглобин, а при исследовании мочевого осадка отмечается увеличение количества клеток эпителия почечных канальцев с включениями гемосидерина.
Патоморфология костного мозга: гиперплазия красного ростка кроветворения различной выраженности.
При тяжелых гемолитических кризах костный мозг способен увеличивать продукцию эритроцитов в 6—8 раз.
Дифференциальная диагностика.
АИГА с внутриклеточным механизмом разрушения эритроцитов необходимо дифференцировать от других анемических состояний, сопровождающихся увеличением количества ретикулоцитов: постгеморрагической анемией; ЖДА на фоне терапии препаратами железа; В12ДА на фоне терапии витамином В12; ФДА на фоне терапии фолиевой кислотой.
Для разграничения этих состояний большое значение имеет внимательное изучение анамнеза и анализ имеющихся документальных данных о течении заболевания. Важным подспорьем является проба Кумбса, АИГА с внутрисосудистым разрушением эритроцитов необходимо дифференцировать от ПНГ (отрицательные сахарозная проба и проба Хема при АИГА и положительные — при ПНГ).
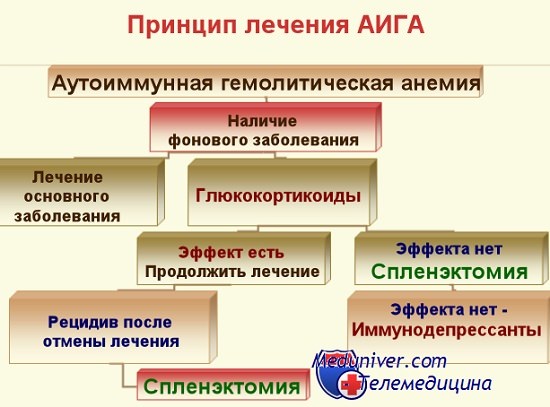
Лечение.
АИГА требует незамедлительного лечения.
Препараты первой линии — ГКС — преднизолон внутрь в дозе 1-2 мг/кг массы тела в сутки.
Признаками эффективности лечения являются прекращение падения НЬ, уменьшение ретикулоцитоза, нормализация температуры тела, улучшение самочувствия больного.
Гемоглобин начинает повышаться на 3—4-й день от начала лечения.
После нормализации показателей периферической крови дозу преднизолона начинают медленно снижать до полной отмены.
Рекомендуемая доза преднизолона для пациентов старше 70 лет с признаками остеопороза — 0,6 мг/кг веса/день.
Если в силу каких-либо обстоятельств больной не может получать ГКС перорально, то при парентеральном введении их дозу необходимо увеличить.
Если преднизолон вводят в/м, его доза должна быть увеличена в два раза, а при в/в введении — в три раза по сравнению с дозой, получаемой перорально.
Следует также учитывать, что при парентеральном введении преднизолон действует кратковременно.
Использование ГКС-терапии позволяет получить стойкий эффект у половины больных.
У остальных лечение преднизолоном дает временный эффект; снижение дозы или полная отмена препарата приводят к развитию рецидива заболевания.
Такие больные нуждаются в постоянном приеме поддерживающей дозы преднизолона или проведении повторных курсов терапии.
Спленэктомия в качестве второй линии терапии показана в следующих случаях:
1) отсутствие эффекта на преднизолон;
2) зависимость от преднизолона в дозе 20 мг/день и более;
3) ранний рецидив после отмены преднизолона.
При АИГА с внутрисосудистой гибелью эритроцитов эффект от спленэктомии меньше и может быть отсроченным.
Терапевтическое действие в этом случае связано с выключением селезенки из процесса синтеза AT.
Для пациентов старше 70 лет и детей спленэктомия не является терапией второй линии в связи с высоким риском развития иммунодефицита и инфекционных осложнений.
Терапия третьей линии.
В случае неэфективности спленэктомии назначаются иммунодепрессанты.
В последние годы получен хороший эффект при лечении АИТА циклоспорином А (сандиммун).
Начальная доза 2,5 мг/кг х 2 раза в день в течение 6 дней с последующим снижением дозы циклоспорина до 3 мг/кг день и добавлением 5 мг/день преднизолона.
Применение циклоспорина А позволяет получать длительные и стойкие ремиссии заболевания.
Микофенолат также показал свою эффективность в терапии АИГА.
Ритуксимаб (Мабтера) 375 мг/м2 1 раз в нед — в течение 4 нед. Некоторые исследователи показывают 100% ответа.
Имуран (азатиолрин — 1,5 мг/кг/день в течение 3 мес) или малые дозы циклофосфамида (2 мг/кг/день х 3 мес). Ответ наблюдается у 50% пациентов.
Высокие дозы циклофосфана (50 мг/кг в день х 4 дня) индуцировали продолжительные ремиссии (15 мес) у 66% пациентов.
Прогноз.
При адекватной терапевтической тактике ведения прогноз у больных с АИГА благоприятный.
Профилактика. Эффективной профилактики АИГА не существует.
Лечение аутоиммунной гемолитической анемии – схемаПоскольку аутоиммунная гемолитическая анемия делится на генуинную и вторичную формы по возможности лечение должно учитывать соответствующие особенности, и тем самым взаимодействовать с механизмами образования антител. При вторичных формах за счет лимфопролиферации следует лечить последнюю в целях пресечения и дальнейшего угнетения разрастания массы злокачественных клеток, сецернирующих аутоантитела. Правильно проводимая терапия ХЛЛ, ЛС, PC защищает больного от тяжелых приступов расплавления крови, естественно поскольку имеются длительные межпрнступные периоды. При аутоиммунной гемолитической анемии, за счет иммунного дефицита или гиперреактивного состояния с дисгаммаглобулинемией, лечить эти явления для устранения условий аутоиммунного гемолиза или даже его предупреждения. Хирургическое вмешательство, облучение или даже лечение цитостатическими средствами — когда это возможно при отдельных видах рака — устраняют причину развития аутоиммунной гемолитической анемии. Однако наиболее часто периоды расплавления крови при вторичных формах заболевания — за исключением заболеваний за счет отсутствия антител — требуют лечение патогенетического характера в целях приостановления процесса. При генуинной аутоиммунной гемолитической анемии с холодовыми или тепловыми антителами, когда не выявляется определенная этиологическая причина, в основном на острых периодах или формах хронического течения методы патогенетической терапии представляются единственно возможными. В подобных случаях заболевания удовлетворительные результаты дает кортизонотерапия, при этом среднесуточная доза преднизона равняется 40—50 мг. При весьма тяжелых формах со сверхострым расплавлением крови, понижением показателя гемоглобина до 3—4 г, продолжительности жизни гематий от 5 до 10 дней назначать большую дозу от 80 до 100 мг в сутки, из расчета примерно 1—1,5 мг на кг веса тела. В большинстве наблюдаемых нами случаях (Берчану и сотр.) при генуинных формах гемолитический процесс был приостановлен на 2—4 неделях лечения. Течение вторичной формы аутоиммунной гемолитической анемии (ДКВ или лимфопролиферация) зависит от реакции первичного заболевания на проводимую терапию. Даже если назначение кортикоидов обусловливает обратное течение гемолитического процесса, в случае неподдающейся лечению злокачественной лимфопролиферации или сложности ее терапии — например в устарелых формах РКВ — расплавление крови возобновляется непосредственно после уменьшения дозы кортизона. По Leddy кортизонотерапия дает положительный результат примерно в 2/3 случаев с первичными заболеваниями, а в 1/3 — лишь относительный результат, причем из них 5—10% составляют безответные случаи. В группе случаев, не реагирующих на лечение или дающих посредственный результат с повторными рецидивами после непрерывной 5—6-месячной кортикотерапии, показана спленэктомия. Этот хирургический метод лечения дает хорошие результаты у больных, у которых наблюдается преимущественно селезеночная секвестрация.
Тем не менее удаление селезенки следует применять и больным с преимущественно печеночной секвестрацией, поскольку этим приемом устраняются важная иммунологическая система выделения аутоантител и значительная масса макрофаговой ткани гемолитичской активности. Спленэктомия также показана при тяжелом гемолитическом заболевании за счет гиперспленизма в результате злокачественной лимфомы и даже при РКВ или хроническом агрессивном гепатите, конечно когда это допускает общее состояние больного. Во всех отмеченных случаях силен-эктомия рассматривается как биологический иммуносупрессорный метод, устраняющий значительную массу лимфоретикулярных клеток с иммуной патологической реакцией. Известно, что, в отдельных случаях, наличие антител отмечается и после удаления селезенки, даже если процесс расплавления крови не возобновляется. Итак, положительный результат объясняется, в основном, устранением пожирающей эритроциты макрофаговой ткани. В нашем опыте, охватившем 100 случаев спленэктомии у страдающих гемолитической анемией (Теодореску и Берчану) в 25% случаев гемоцитопений по различным причинам наблюдались положительные результаты. При гемолитической анемии с холодовыми антителами, развивающейся после вирусной инфекции, нередко специфическая терапия оказывается лишней, поскольку гемолитический эпизод исчезает по истечении периода выздоровления, когда сокращается число аутоантител. При генуинных или первичных, равно как и вторичных послевирусных формах, которые самоподдерживаются, также в заболеваниях за счет злокачественной лимфомы показана кортикотерапия крупными дозами, в связи с тем, что в этих случаях реакция слабее, чем при формах болезни с холодовыми антителами. По истечении 5—6-месячного периода лечения испробовать спленэктомию, хотя положительный результат редкое явление. После непродолжительного улучшения гемолитической анемии процесс расплавления крови возобновляется, болезнь продолжает свое течение и антитела остаются неизменными. В большинстве случаев гемолитической анемии с холодовыми антителами, не поддающейся кортикотерапии и спленэктомии назначать, в принципе, краткосрочную умеренную иммуносупрессорную терапию. Так, иммуран 100 мг в сутки, эндоксан 50—100 мг и лейкеран 4—6 мг за 1—3 месяца сокращают коэффициент антител и интенсивность расплавления крови, вообще устраняя острые приступы. Болезнь приобретает хроническое течение, чередуются периоды хорошого состояния и умеренного гемолиза, что напоминает хроническую гемолитическую желтуху с компенсированной или умеренной анемией. Иные виды терапии симптоматического или патогенетического характера в аутоиммунной гемолитической болезни не оправдываются положительными результатами. В хронических, устойчивых к лечению формах, которые в основном развиваются за счет холодовых антител, следует избегать способствующие усугублению гемолиза условия, в том числе, инфекции, большую физическую нагрузку и стресс от волнения. В частности избегать воздействие холода, холодные ваны и даже контакт с определенными холодными предметами. При аутоиммунной гемолитической анемии с богатым эритробластами регенеративным костным мозгом переливание крови в принципе не представляется необходимым. Когда в костном мозге, особенно на остром периоде, отмечаются заниженный ретикулоцитоз и мегалобластические отклонения назначать фолиевую кислоту и витамин В12, способствующих восстановлению процесса регенерации костного мозга. В очень тяжелых случаях, с острым гемолизом, падением гемоглобина до 3—4 г., когда тканевая аноксия ставит под угрозу жизнь больного помимо кортизонотерапии крупными дозами, включительно внутривенным введением гемисукцината гидрокортизона, также назначать переливание массы промытых гематий, которые, вообще, хорошо переносимы. В периоды приступов эритробластопении проводить повторные переливания промытыми эритроцитами, одновременно с кортикотерапией до восстановления нормального кроветворения, роста показателей гемоглобина, гематокрита и ретикулоцитов. Противопоказано переливание цельной крови, поскольку подвоз ею комплемента и собственно жидкая плазматическобелковая среда усугубляют явления агглютинации и внутрисосудистого расплавления крови. Более сложные условия лечения при аутоиммунных антителах с характеристикой паиагглютинина и пангемолизина, отмечены нами, в основном, при острой анемии лекарственных средств, острой недифференцированной лейкемии и волчанке. На остром периоде болезни больной не переносит ни одной из групп красных кровяных телец, в связи с чем, в первую очередь, помимо кортикоретапии крупными дозами, проводить характерную для злокачественного разрастания цитостатическую терапию — особенно непродолжительными комбинациями синхронизирующего эффекта, в целях быстрого сокращения массы злокачественных клеток. В принципе это обусловливает ослабление процесса аутогемолиза, сокращение коэффициента паиагглютинина и делает возможным переливание промытыми гематиями после их тщательного отбора от доноров, посредством прямого испытания. Впрочем, проведение любого переливания страдающим острым аутоиммуным расплавлением крови требует особой осторожности и наблюдения непосредственного результата гемолиза, наступающего с началом переливания. Значительная концентрация гемолитических антител у больного может обусловить развитие резкого расплавления переливаемых гематий в условиях оптимального испытания в пробирке. Появление клинических признаков даже незначительного гемолиза требует немедленной проверки выделяемого в кровообращение гемоглобина и прекращения переливания при любом незначительном росте. – Также рекомендуем “Пароксизмальная гемолитическая анемия в условиях холода – клиника, диагостика, лечение” Оглавление темы “Гемолитические анемии”:
|
