Приобретенные гемолитические анемии этиология патогенез
Гемолитическая анемия — анемия, возникающая в результате повышенного эритродиереза, когда разрушение эритроцитов преобладает над их образованием.
Классификация. По этиологии гемолитические анемии подразделяются на приобретенные и наследственные. В свою очередь в зависимости от этиологических факторов, вызвавших гемолиз эритроцитов, приобретенные гемолитические анемии делятся на токсические, обусловленные действием экзогенных и эндогенных гемолитических ядов; иммунные (гетеро-, изо-, аутоиммунные), когда гемолиз происходит под влиянием комплекса антиген — антиэритроцитарное антитело; механические — при механическом повреждении эритроцитов; мембранопатии, связанные с соматической мутацией пролиферирующих клеток эритроцитарного ряда и образованием популяции эритроцитов с дефектом структуры мембраны.
На основании того, какие генетические нарушения привели к усилению гемолиза эритроцитов, наследственные гемолитические анемии подразделяют на наследственные мембранопатии, ферментопатии и гемоглобинопатии, вызванные генетическими дефектами структуры мембраны, активности ферментов эритроцитов и синтеза гемоглобина. Имеется две разновидности наследственных гемоглобинопатии: анемии, связанные с нарушением синтеза цепей глобина, и анемии, обусловленные наследственным дефектом первичной структуры цепей глобина.
Этиология приобретенных гемолитических анемий. Токсическая гемолитическая анемияможет развиться под влиянием гемолитических ядов (соединения мышьяка, свинца, нитробензол, фенилгидразин; алкоголь, желчные кислоты, токсические продукты азотистого обмена; змеиный, грибной, пчелиный яды и др.), а также при действии возбудителей инфекционных и паразитарных заболеваний (гемолитический стрептококк, анаэробная инфекция, малярийный плазмодий, лейшмания).
Иммунная (гетеро-, изо-, аутоиммунная) гемолитическая анемияразвивается при переливании видо-, группо- и резус-несовместимой крови; резус-несовместимости матери и плода; образовании аутоантител против собственных эритроцитов при изменении их антигенных свойств под влиянием лекарственных препаратов, вирусов, микроорганизмов или в результате соматической мутации иммуноцитов, когда возникает “запретный” клон лимфоцитов, продуцирующих антитела к нормальным антигенам эритроцитов (при лейкозе, системной красной волчанке и др.).
Механическое повреждение эритроцитовможет возникнуть при протезировании кровеносных сосудов и клапанов сердца, длительном марше или беге по твердому грунту (маршевая гемоглобинурия), спленомегалии.
Причиной приобретенной мембранопатииможет стать соматическая мутация эритробластов под действием вирусов, микроорганизмов, лекарственных препаратов с образованием патологической популяции эритроцитов, у которых нарушается структура мембраны и повышается чувствительность к комплементу (пароксизмальная ночная гемоглобинурия).
Патогенез.Механизм гемолиза при приобретенной гемолитической анемиизаключается в повреждении структуры мембран эритроцитов. Одни гемолитические факторы (например, механические) оказывают прямое повреждающее действие, другие (мышьяковистый водород, нитриты), являясь сильными окислителями, вызывают сначала метаболические, а затем функциональные и структурные изменения в мембране и строме эритроцитов, приводящие к их гемолизу. Многие гемолитические яды биологического происхождения обладают ферментной активностью (лецитиназная активность стрепто-, стафилолизинов, яда насекомых и змей), разрушая лецитин мембран. При иммунных гемолитических анемиях IgG и IgM присоединяют к эритроцитарной мембране комплемент, который при этом активируется и вызывает ее ферментативный лизис.
Под влиянием гемолитических агентов в мембранах эритроцитов образуются поры, через которые из клетки выходят ионы калия, фосфаты, а ионы натрия поступают в клетку. Вследствие сдвигов ионного баланса вода проникает в эритроцит, который при этом набухает, приобретает сферическую форму, его клеточная поверхность уменьшается, снижается способность к деформации. Такие сфероциты не могут пройти через межэндотелиальные поры синусов селезенки и фагоцитируются селезеночными макрофагоцитами. Когда объем эритроцита достигает критического (146 % первоначального), а размер пор мембраны превышает 6 нм, наступает гемолиз с выходом гемоглобина в плазму.
Гемолиз эритроцитов при приобретенных гемолитических анемиях происходит преимущественно в кровеносном русле. Однако при резус-конфликте (гемолитическая болезнь новорожденных) антирезусные агглютинины, образовавшиеся в организме резус-отрицательной матери, вызывают гемолиз резус-положительных эритроцитов плода или новорожденного не только внутри сосудов, но и в печени и селезенке (внутриклеточный гемолиз).
При наследственной гемолитической анемиигемолиз обусловлен снижением осмотической и механической резистентности эритроцитов с генетически детерминированными нарушениями структуры мембраны, метаболизма, синтеза гемоглобина.
Так, при наследственной мембранопатии(микросфероцитарная гемолитическая анемия или болезнь Минковского—Шоффара с аутосомно-доминантным наследованием) генетический дефицит в мембране – эритроцитов Са2+-зависимой АТФазы и фосфолипидов приводит к повышению проницаемости мембраны. В клетки поступают ионы натрия и вода, эритроциты превращаются в сфероциты с резко пониженной способностью деформироваться при прохождении через синусы селезенки. Отрыв части оболочки у таких эритроцитов ведет к образованию микросфероцитов с укороченной продолжительностью жизни (8—14 дней вместо 120 дней в норме) в связи с захватом их макрофагоцитами селезенки и печени (внутриклеточный гемолиз).
При наследственной ферментопатии, например глюкозо-6-фосфатдегидрогеназодефицитной анемии (доминантное, сцепленное с X-хромосомой наследование), острый внутрисосудистый гемолиз эритроцитов, возникающий при приеме лекарств с высокой окислительной способностью (противомалярийные препараты, фтивазиди др.), обусловлен повреждением клеточных мембран перекисями, так как в эритроцитах с дефицитом Г-6-ФДГ понижено содержание восстановленного глутатиона (антиоксиданта).
Внутриклеточный гемолиз эритроцитов при наследственной гемоглобинопатии связан с синтезом аномального или не свойственного данному возрасту гемоглобина1. Так, при серповидноклеточной анемии2 образуется HbS (в β-цепи глобина глутаминовая кислота заменена валином), который в восстановленном состоянии выпадает в кристаллы и вызывает деформацию эритроцитов (серповидная форма); гипоксия способствует усилению гемолиза таких эритроцитов. При α-талассемии (генетический дефект синтеза α-цепей) происходит гемолиз эритроцитов с аномальным гемоглобином — Bart—НЬ(γ4) у новорожденных и НЬН(β4) у взрослых людей; при β-талассемии, когда нарушен синтез β-цепей и не образуется НЬА,(α2β2), гемолизируются эритроциты, содержащие фетальный гемоглобин (α2γ2) или же НbА2(α2δ2).
Следствием массивного гемолиза эритроцитов является анемия с нарушением дыхательной функции крови и развитием гипоксии. Образовавшийся при распаде эритроцитов гемоглобин циркулирует в крови (гемоглобинемия) и соединяется с гаптоглобином в крупномолекулярный комплекс, не проходящий через почечный фильтр. Если же содержание свободного гемоглобина в плазме превышает 20,9 ммоль/л (337 г/л) или исходный уровень гаптоглобина низкий, тогда не связанный с последним гемоглобин начинает выделяться с мочой (гемоглобинурия). Частично гемоглобин поглощается клетками макрофагоцитарной системы и расщепляется в них до гемосидерина. Гемосидероз селезенки, почек, печени, костного мозга сопровождается реактивным разрастанием соединительной ткани и нарушением функций этих органов. Повышенное образование из гемоглобина желчных пигментов обусловливает развитие гемолитической желтухи (см. раздел XXII — “Патологическая физиология печени”). Кроме того, внутрисосудистый распад эритроцитов может привести к появлению тромбов и нарушению кровоснабжения тканей, отсюда — трофические язвы конечностей, дистрофические изменения в селезенке, печени, почках. В результате поступления в сосудистое русло большого количества эритроцитарного тромбопластина возможно развитие ДВС-синдрома.
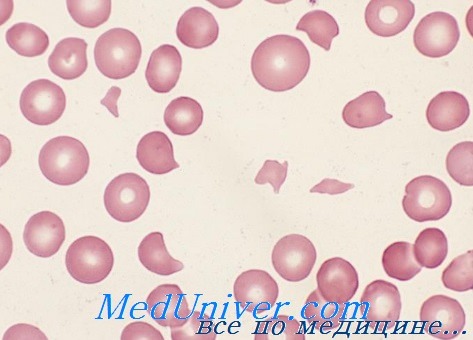
Картина крови. Приобретенная гемолитическая анемия по типу кроветворения является эритробластической, по степени регенерации костного мозга — регенераторной, по цветовому показателю — нормо-или гипохромной, реже — ложногиперхромной (вследствие абсорбции гемоглобина на эритроцитах). Степень уменьшения количества эритроцитов и гемоглобина зависит от интенсивности гемолиза. В мазке крови обнаруживаются клетки физиологической регенерации и дегенеративно измененные эритроциты (пойкилоцитоз; разорванные, фрагментированные эритроциты, анизоцитоз). Появление большого количества эритробластов и нормобластов характерно для гемолитической болезни новорожденных.
При наследственной гемолитической анемии отмечается усиленная регенерация эритроцитарного ростка часто с неэффективным эритропоэзом, когда в костном мозге разрушаются ядерные формы эритроцитов. В мазке крови наряду с регенеративными формами (высокий ретикулоцитоз, полихроматофилия, единичные ядерные формы эритроцитов) находятся дегенеративно измененные клетки (микросфероциты при болезни Минковского — Шоффара, серповидные при S-гемоглобинопатии, мишеневидные, базофильно пунктированные — при талассемии). При частых гемолитических кризах может возникнуть гипорегенераторная анемия.
Причины гемолитических анемий – этиология, патогенезГемолитические анемии (ГА) составляют группу анемий периферической природы, обусловленные избыточным расплавлением эритроцитов. Общую причину всех видов гемолитических анемий (ГА) составляет сокращение длительности жизни эритроцитов до менее 100 дней, определение которой составляет наиболее точный способ диагностирования заболевания. При сокращении длительности жизни красных кровяных клеток развивается избыточное расплавление крови, в связи с чем в организме отмечается наличие продуктов катаболизма гема, что, однако, не всегда сопровождается анемией. Известно, что избыточное расплавление крови компенсируется регенеративной пролиферацией костного мозга, поскольку интенсивность этого гемолиза не превышает физиологический более чем в 4—5 раз. Это означает, что центральное избыточное производство эритробластов и выделение на периферию новых ретикулоцитов может оказаться в 5—6 раз больше их абсолютно нормального количества, т.е. примерно в размере 25 мл ежесуточно (12 х 109). Следовательно, компенсирующая регенерация достаточна для сохранения показателя гематокрита и периферического гемоглобина, естественно когда периферический распад укладывается в пределы 4—5 X 25 мл эритроцитов. Патологическое расплавление крови, превышающее эти значения остается не компенсированным, в связи с чем развивается гемолитическая анемия (ГА), которая определяется как регенеративная, вообще нормохромная и нормоцитная анемия. Однако при отдельных видах показатели формы, объема эритроцитов и концентрации гемоглобина колеблятся и характерны лишь для определенного этиопатогенеза. Диагностирование гемолитической анемии проводить сопоставлением морфологических изменений красных кровяных клеток в процессе расплавления крови, этиологических факторов и патогенетического механизма каждого вида ГА. В принципе механизмы патологического гемолиза и физиологического расплавления состарившихся красных кровяных клеток одинаковы.
Этиопатогенетические механизмы расплавления (гемолиза) крови при гемолитической анемииПри физиологических условиях продолжительность жизни красных кровяных клеток обусловлена определенными физическими и ферменто-метаболическими постоянными, которые определяют ее частную структуру безъядерной клетки с большой функциональной приспособляемостью. Отношения объем/площадь, толщина/диаметр и двувогнутая форма обусловливают определенные эластичность и пластичность, способствующими изменению формы тела клетки и ее приспособления в зависимости от потребностей циркуляции эритроцитов. Отношения объем/площадь и диаметр/толщина однозначны с показателями пластичности и фильтрации, количественное определение которых проводится по новым методам (Jandl, Teitel). Нормальная пластичность обеспечивает прохождение эритроцитов через поры сосудосинусоидных эндотелиев органов, с обильной ретикулоэндотелиальной тканью, таких как, печень, костный мозг и особенно селезенка. Несмотря на то, что диаметр пор колеблется от 0,5 до 2—3 микронов, гематии легко проходят через них благодаря способности изменять форму и передвигаться из одной стороны в другую с помощью амибоидных движений. Любое изменение отношений объем/площадь и диаметр/толщина сокращает пластичность гематий, которые становятся жесткими, более не изменяют форму в целях прохояодения через эндотелиальные поры. Красные кровяные клетки «секвестрируются » и «захвачиваются органами с большим содержанием РЭС и в конечном итоге пожираются ими. Этим путем развертывается внутриклеточное расплавление крови, процесс заложенный в основу ряда видов патологического гемолиза, обусловливаемого сдвигами физических постоянных, влияющих на пластичность. Нормальная морфологическая и физическая структуры в свою очередь обусловлены биохимической структурой оболочки и стромы эндоэритроцита. В соответствующих главах рассматривались зависимость биофизических параметров полупроницаемой, селективной в отношении Na и К клеточной оболочки, от ее биохимической структуры и энергии, снабжаемой АТФ за счет активности аденозинтрифосфатазы, в обратимой реакции АТФ—АДФ. Нарушение проходимости и сдвиги в еще недостаточно изученных (Weed) биохимических структурах определяют количественное изменение отношения объем/площадь при микросфероцитной гемолитической анемии — как вид ГА за счет генетических эндоэритроцитных изменений. Воздействие химических гемолитических веществ, таких как органические растворители и отдельные растительные или животные яды обусловливает развитие альтерационных изменений жировых структур оболочки или изменяет распределение холестерина на ее поверхности, в связи с чем меняется двувогнутая форма красных кровяных клеток (Murphy). Изо- или аутоиммунные тела, равно как и комплемент путем непосредственного действия на антигенные структуры мембраны или косвенного — когда действуют через иммунные комплексы — также вызывают изменение оболочки и нарушение селективной передачи ионов натрия и калия. Избыточное поступление воды, сопровождающее перенос ионов, ведет к набуханию красной кровяной клетки, изменению отношения объем/площадь, понижению пластичности, а в связи с этим и к жесткости гематии. После заключения в синусоидные органы и макрофагоцитоза они подвергаются процессу внутриклеточного расплавления. Но при значительных изменениях, набухание за счет избыточного поступления воды разъединяет связи гемоглобина со стромой. По этой причине гемоглобин образует внутриэритроцитную коллоидную взвесь и обусловливает важную фазу процесса расплавления крови, который, в дальнейшем развертывается во внутрисосудистом разделе. В зависимости от концентрации гемолитических средовых факторов и их физической или биологической природы расплавление крови протекает внутриклеточно — за счет понижения пластичности, или внутрисосудисто — за счет выхождения гемоглобина из клетки через очень пораженную оболочку. Это осуществляется либо врожденным нарушением оболочечных или эндоэритроцитных структур, либо воздействием токсических, для этих структур, гемолитических факторов. Механизм альтерационного изменения пластичности составляет основу большинства видов гемолитической анемии, определяемых структурными нарушениями внутри стромы, в том числе гемоглобина или набора ферментов, которые предоставляют жизненную энергию красной кровяной клетки. Гемоглобин сохраняет свои биохимическую структуру и физическое и функциональное свойства переносчика О2 и СО2, поскольку он находится в восстановленном состоянии. Последнее возможно при наличии энергии, вырабатываемой сгоранием глюкозы в условиях анаэробного пути Эмбдена-Мейергоффа и пентозного цикла сгорания рибозы. Энергия, поставляемая действием набора ферментов, в составе которого известны ведущие ферменты (гексокиназа, пируваткиназа, изомераза, Г-6-Ф-дегидрогеназа, глютатионредуктаза, глютатионсинтетаза, DPNH) сохраняет отборный перенос катионов и железа, также восстановленное состояние гемоглобина. Врожденное или приобретенное нарушение структуры гемоглобина или ферментометаболические расстройства составляют патогенетические причины, определяющие основные группы гемолитической анемии. Однако существует ряд токсических факторов, непосредственно окисляющих гемоглобин или действующих одновременно с ферментометаболическим набором, и тем самым сокращающих энергию, требуемую для эндогенного окислительно-восстановительного процесса и сохранения гемоглобина в норме. Врождено патологический гемоглобин разных видов (Н, S, С и пр.), неустойчив, оседает в виде аггрегатов или кристаллов и тем самым придает некоторую жесткость красным кровяным клеткам. В принципе врожденная недостаточность эндоэритроцитных ферментов вызывает окисление гемоглобина, его преобразование в метгемоглсбин, оседание последнего в виде телец Гейнца и нарушение пластичности гематип изменением их формы, объема и поверхности. Воздействие химических факторов, растительных, животных или бактериальных ядов на метаболические или ферментные структуры обусловливает и образование неустойчивого окисленного гемоглобина, который влияет на красную кровяную клетку, так же как при врожденной энзимопатии. В условиях механического расплавления за счет факторов системного кровообращения, ударяясь о слой фибрина — например при ВДС, о пластинку обызвествленного атерома на сосудах или склерозированных природных или протетических клапанах красные кровяные клетки деформируются, разрываются, площадь оболочки уменьшается, они становятся жесткими и подвергаются внутриклеточному или внутрисосудистому расплавлению. – Также рекомендуем “Классификация гемолитических анемий – этиологическая, патогенетическая” Оглавление темы “Гемолитические анемии”:
|
