Прогноз при анемии фанкони

Анемия Фанкони – это генетическое заболевание, которое передается по аутосомно-рецессивному типу и характеризуется нарушением кроветворения, формированием злокачественных новообразований, пороками развития, ломкостью хромосом. Проявляется частыми кровотечениями, кровоподтеками на коже, вялостью, бледностью, склонностью к инфекциям. Диагностика проводится лабораторными методами, назначаются цитогенетическое, молекулярно-генетическое и клиническое исследования крови, миелограмма. Основные способы лечения – пересадка костного мозга, медикаментозное поддержание кроветворения, переливание крови.
Общие сведения
Синонимичные названия анемии Фанкони – врожденная панмиелопатия Фанкони, наследственная панмиелопатия. Заболевание названо по фамилии швейцарского педиатра Гвидо Фанкони, который в 1927 году описал врожденную апластическую патологию на основе симптомов у трех братьев. Анемия Фанкони является редкой генетической болезнью, наследуется согласно аутосомно-рецессивному принципу. Эпидемиологические показатели низкие – 1 больной ребенок на 350 тысяч новорожденных. Распространенность одинакова среди представителей женского и мужского пола, выше в сообществах с разрешенными близкородственными браками, например, у некоторых южноафриканских народов.
Анемия Фанкони
Причины
Заболевание является наследственным, развивается при передаче дефектного гена от родителей к ребенку. Выявлено 15 генов, мутации которых проявляются анемией Фанкони. Из них 14 расположены в аутосомах и являются рецессивными, 1 тип гена находится в X-хромосоме (сцепленной с полом). Все эти гены отвечают за производство определенного фермента, участвующего в репарации ДНК.
Аутосомно-рецессивное наследование подразумевает, что и отец, и мать должны быть носителями патологической генетической информации. При этом сами они, как правило, здоровы. Вероятность рождения больного ребенка в такой паре составляет 25%. Генетическая панмиелопатия диагностируется у детей и взрослых, получивших от каждого из родителей один и тот же измененный ген. В крайне редких случаях анемия провоцируется передачей дефектной Х-сцепленной хромосомы. Женщины могут быть носительницами мутации, заболевание проявляется только у мальчиков. Риск развития патологии у сына при наличии у матери мутированного гена – 50%.
Патогенез
В норме в клетках организма существуют специальные ферментные системы, которые исправляют разрывы молекул ДНК, поврежденных в процессе биосинтеза или воздействия химических, физических реагентов. При анемии Фанкони обнаруживается генетический дефект в кластере белков, ответственных за репарацию ДНК, что приводит к повышенной ломкости хромосом. В итоге у пациентов развиваются нарушения функций костного мозга – неоплазии и апластическая анемия. Онкологические заболевания чаще всего представлены острым миелоидным лейкозом – злокачественной опухолью миелоидного ростка крови, провоцирующей накопление измененных белых клеток, подавляющих рост эритроцитов, тромбоцитов и нормальных лейкоцитов. При апластической анемии в результате дисплазии костного мозга резко угнетается рост и созревание всех трех видов клеток крови.
Симптомы анемии Фанкони
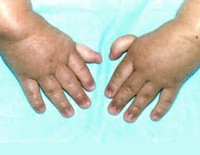
Более чем у половины пациентов наблюдаются врожденные аномалии развития внутренних органов и скелета. Костные деформации проявляются специфическим внешним видом: больные низкорослые, с уменьшенным размером головы, отсутствием или заметным укорочением большого пальца на руках, недоразвитием лучевой кости, врожденным вывихом бедра и/или наличием шейного ребра, косолапостью, недоразвитым подбородком («птичьим лицом»). Характерна гиперпигментация кожи в виде светлых и коричневатых пятен.
Неврологические расстройства представлены косоглазием, недоразвитием одного или двух глаз, опущением верхнего века, глазным дрожанием, глухотой, умственной отсталостью. Больные зачастую имеют незрелые половые органы, у них отсутствует одно или оба яичка. К распространенным аномалиям строения органов относятся пороки мочевыделительной системы: удвоение мочеточников или лоханки, подковообразные почки, почечные кисты, смещенное наружное отверстие уретры (гипоспадия). Врожденные пороки сердца включают атрезию трехстворчатого клапана, дефект межпредсердной перегородки, митральный стеноз, дефект межжелудочковой перегородки. Пациенты страдают от почечной и сердечной недостаточности.
Ключевые симптомы связаны с постепенным нарастанием нарушений в работе костного мозга. Чаще они дебютируют в детском возрасте (в 5-10 лет). Из-за снижения количества тромбоцитов развивается повышенная кровоточивость: при ранениях кровь долго не сворачивается, легко возникают носовые кровотечения, выделения при менструациях обильны, на теле обнаруживается много «беспричинных» кровоподтеков. Уменьшение числа эритроцитов проявляется анемией с характерной слабостью, быстрой утомляемостью, головокружениями, обмороками, бледностью кожи, учащенным сердцебиением и одышкой. Недостаток лейкоцитов способствует ухудшению сопротивляемости инфекциям. Впоследствии формируется лейкоз, миелодиспластический синдром, онкологические болезни.
Осложнения
Наиболее распространенным осложнением считаются частые инфекционные заболевания. У пациентов развивается ОРВИ, ангина, ринит, бронхит, грипп, тиф, герпес. Рецидивирующий характер болезней и их тяжелое течение приводят к деструкции органов, сопровождаются риском сепсиса. Другим осложнением наследственной анемии являются злокачественные новообразования – лейкемия, эпителиальные опухоли органов шеи и головы, половых органов. Рак у таких больных тяжело поддается лечению из-за повышенной ломкости и сниженной репарации ДНК. Это явление ограничивает применение лучевой терапии, цитотоксических препаратов. Нарушение свертываемости становится причиной больших кровопотерь.
Диагностика
Обследование больных проводят онкологи, гематологи, педиатры, врачи-генетики. Диагностика начинается с анализа анамнестических данных и жалоб. Врач выясняет, имеется ли данное наследственное заболевание у близких родственников, уточняет время появления первых признаков болезни, ранние обращения к врачам. При осмотре оценивает общее состояние пациента, выявляет наличие аномалий развития, гиперпигментированных пятен, кровотечений, кровоподтеков. В большинстве случаев не составляет труда обнаружить типичные деформации костей, недоразвитие глаз. Для подтверждения диагноза и различения анемии Фанкони с приобретенной анапластической анемией проводится ряд лабораторных исследований:
- Клинический анализ крови. Характерны изменения клеточного состава крови. На ранних этапах нарушения кроветворения диагностируется тромбоцитопения и лейкопения, на более поздних – панцитопения (резкое снижение объема эритроцитов, лейкоцитов и тромбоцитов). Возможен умеренный гемолиз без гипербилирубинемии, но с ретикулоцитозом. Значение СОЭ увеличено до 60-80 мм/ч.
- Цитогенетическое исследование клеток. Выполняется проба с диэпоксибутаном, митомицином C, указывающая на частоту и спектр хромосомных аберраций. В пользу генетической анемии рассматриваются показатели ДЭБ-теста более 45%, пограничный уровень – 11-45% (процент клеток с хромосомными разрывами).
- Молекулярно-генетический анализ клеток. Исследуются гены, мутации в которых могут привести к развитию заболевания. В 60-70% случаев мутации обнаруживаются в паре генов FANCA, в 14% – в аллели FANCC, в 10% – в генах FANCG. Частота мутаций в других парах – 0,2-3%.
- Миелограмма. По данным исследования определяется увеличение количества плазматических клеток и макрофагов, фагоцитирующих жиры. Содержание недифференцированных клеток – в пределах нормы. Снижена концентрация клеток миелоцитарного ростка, увеличен показатель лимфоцитов.
Лечение анемии Фанкони
Основная терапия направлена на восстановление процесса кроветворения. Методы лечения подбираются индивидуально, зависят от тяжести заболевания, возраста пациента, наличия и выраженности врожденных аномалий. Дополнительно проводится лечение инфекций и онкопатологий, осуществляются реабилитационные мероприятия. Для устранения анемии используются следующие методы:
- ТКМ. Трансплантация костного мозга является наиболее эффективной в долгосрочной перспективе, но имеет противопоказания, нередко сопровождается развитием осложнений. Оптимальный возраст для проведения операции – до десяти лет. Донорами могут выступать здоровые сестра и братья, подходящие по критериям совместимости. Предварительная интенсивная терапия (кондиционирование) связана с риском токсического воздействия на органы. После трансплантации сохраняется высокая вероятность острого или хронического иммунного конфликта между клетками донора и реципиента.
- Медикаментозная стимуляция кроветворения. При невозможности проведения трансплантации пациентам показано консервативное лечение, временно улучшающее их состояние. Выработка кровяных клеток стимулируется андрогенами (мужскими половыми гормонами) и гематопоэтическими факторами роста – эритропоэтином, фактором стволовых клеток, интерлейкинами-1-12. Параллельно применяются иммунодепрессанты. Медикаментозная терапия способна на протяжении многих лет поддерживать высокое качество жизни больных, но ее эффективность постепенно снижается.
- Переливание компонентов крови. При выраженных побочных эффектах или противопоказаниях к этиотропной терапии (трансплантации, стимуляции кроветворения) назначаются процедуры гемотрансфузии. Переливаются отмытые эритроциты – донорские красные кровяные тельца, освобожденные от поверхностных белков. При кровотечениях и снижении уровня тромбоцитов пациентам вводится тромбоцитарная масса.
Прогноз и профилактика
Продолжительность жизни больных определяется степенью нарушения функции костного мозга. Иногда пациенты доживают до 40 лет без лечения, но нередко умирают в детстве от тяжелой анемии или онкологических заболеваний. Прогноз наиболее благоприятен при своевременном проведении аллогенной трансплантации костного мозга, после которой есть шанс полного восстановления нормального кроветворения и увеличения срока жизни. Поскольку заболевание генетическое, предотвратить его развитие невозможно. Профилактика сводится к медико-генетической консультации супружеских пар из групп риска, планирующих беременность, а также к проведению пренатальной диагностики патологии, в ходе которой из пуповинной вены плода производится забор крови и выполняется ДЭБ-тест. При его положительном результате рассматривается вопрос о прерывании беременности.
Анемия Фанкони – редкое заболевание, развитие которого обусловлено генетическим дефектом группы белков, отвечающих за репарацию (исправление разрывов и ошибок) молекул ДНК. Это приводит к повышенной ломкости хромосом, в результате чего у пациентов с возрастом развивается апластическая анемия и запускаются неопластические процессы.
Анемия Фанкони встречается с частотой 1 случая на 350 000 новорожденных. Более высокий показатель заболеваемости отмечается у жителей Южной Африки и евреев-ашкенази – 1 случай на 90 новорожденных.
Внимание! Фотография шокирующего содержания.
Для просмотра нажмите на ссылку.
Причины и факторы риска
В большинстве случаев для анемии Фанкони характерен аутосомно-рецессивный тип наследования. Это означает, что для развития патологии ребенок должен получить мутировавший ген и от матери, и от отца. В тех случаях, когда он получает только одну копию измененного гена, заболевание не разовьется, но ребенок будет носителем патологического гена и сможет в дальнейшем передать его своим потомкам. Если и отец, и мать являются носителями мутированного гена, вероятность рождения больного ребенка – 25%.
Существует форма анемии Фанкони с рецессивным Х-сцепленным типом наследования. Носители мутации в этом случае – женщины. Вероятность рождения у них сына с анемией Фанкони составляет 50%.
 Анемия Фанкони наследуется по аутосомно-рецессивному типу – ребенок должен получить мутированных ген от обоих родителей
Анемия Фанкони наследуется по аутосомно-рецессивному типу – ребенок должен получить мутированных ген от обоих родителей
Симптомы
Первые признаки нарушения кроветворения при анемии Фанкони начинают проявляться у детей после 6-7 лет. Но заподозрить данную патологию можно и ранее по внешнему облику пациентов, для которых характерны:
- низкорослость;
- микрофтальмия;
- микроцефалия;
- смуглая кожа;
- неправильно сформированные большие пальцы рук;
- наличие на кожных покровах и слизистых оболочках участков гипер- и гипопигментации.
Прогноз при анемии Фанкони серьезный. Большинство больных живут не более 40 лет.
Помимо этого, могут наблюдаться другие аномалии:
- умственная отсталость;
- глухота;
- глазное дрожание;
- косоглазие;
- птоз века;
- гипоспадия;
- отсутствие яичек, недоразвитие половых органов;
- врожденные пороки сердца;
- поликистоз или гипоплазия почек, подковообразные почки;
- удвоение мочеточников и (или) лоханок.
При анемии Фанкони постепенно нарушается кроветворная функция костного мозга. В первые годы жизни уровень клеток крови обычно соответствует нормальным возрастным показателям, но эритроциты отличаются значительными размерами (макроцитоз). В последующие годы у пациентов развивается панцитопения, то есть уровень всех линий клеток крови снижается.
Уменьшение количества тромбоцитов становится причиной появления кровоподтеков, частых носовых кровотечений. В результате снижения числа эритроцитов возникает анемия с такими характерными симптомами:
- бледность кожи;
- слабость;
- тахикардия;
- чувство нехватки воздуха, одышка.
Уменьшение количества нейтрофилов (нейтропения) приводит к низкой сопротивляемости организма инфекциям.
Трансплантация донорского костного мозга – единственная возможность добиться восстановления функции кроветворения при анемии Фанкони.
В дальнейшем нередко развиваются онкологические заболевания (в частности, лейкозы и миелодиспластический синдром).
Читайте также:
Польза и вред сдачи крови: 12 заблуждений о донорстве
8 продуктов, помогающих улучшить кровообращение
Целебная гречка: 8 свойств знакомого продукта
Диагностика
Предположить наличие анемии Фанкони можно на основании характерного внешнего вида пациента и изменений в клиническом анализе крови. Уточнить диагноз позволяет миелограмма (анализ клеточного состава костного мозга).
Для постановки окончательного диагноза необходимо цитогенетическое исследование клеток крови (тест с митомицином С или проба с диэпоксибутаном). В специализированных лабораториях может быть выполнен и молекулярно-генетический анализ, позволяющий выявить у пациента наличие конкретного генетического дефекта.
Лечение
Единственным методом, позволяющим добиться восстановления кроветворения при анемии Фанкони, является трансплантация донорского костного мозга. Желательно осуществить ее в первое десятилетие жизни ребенка, так как в старшем возрасте эффективность трансплантации значительно снижается. Наилучшие результаты наблюдаются в тех случаях, когда в качестве доноров костного мозга выступают близкие родственники больного, не имеющие данного заболевания.
При подготовке пациентов к пересадке костного мозга при анемии Фанкони нужно учитывать следующие особенности: они обладают повышенной чувствительностью к повреждающему воздействию химиотерапевтических препаратов и ионизирующего излучения, у них повышен риск развития хронических и острых реакций «трансплантат против хозяина».
 При анемии Фанкони показана пересадка костного мозга от донора
При анемии Фанкони показана пересадка костного мозга от донора
Если в силу каких-либо причин трансплантация костного мозга невозможна, проводят консервативную терапию, направленную на стимуляцию процессов гемопоэза. С этой целью назначают лекарственные препараты мужских половых гормонов (андрогенов) или факторов роста. Примерно в 50% случаев обеспечивается хороший ответ на гормональную терапию андрогенами, и в течение многих лет она позволяет поддерживать выработку клеток крови костным мозгом на должном уровне. Однако в дальнейшем ее эффективность снижается, увеличивается вероятность развития побочных эффектов.
В тяжелых случаях осуществляют переливание эритроцитарной, лейкоцитарной или тромбоцитарной массы.
Возможные осложнения и последствия
Наиболее частыми осложнениями анемии Фанкони являются:
- присоединение вторичной инфекции;
- повышенная кровоточивость;
- развитие лейкемии.
Прогноз
Прогноз при анемии Фанкони серьезный. Большинство больных живут не более 40 лет. Даже после удачно выполненной трансплантации костного мозга и восстановления функции кроветворения вероятность развития онкологических заболеваний остается очень высокой.
Если и отец, и мать являются носителями мутированного гена, вероятность рождения ребенка с анемией Фанкони – 25%.
Профилактика
Предотвратить развитие анемии Фанкони невозможно. Если в роду имеются случаи данного заболевания, беременной женщине рекомендуется пренатальная диагностика: из пуповинной вены плода берется кровь (кордоцентез), ставится проба с диэпоксибутаном. При положительном результате семейной паре предлагается провести прерывание беременности по медицинским показаниям.
Информация является обобщенной и предоставляется в ознакомительных целях. При первых признаках болезни обратитесь к врачу. Самолечение опасно для здоровья!
Анемия Фанкони (МКБ-10 D61.0) – редкое генетическое заболевание кроветворной системы, поражающее костный мозг человека. Этот орган отвечает за производство и созревание трех разных видов кровяных клеток: эритроцитов, лейкоцитов и тромбоцитов. При возникновении этого заболевания работа костного мозга существенно ухудшается, вплоть до его полного отказа, что приводит к значительному нарушению процесса кроветворения. Впервые вопросом, что такое анемия, которая имеет очень похожие проявления у членов одной семьи, задался педиатр Гвидо Фанкони, наблюдая нескольких братьев, имевших ярко выраженные признаки болезни. В начале XX века Фанкони описал новое заболевание, названное впоследствии его именем.
Причины возникновения и факторы риска

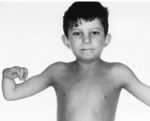
Внешний вил больного ребенка
Так как заболевание наследуется от родителей к детям, то основные причины, влияющие на его возникновение – дефекты определенных генов. У носителей аномальных хромосом может не быть никакой симптоматики.
Приблизительно 1 ребенок из 350 тыс. новорожденных будет болен анемией Фанкони (АФ), причем мальчики и девочки болеют одинаково часто.
Факторы риска существенно возрастают, если в родословной каждого из супругов были предки, с диагностированной патологией клеток крови. А также риск рождения малыша с АФ значительно выше у членов определенных этнических групп: испанских цыган, голландцев, евреев — ашкенази, народностей Кореи и Южной Африки.
Патогенез
Что же происходит в организме, если у человека анемия Фанкони? Сегодня науке известно 19 генов, ассоциированных с формированием АФ. Лишь один из них, называемый FANCB, находится на Х-хромосоме, все другие – на аутосомах. Каждый из этих генов связан с синтезом белка определённого вида, так или иначе участвующего в процессе восстановления ДНК.
Структура ДНК повреждается под воздействием множества внешних и внутренних факторов. При АФ дефектные стволовые клетки не в состоянии качественно исправлять повреждения ДНК, поломки которой накапливаются и могут приводить к недостаточности кроветворения, аномалиям развития, наблюдаемым у членов одной семьи, и предрасположенности к возникновению опухолей.
Вследствие дефективности таких генов у детей с АФ с рождения появляется излишняя хрупкость хромосом, угнетаются три ростка кроветворения в костном мозге, возрастает время созревания всех клеток крови, в 2–3 раза сокращается срок жизнедеятельности эритроцитов, в костном мозге разрастается жировая ткань.
Нарушения кроветворения множатся с течением времени. Организм испытывает недостаток кислорода, который переносится по кровяному руслу красными кровяными тельцами. Увеличивается дефицит энергии, проявляемый головокружениями, утомляемостью, головной болью, зябкостью. Нарастают симптомы апластической анемии, болезнь прогрессирует.
Как передается анемия Фанкони

Анемия Фанкони относится к семейным заболеваниям, передающимся из поколения в поколение. Тип наследования – аутосомно-рецессивный. Врожденная апластическая анемия может быть у ребенка, если у каждого из его родителей имеется генная мутация. Причем родители могут не страдать АФ, а всего лишь быть носителями болезни. Вероятность рождения малыша с патологией у такой пары – 25%.
Если же только у одного из родителей наблюдается анемия Фанкони, а второй здоров, то ребенок не заболеет, однако будет бессимптомным носителем и в будущем сможет передать копию измененного гена своим потомкам. Такую же ситуацию можно обнаружить в случае, если только один из родителей – носитель мутировавших генов, которые отвечают за развитие апластической анемии.
Еще реже встречаются случаи, когда заболевание рецессивным путем передается от матери к сыну. Это может произойти, если мать – носитель аномальной Х- хромосомы. Вероятность заболеть у таких мальчиков возрастает до 50%.
Симптомы и особенности течения болезни
Симптомы анемии Фанкони у новорожденных обнаруживаются крайне редко. АФ развивается постепенно. Первые признаки апластической анемии проявляются в раннем детском возрасте, но диагностируется она чаще у детей до 10 лет, из-за малой распространенности заболевания.
Подавляющее большинство больных, примерно две трети от общего количества, имеют один или несколько врожденных пороков развития. Многие из них можно увидеть на фото в сети Интернет:
- низкий рост;
- маленький размер головы, микроцефалия;
- патологии глаз и птоз;
- свисающие пальцы рук;
- вывих бедра;
- темная, гиперпигментированная кожа, полностью или частично;
- пороки сердца и почек;
- слепота и глухота;
- умственная отсталость и другие.
Эти дефекты способны сочетаться между собой. Так, если у одного ребенка в семье может присутствовать патология сердца или мозга, то у другого – костные аномалии и гиперпигментация кожи, а позже у обоих будет диагностирована анемия Фанкони.

Приблизительно одна треть пациентов, с клинически подтвержденным диагнозом анемии Фанкони не имеет вышеперечисленных врожденных дефектов. У них обнаруживаются только гематологические проявления болезни.
Чем старше становится ребенок, тем больше прогрессируют нарушения в системе кроветворения. Спустя какое-то время болезнь может проявиться такими симптомами.
- Множественные гематомы, большие и маленькие, возникающие даже от незначительного воздействия на кожу.
- Изменение окраски кожных покровов, необычная бледность.
- Сильная утомляемость, вялость, апатия.
- Выраженные изменения в общем анализе крови, называемые панцитопения – одновременное уменьшение количества белых, красных кровяных телец и тромбоцитов.
- Также могут возникнуть кровотечения, к примеру, носовые, которые невозможно остановить стандартными методами долгое время.
У пациентов с анемией Фанкони в подростковом и юном возрасте резко возрастает вероятность возникновения злокачественных новообразований органов дыхания, пищеварения, женской половой сферы, а также острого миелолейкоза
Если же заболевание по каким-либо причинам не проявлялось до полового созревания, то его дебют у взрослых, скорее всего, будет связан с симптомами, затрагивающими половую и репродуктивную сферу. У женщин это позднее наступление и нерегулярность менструального цикла, частые выкидыши, бесплодие, гипоплазия половых органов. У мужчин — недоразвитость гениталий.
К каким докторам обращаться при анемии Фанкони
Детей и взрослых, больных анемией Фанкони наблюдают и лечат педиатры, семейные врачи, гематологи и генетики. При необходимости, в зависимости от выраженности и тяжести симптомов, возможны консультации эндокринолога, ортопеда, офтальмолога, гинеколога, нефролога, онколога.
Лечение заболевания

Пациентов с АФ принимают в специализированных стационарах гематологического профиля. Схема лечения выстраивается индивидуально с учетом тяжести заболевания.
Самым современным и наиболее действенным методом лечения анемии Фанкони является донорская трансплантация гемопоэтических стволовых клеток, иначе называемая пересадкой костного мозга. Оптимально, если донором будет здоровый близкий родственник, обычно брат или сестра. На сегодня это самое радикальное средство, позволяющее существенно продлить жизнь.
Для этого костный мозг пациента, пораженный болезнью, разрушают с помощью специальных, высокотоксичных препаратов химиотерапии, полностью подавляют иммунитет. После этого в кровь вводят здоровые стволовые клетки, полученные из костного мозга, и реже, пуповинной или же периферической крови донора. Максимальный эффект от процедуры — полная приживаемость у реципиента донорского материала и нормализация состояния.
Однако, при всей очевидной прогрессивности и эффективности метода, при пересадке костного мозга часто возникают критически опасные для жизни осложнения, а именно:
- присоединение вторичных инфекций (вирусных, бактериальных, грибковых) из-за нулевого иммунитета, сепсис;
- кровотечения, связанные с дефицитом тромбоцитов;
- развитие тяжелых форм реакции «трансплантат против хозяина»;
- возникновение лейкемии.
Кроме того, на фоне иммуносупрессии, лучевой терапии и введения цитостатиков человек, больной апластической анемией нередко погибает, из-за повышенной хрупкости клеток.
При невозможности подобрать полностью или частично совместимого донора, для лечения анемии Фанкони может применяться консервативная терапия. С этой целью больным вводят мужские половые гормоны — андрогены, факторы роста, особые белки крови, иммунодепрессанты, кортикостероиды. В некоторых случаях помогает удаление селезенки с последующей терапией глобулинами.
У половины пациентов такое лечение дает стойкий положительный результат в первые месяцы его применения. При отмене приема лекарств заболевание начинает вновь прогрессировать.
При ярко выраженной панцитопении также активно применяются гемотрансфузии — переливания цельной крови или ее компонентов. Это временно улучшает состояние пациентов с АФ.
Прогноз и последствия
Анемия Фанкони — серьезное заболевание с неблагоприятным прогнозом. Полностью вылечиться нельзя, не существует лекарств, способных восстановить поврежденные гены. Но в результате проводимого лечения можно значительно улучшить качество жизни и увеличить ее продолжительность до 40 лет. Летальность существенно варьируется. У половины пациентов проводимая терапия не вызывает положительных изменений.
Недостаточность иммунитета на фоне нейтропении, количественного снижения лейкоцитов, дает зеленый свет инфекциям, от которых чаще всего и погибают пациенты. Также прогноз существенно ухудшается при появлении онкологических заболеваний или серьезных побочных эффектов от лечения.
