Прогноз при рефрактерной анемии

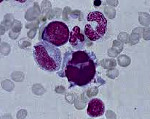
Миелодиспластический синдром – группа гематологических заболеваний, при которых наблюдаются цитопения, диспластические изменения костного мозга и высокий риск возникновения острого лейкоза. Характерные симптомы отсутствуют, выявляются признаки анемии, нейтропении и тромбоцитопении. Диагноз устанавливается с учетом данных лабораторных анализов: полного анализа периферической крови, гистологического и цитологического исследования биоптата и аспирата костного мозга и т. д. Дифференциальный диагноз может представлять значительные затруднения. Лечение – переливание компонентов крови, химиотерапия, иммуносупрессивная терапия, пересадка костного мозга.
Общие сведения
Миелодиспластический синдром – группа заболеваний и состояний с нарушениями миелоидного кроветворения и высоким риском развития острого лейкоза. Вероятность развития увеличивается с возрастом, в 80% случаев данный синдром диагностируется у людей старше 60 лет. Мужчины страдают несколько чаще женщин. У детей миелодиспластический синдром практически не встречается. В последние десятилетия гематологи отмечают увеличение заболеваемости среди лиц трудоспособного возраста. Предполагается, что причиной «омоложения» болезни могло стать существенное ухудшение экологической обстановки.
До недавнего времени лечение миелодиспластического синдрома было только симптоматическим. Сегодня специалисты разрабатывают новые методы терапии, однако эффективное лечение этой группы болезней все еще остается одной из самых сложных проблем современной гематологии. Пока прогноз при миелодиспластическом синдроме, в основном, зависит от особенностей течения болезни, наличия или отсутствия осложнений. Лечение осуществляют специалисты в сфере онкологии и гематологии.
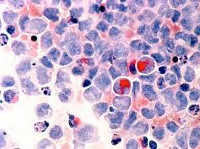
Миелодиспластический синдром
Причины и классификация миелодиспластического синдрома
С учетом причин развития различают два типа миелодиспластического синдрома: первичный (идиопатический) и вторичный. Идиопатический вариант выявляется в 80-90% случаев, диагностируется преимущественно у пациентов старше 60 лет. Причины возникновения установить не удается. В числе факторов риска первичного миелодиспластического синдрома – курение, повышенный уровень радиации при выполнении профессиональных обязанностей или проживании в неблагоприятной экологической зоне, частый контакт с бензином, пестицидами и органическими растворителям, некоторые наследственные и врожденные заболевания (нейрофиброматоз, анемия Фанкони, синдром Дауна).
Вторичный вариант миелодиспластического синдрома наблюдается в 10-20% случаев, может возникать в любом возрасте. Причиной развития становится химиотерапия или радиотерапия по поводу какого-то онкологического заболевания. В число лекарственных средств с доказанной способностью вызывать миелодиспластический синдром включают циклофосфан, подофиллотоксины, антрациклины (доксорубицин) и ингибиторы топоизомеразы (иринотекан, топотекан). Вторичный вариант отличается более высокой резистентностью к лечению, более высоким риском развития острого лейкоза и более неблагоприятным прогнозом.
В современной редакции классификации ВОЗ различают следующие типы миелодиспластического синдрома:
- Рефрактерная анемия. Сохраняется более полугода. В анализе крови бласты отсутствуют либо единичные. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная анемия с кольцевыми сидеробластами. Сохраняется более полугода. В анализе крови бласты отсутствуют. В костном мозге дисплазия эритроидного ростка.
- Рефрактерная цитопения с многолинейной дисплазией. В анализе крови тельца Ауэра отсутствуют, бласты отсутствуют либо единичные, выявляются панцитопения и увеличение количества моноцитов. В костном мозге диспластические изменения менее 10% клеток в 1 миелоидной клеточной линии, бластов менее 5%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-1. В анализе крови тельца Ауэра отсутствуют, бластов более 5%, цитопения и увеличение количества моноцитов. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 5-9%, телец Ауэра нет.
- Рефрактерная анемия с избытком бластов-2. В анализе крови увеличение количества моноцитов, цитопения, бластов 5-19%, могут выявляться тельца Ауэра. В костном мозге дисплазия одной либо нескольких клеточных линий, бластов 10-19%, обнаруживаются тельца Ауэра.
- Неклассифицируемый миелодиспластический синдром. В анализе крови цитопения, бласты отсутствуют либо единичные, тельца Ауэра отсутствуют. В костном мозге дисплазия одного мегакариоцитарного либо гранулоцитарного ростка, бластов более 5%, тельца Ауэра отсутствуют.
- Миелодиспластический синдром, ассоциированный с изолированной делецией 5q. В анализе крови анемия, бластов более 5%, возможен тромбоцитоз. В костном мозге более 5% бластов, тельца Ауэра отсутствуют, изолированная делеция 5q.
Симптомы миелодиспластического синдрома
Клиническая симптоматика определяется степенью нарушений миелопоэза. При мягко протекающих расстройствах возможно длительное бессимптомное или стертое течение. Из-за слабой выраженности клинических проявлений некоторые больные не обращаются к врачам, и миелодиспластический синдром обнаруживается во время проведения очередного медицинского осмотра. При преобладании анемии наблюдаются слабость, одышка, плохая переносимость физических нагрузок, бледность кожных покровов, головокружения и обморочные состояния.
При миелодиспластическом синдроме с тромбоцитопенией возникает повышенная кровоточивость, отмечаются десневые и носовые кровотечения, на коже появляются петехии. Возможны подкожные кровоизлияния и меноррагии. Миелодиспластический синдром с выраженными нейтропенией и агранулоцитозом проявляется частыми простудами, стоматитом, синуситом или стрептодермией. В тяжелых случаях возможно развитие пневмонии или сепсиса. Инфекционные заболевания нередко вызываются грибками, вирусами или условно-патогенными микробами. У каждого пятого пациента с миелодиспластическим синдромом выявляется увеличение лимфоузлов, селезенки и печени.
Диагностика миелодиспластического синдрома
Диагноз выставляется с учетом данных лабораторных исследований: анализа периферической крови, биопсии костного мозга с последующим цитологическим исследованием, цитохимических и цитогенетических тестов. В анализе периферической крови больных миелодиспластическим синдромом обычно обнаруживается панцитопения, реже выявляется дву- или одноростковая цитопения. У 90% пациентов наблюдается нормоцитарная либо макроцитарная анемия, у 60% – нейтропения и лейкопения. У большинства больных миелодиспластическим синдромом отмечается тромбоцитопения.
При исследовании костного мозга количество клеток обычно нормальное либо повышенное. Уже на ранних стадиях обнаруживаются признаки дизэритропоэза. Количество бластов зависит от формы миелодиспластического синдрома, может быть нормальным либо увеличенным. В последующем наблюдаются дисгранулоцитопоэз и дисмегакариоцитопоэз. У некоторых больных признаки дисплазии костного мозга выражены очень слабо. В процессе цитогенетического исследования у ¾ больных выявляются хромосомные нарушения. Дифференциальный диагноз миелодиспластического синдрома проводят с В12-дефицитной анемией, фолиево-дефицитной анемией, апластической анемией, острым миелолейкозом и другими острыми лейкозами.
Лечение и прогноз при миелодиспластическом синдроме
Тактика лечения определяется выраженностью клинической симптоматики и лабораторных изменений. При отсутствии явных признаков анемии, геморрагического синдрома и инфекционных осложнений осуществляется наблюдение. При миелодиспластическом синдроме с выраженной анемией, тромбоцитопенией и нейтропенией, а также при высоком риске возникновения острого лейкоза назначают сопроводительную терапию, химиотерапию и иммуносупрессивную терапию. При необходимости осуществляют пересадку костного мозга.
Сопроводительная терапия является самым распространенным методом лечения миелодиспластического синдрома. Предусматривает внутривенные инфузии компонентов крови. При длительном применении может провоцировать повышение уровня железа, влекущее за собой нарушения деятельности жизненно важных органов, поэтому переливания гемокомпонентов производят при одновременном приеме хелаторов (лекарственных средств, связывающих железо и способствующих его выведению).
Иммуносупрессоры эффективны при лечении миелодиспластического синдрома с отсутствием хромосомных аномалий, наличием гена HLA-DR15 и гипоклеточном костном мозге. Химиотерапию применяют при невозможности трансплантации костного мозга. Высокие дозы препаратов используют при трансформации миелодиспластического синдрома в острый лейкоз, а также при рефрактерных анемиях с избытком бластов при нормоклеточном и гиперклеточном костном мозге, низкие – при невозможности пересадки костного мозга. Наряду с перечисленными средствами пациентам назначают гипометилирующие средства (азацитидин). Наиболее надежным способом достижения полноценной длительной ремиссии является трансплантация костного мозга.
Прогноз зависит от типа миелодиспластического синдрома, количества хромосомных аномалий, необходимости в регулярных переливаниях компонентов крови, выраженности клинических проявлений и наличия осложнений. Различают 5 групп риска. Средняя выживаемость больных миелодиспластическим синдромом, входящих в группу с самым низким уровнем риска, составляет более 11 лет; с самым высоким – около 8 месяцев. Вероятность отторжения костного мозга после трансплантации – около 10%.
Заболевания крови составляют многочисленную и разнообразную группу синдромов, формирующихся при нарушениях качественного и количественного состава крови. Все они систематизируются, исходя из поражения какого-либо компонента крови. Гематологические заболевания делят на три основные группы:
- патологии, характеризующиеся снижением уровня гемоглобина;
- гемобластозы;
- гемостазиопатии.
Рефрактерная анемия – одна из разновидностей малокровия, отличающаяся нарушением созревания клеток красного ростка.
Миелодиспластический синдром – это что?
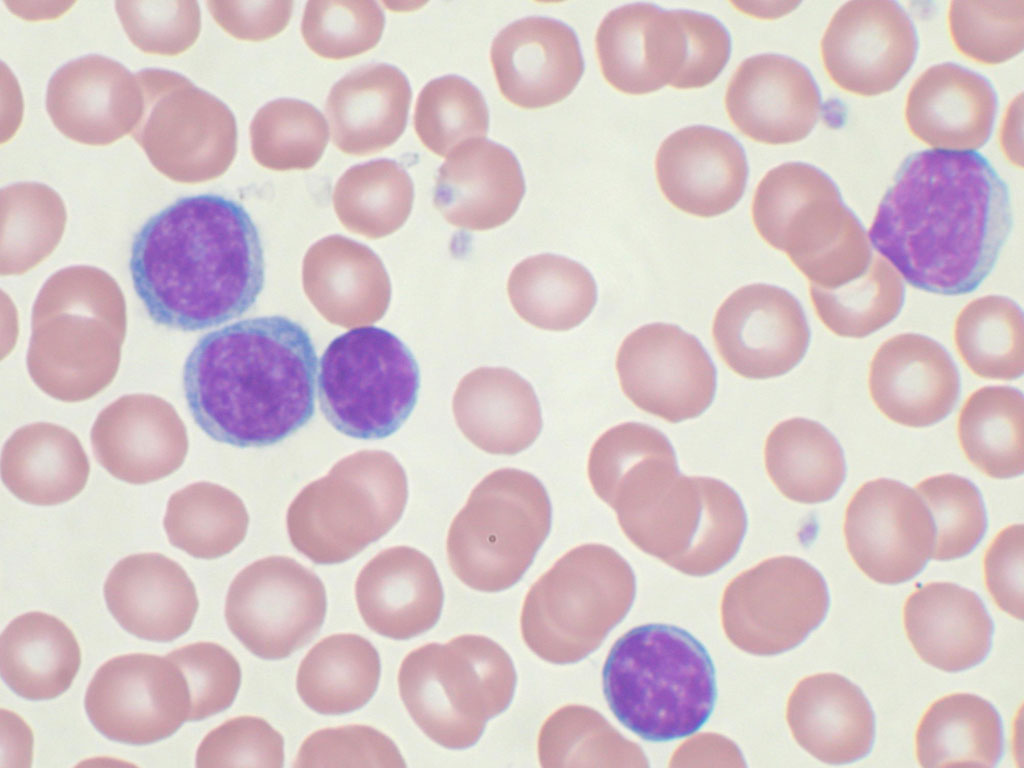
Группу заболеваний и состояний с нарушением процесса образования эритроцитов, моноцитов, тромбоцитов, гранулоцитов в миелоидной ткани (миелоидное кроветворение) с высокой вероятностью развития опухолевого поражения кроветворной системы в медицине именуют миелодиспластическим синдромом (МДС).
Клинические признаки в этом случае такие же как при анемии, состоянии, отличающимся снижением уровня нейтрофильных гранулоцитов в крови и тромбоцитопении. Заболевание чаще встречается у людей после 60 лет, причем мужчины подвержены ему больше, чем женщины. Однако в последнее время наблюдается «омоложение» болезни. Гематологи считают, что причина кроется в ухудшении экологической обстановки.
Одно из заболеваний группы миелодиспластического синдрома – рефракторная анемия. Данная патология, как и все остальные, объединенные МДС, относится к гематологическим заболеваниям, характеризующимися цитопенией (снижением уровня определенного вида клеток в крови) и патологическими изменениями костного мозга.
Классификация миелодиспластического синдрома
В международную классификацию болезней были внесены некоторые изменения, которые коснулись и гематологических заболеваний. Систематизация схожа с предложенной ранее ВОЗ, но отличается от FAB количеством вариантов определения заболеваний:
- D46.0 – рефрактерная анемия без сидеробластов.
- D46.1 – РА с кольцевыми сидеробластами. Незрелые кровяные клетки в крови не обнаруживаются.
- D46.2 – рефракторная анемия с избытком бластов 1. В анализе крови цитопения, превышение уровня моноцитов, тельца Ауэра отсутствуют.
- D46.3 – рефракторная анемия (РА) со множеством бластов с трансформацией.
- D46.4 – РА неуточненная.
- D46.5 – рефракторная цитопения со многолинейной дисплазией.
- D46.6 – миелодиспластический синдром, ассоциированный с делецией 5q.
- D46.7 – другие миелодиспластические синдромы.
- D46.9 – миелодиспластический синдром неуточненный.
Особенности рефрактерной анемии
Refractorius в переводе с латыни означает “невосприимчивый”, “трудноизлечимый”. Заболевание относится к гематологическим и характеризуется нарушением развития эритроцитного ростка в крови, продуцируемого костным мозгом. При синдроме рефрактерной анемии сначала снижается содержание эритроцитов в крови, а потом и остальных клеток, поражается орган кроветворной системы, отвечающий за гемопоэз.
Основная опасность патологии заключается в том, что она не поддается лечению, основанному на применении железосодержащих препаратов. Данный вид анемии часто протекает практически бессимптомно и выявляется при диагностике других патологий. Болезнь быстро прогрессирует и ведет к развитию острого лейкоза.
Рефракторная анемия с избытком бластов
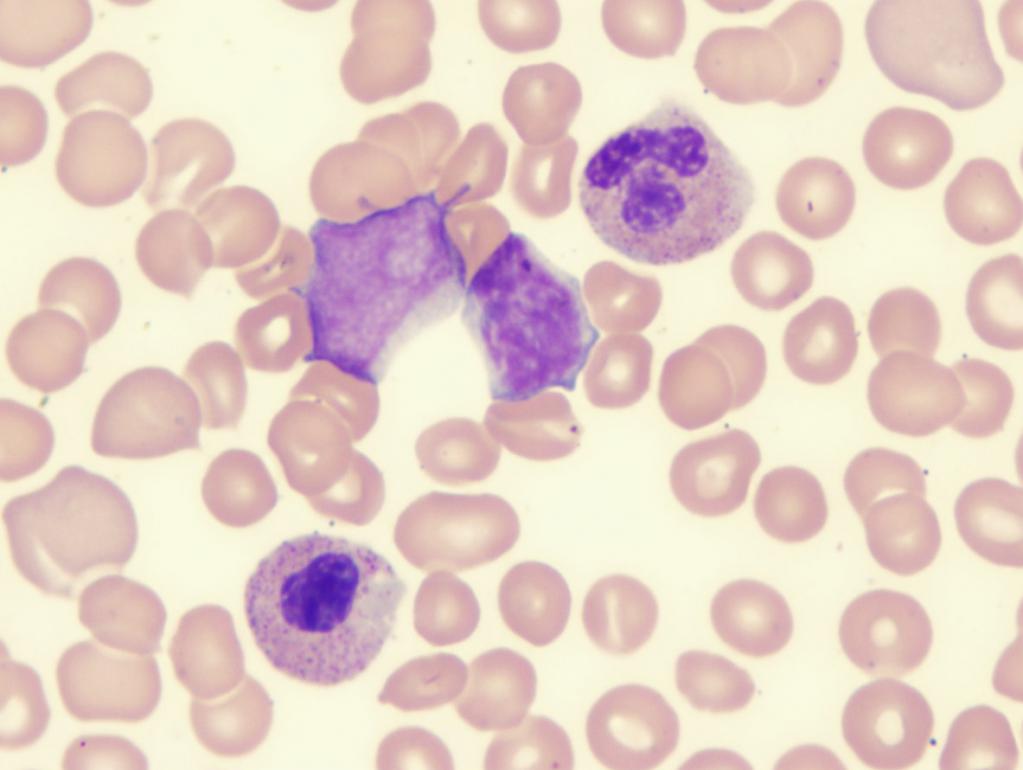
Исходя из статистических данных, людей с подобным диагнозом около 1 015 000. Заболевание чаще всего встречается у мужчин 75-80 лет, а у женщин в возрасте 73-79 лет. Патологию делят на два типа:
- РАИБ-1 – характеризуется цитопенией, увеличением числа моноцитов в крови. Палочковидные красные белковые включения в цитоплазме моноцитов (тельца Ауэра) не обнаруживаются. В костном мозге наблюдается дисплазия одной клеточной линии, бластов (незрелые кровяные клетки) около 5-19 %.
- РАИБ с трансформацией – анализ крови показывает повышенное содержание моноцитов, выявляются тельца Ауэра. Содержание бластов около 30 %. В костном мозге обнаруживаются дисплазии сразу нескольких клеточных линий. Подобная картина способствует развитию острого миелолейкоза.
Смертность от данной патологии составляет около 11 %.
Причины возникновения патологии
Точные причины развития заболевания до сих пор не выявлены. Разделяют два типа синдрома, и по каждому из них установлены факторы риска.
Первичный (идеопатический) выявляется в почти 90 % случаев. Факторы риска:
- Курение.
- Превышенный уровень радиации.
- Проживание в неблагоприятной экологической зоне.
- Регулярное вдыхание паров бензина, органических растворителей, пестицидов.
- Врожденный нейрофиброматоз Реклингхаузена (развитие опухолей из нервной ткани).
- Наследственная анемия Фанкони.
- Синдром Дауна.
Вторичный тип рефрактерной анемии (МДС) наблюдается в 20 % случаев, может развиваться в любом возрасте. Основные причины развития:
- Химиотерапия или радиотерапия.
- Долговременное применение некоторых групп лекарственных средств: циклофосфаты, антрациклины, ингибиторы топоизомеразы, подофиллотоксины.
Вторичный вариант отличается высокой резистентностью к терапии и большой вероятностью формирования острого лейкоза и, как следствие, неблагоприятным прогнозом.
По каким признакам определить заболевание?

Часто патология развивается без каких-либо симптомов, что мешает начать лечение на ранних этапах и в мягких формах. Как правило, диагностируется рефрактерная анемия в тяжелой степени при плановом обследовании пациента.
Но выявить заболевание на ранних этапах все же можно. Первые его признаки имеют много общего с проявлениями, возникающими при патологиях печени, аутоиммунных заболеваниях и любой другой анемии. К ним относятся:
- Бледность, прозрачность кожи, в особенности на лице.
- Чрезмерное утолщение рогового слоя эпидермиса на локтях и коленях.
- Образование гематом, которые долго проходят.
- Постоянные трещины на слизистой рта.
- Ломкость ногтей.
- Изменение обоняния и вкуса: пристрастие к резким запахам, желание есть землю, мел.
- Быстрая утомляемость.
- Частые ОРВИ с тяжелым течением.
При обнаружении подобных симптомов следует обратиться к врачу.
Клинические проявления тяжелой степени патологии

Клиническая картина анемии состоит из двух фаз: хроническая гемодепрессия и тяжелая (финальная) стадия.
При гемодепрессии наблюдаются следующие проявления:
- Значительное повышение температуры, лихорадка.
- Резкий упадок сил.
- Общее плохое самочувствие.
- Снижение веса.
- Увеличение внутренних органов: селезенки, печени.
- Увеличение и болезненность лимфатических узлов.
Подобные состояния затяжные, с периодами ремиссии.
Симптомы тяжелой степени рефрактерной анемии (миелодиспластический синдром) такие же, как при остром лейкозе. Болезнь развивается стремительно. Одной из ее особенностей является обнаружение бластов в анализе крови. Заболевание сопровождается следующими симптомами:
- Гематомы, даже при незначительных ушибах.
- Кровоточивость десен.
- Гингивит.
- Бинокулярное смещение глазного яблока.
- Упорные повторные воспалительные процессы в носоглотке.
- Нагноение царапин, небольших ран.
- Боли в области позвоночника.
У пациентов пожилого возраста возникают вторичные заболевания, чаще поражается сердечно-сосудистая система. Пациенты испытывают боли при ходьбе в нижних конечностях.
Диагностические мероприятия
При первых подозрительных симптомах необходимо обратиться к доктору. Диагноз “миелодиспластический синдром” или “рефрактерная анемия с избытком бластов” ставится только после прохождения ряда лабораторных исследований. Они включают:
- Клинический анализ периферической крови.
- Цитологические исследования аспирата костного мозга.
- Трепанобиопсия заключается во взятии биоматериала из костного мозга путем прокола большеберцовой кости.
- Цитогенетический тест. Анализ выявляет хромосомные нарушения, является обязательным.
В зависимости от клинической картины заболевания могут быть назначены дополнительные диагностические мероприятия:
- УЗИ брюшной полости.
- Эзофагогастродуоденоскопия желудочно-кишечного тракта.
- Анализ на специфические онкомаркеры.
Методы терапии
Выбор способа лечения рефрактерной анемии обусловлен выраженностью клинических проявлений и результатами лабораторных исследований. Схемы терапии довольно сложны и определяются врачом. Пациенты с небольшим количеством бластов находятся в группе низкого риска. Они получают заместительное и поддерживающее лечение и могут вести практически обычный образ жизни. Приблизительная схема лечения такова:
- В стационарных условиях осуществляется наблюдение. Основная задача: поддержка нормального уровня гемоглобина и недопущение развития анемического синдрома. Пациенту делают переливание эритроцитарной донорской массы.
- При тяжелой анемии назначают лекарственные препараты, способствующие восстановлению железосодержащего белка: «Эксиджад», «Десферол».
- Для предотвращения иммунной агрессии против костного мозга применяют «Леналидомид» с антимоноцитарным глобулином и «Циклоспорином».
- При выявлении инфекционных заболеваний назначают антибактериальные препараты в зависимости от возбудителя и его резистентности.
- При необходимости, проводят пересадку костного мозга.
Прогнозирование
Прогноз рефрактерной анемии (миелодиспластический синдром) зависит от клинической картины, ответной реакции организма на терапию, своевременности обращения за медицинской помощью. Исход заболевания обусловлен выраженностью дефицита определенных клеток, наличие и профиль хромосомных отклонений, количество бластов и их тенденцию к развитию в крови и костном мозге.
Профилактика

Ввиду того что сущность, обстоятельства и механизмы развития патологии до конца еще не исследованы, то и действенные профилактические методы назвать практически невозможно. Врачи советуют придерживаться следующих рекомендаций по сохранению здоровья:
- Правильно сбалансировано питаться.
- Включать в рацион продукты с высоким содержанием железа.
- Чаще совершать прогулки на свежем воздухе.
- Отказаться от вредных привычек, в частности курения.
- При работе с пестицидами или органическими растворителями применять средства защиты.
Рефракторная анемия – опасное гематологическое заболевание, переходящее в онкологию. Чтобы избежать тяжелых стадий заболевания и серьезных последствий, необходимо регулярно проводить плановый осмотр. При обнаружении патологии необходимо полностью пройти курс терапии, многим пациентам это помогло не только улучшить, но и продлить жизнь.
