Протезирование аортального клапана анемия
Статья посвящена проблеме приобретенной механической гемолитической анемии, вызванной дисфункцией имплантированных сердечных клапанов. Показано, что в современных условиях наиболее часто выраженные признаки гемолиза наблюдаются при дисфункции протеза, например, вследствие образования параклапанной фистулы. Представлены клинические случаи.
В настоящее время благодаря современным возможностям сердечно-сосудистой хирургии операция протезирования клапанов сердца стала повседневной в работе специализированных кардиохирургических центров. В мире живут десятки тысяч пациентов с имплантированными сердечными протезами. В условиях хирургической коррекции клапанов становится актуальной проблема послеоперационной анемии, которая может носить различный характер. Вероятность развития у такого рода больных приобретенной механической гемолитической анемии во многом определяет течение послеоперационного периода. Большое значение в достижении хороших отдаленных результатов приобретают квалифицированный контроль и лечение этих пациентов у врача поликлиники по месту жительства [1].
Данные о воздействии протезов на эритроциты и на возникновение гемолиза противоречивы. По данным некоторых исследователей, гемолиз бывает клинически невыраженным, в других работах имеются указания на значительные клинические проявления гемолиза [1–4]. Степень клинических проявлений гемолиза зависит как от состояния самих эритроцитов, так и от механических свойств протезов [5, 6]. Несомненно, играют роль не только обработка протеза и материал, из которого он сделан, но и гемодинамические условия: скорость кровотока в области протеза, образование завихрений.
В связи с улучшением методологии оперативных вмешательств, а также с модернизацией искусственных клапанов сердца (ИКС) сердечно-сосудистый риск при операциях на сердце в течение последних десятилетий существенно снизился во всех возрастных группах. В 1960–1970-е гг. после введения в практику протезирования клапанов сердца гемолитическая анемия развивалась у 5–15% прооперированных пациентов, особенно после имплантирования механических шаровых протезов [2, 5]. Использование протезов нового поколения снизило частоту гемолитической анемии до 1% [2, 6]. Современные искусственные клапаны сердца разработаны на основе клинических данных использования нескольких поколений протезов. Они изготовлены из новейших материалов и имеют уникальную конструкцию [7, 8]. Однако компенсированный гемолиз может возникнуть при любом типе протеза. Наиболее часто выраженные признаки гемолиза наблюдаются при нарушении функции протеза, например, вследствие образования параклапанной фистулы. Разрушение эритроцитов с развитием гемолиза связано с нарушением кровотока через дефектный протез и увеличением повреждения эритроцитов его створками [3, 7]. Клинически гемолиз может проявляться симптомами сердечной недостаточности и анемии. Наблюдаются бледность кожных покровов, желтуха, моча может приобретать коричневый или черный цвет. Содержание билирубина повышено, особенно непрямая фракция, могут быть ретикулоцитоз, повышение активности лактатдегидрогеназы (ЛДГ) и уровня свободного гемоглобина в плазме крови. Синдром механического гемолиза подтверждается обнаружением в мазке крови больного фрагментов (обломков) эритроцитов (Fragmentes Red Cell (FRC)) или шистоцитов (син. — шизоциты). Наблюдаются анизопойкилоцитоз (изменение формы и размеров эритроцитов), полихромазия (способность окрашиваться как основными, так и кислыми красителями). При длительно протекающем гемолизе развивается дефицит железа.
В отечественной и зарубежной литературе описано очень мало случаев макроангиопатической гемолитической анемии, связанной с механическим повреждением эритроцитов у пациентов с ИКС. Мы приводим собственные наблюдения о гемолизе, вызванном дисфункцией механического двустворчатого протеза МедИнж (ЗАО НПП «МедИнж», Россия).
Пациентка, 65 лет.
Диагноз: сочетанный приобретенный порок митрального, аортального и трикуспидального клапанов. Проведено протезирование аортального (МедИнж 23) и митрального (МедИнж 29) клапанов, аннулопластика трикуспидального клапана по Де Вега-2.
До оперативного вмешательства у пациентки показатели красной крови не выходили за пределы соответствующих референтных интервалов: эритроциты — 4,16×1012/л; гемоглобин — 124 г/л; гематокрит — 36%; средний объем эритроцитов — 86,6 фл; среднее содержание гемоглобина в эритроците — 29,8 пг; средняя концентрация гемоглобина в эритроците — 344 г/л; ширина распределения эритроцитов по объему — 13,7%. На 10-е сут после операции у нее наблюдалась нормохромная анемия: эритроциты — 2,74×1012/л; гемоглобин — 83,2 г/л; гематокрит — 23,7%; средний объем эритроцитов — 86,7 фл; среднее содержание гемоглобина в эритроците — 30,4 пг; средняя концентрация гемоглобина в эритроците — 351 г/л; ширина распределения эритроцитов по объему — 16,1%. Через 1 мес. признаки анемии сохранялись: эритроциты — 2,54×1012/л; гемоглобин — 80,2 г/л; гематокрит — 23%; средний объем эритроцитов — 82,3 фл; среднее содержание гемоглобина в эритроците — 27,4 пг; средняя концентрация гемоглобина в эритроците — 351 г/л; ширина распределения эритроцитов по объему — 17,1%. На фоне приема сульфата железа и аскорбиновой кислоты 200 мг/сут эффекта не наблюдалось.
Пациентку беспокоили одышка при минимальной физической нагрузке, в положении лежа, отеки, повышенная утомляемость. Через 6 мес. после операции в связи с сохранением жалоб, признаков анемии (гемоглобин — 70–80 г/л) находилась на лечении в терапевтическом отделении. У пациентки был повышен уровень непрямого билирубина (40,4 мкмоль/л), проба Кумбса отрицательная, отмечалось периодическое выделение мочи черного цвета. Эффекта от преднизолона не было. Была обследована у гематолога, диагностирована приобретенная гемолитическая анемия, обусловленная механическим повреждением эритроцитов протезированными клапанами сердца. Направлена в кардиохирургический стационар для решения вопроса о повторном оперативном вмешательстве.
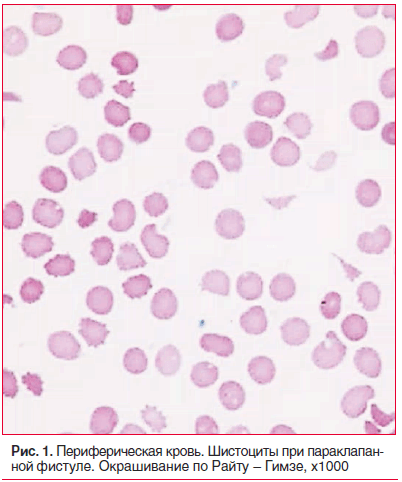
При поступлении в стационар состояние тяжелое. Кожные покровы бледные, желтушные. Живот увеличен за счет асцита. Пастозность стоп, лодыжек. Тоны сердца приглушены, аритмичные. Мелодия протеза четкая, систолический шум во всех точках. На эхокардиографии: в проекции аортального клапана протез без признаков дисфункции; в проекции митрального клапана диагностирована трансклапанная регургитация 1–2 степени, по задней части протеза — параклапанная фистула 2 степени. Показатели красной крови: эритроциты — 2,76×1012/л; гемоглобин — 90 г/л; гематокрит — 26,3%; средний объем эритроцитов — 95,6 фл; среднее содержание гемоглобина в эритроците — 32,2 пг; средняя концентрация гемоглобина в эритроците — 342 г/л; ширина распределения эритроцитов по объему — 24,3%, при микроскопии окрашенного мазка — полихромазия, шистоциты (2,0%) (рис. 1), ретикулоциты — 2,5%. Билирубин общий — 98,5 мкмоль/л, билирубин непрямой — 50,4 мкмоль/л, свободный гемоглобин — 0,6 г/л.
К сожалению, ввиду наличия у пациентки аортального протеза эндоваскулярное закрытие параклапанной фистулы митрального протеза было технически невыполнимо. В настоящее время пациентка наблюдается у кардиолога и гематолога по месту жительства. При снижении гемоглобина ниже 60 г/л ей проводятся трансфузии эритроцитосодержащих компонентов крови.
Пациентка, 60 лет. Диагноз: приобретенный порок митрального и трикуспидального клапанов. Проведены протезирование митрального (МедИнж 29) клапана, аннулопластика трикуспидального клапана по Де Вега.
Через 1 год после оперативного вмешательства у пациентки наблюдалось ухудшение состояния: одышка при минимальной физической нагрузке, отеки на ногах, последние 6 мес. — желтушность склер. В анализах, выполненных по месту жительства, — билирубин до 134 мкмоль/л. По данным чреспищеводной эхокардиографии в проекции митрального клапана — параклапанная фистула 1 степени.
Пациентка была госпитализирована в кардиохирургический стационар для устранения дефекта. При поступлении: билирубин — 110 мкмоль/л, непрямой билирубин — 22,7 мкмоль/л, свободный гемоглобин — 0,3 г/л. Наблюдалась гипохромная анемия: эритроциты — 4,6×1012/л; гемоглобин — 100 г/л; гематокрит — 36%; средний объем эритроцитов — 73,9 фл; среднее содержание гемоглобина в эритроците — 21,7 пг; средняя концентрация гемоглобина в эритроците — 291 г/л; ширина распределения эритроцитов по объему — 24,4%, шистоциты — 1,3%. Пациентке было проведено эндоваскулярное закрытие параклапанной фистулы окклюдером с положительной динамикой, с постепенным снижением уровня общего и непрямого билирубина, повышением уровня гемоглобина. При выписке гемоглобин — 128 г/л.
Таким образом, при подозрении на гемолиз у больных с ИКС всегда необходимо исключать механическую причину повреждения эритроцитов. Степень анемии в зависимости от степени и выраженности гемолиза может быть различной. Чаще всего анемия нормохромная, но при длительно протекающем гемолизе может носить гипохромный характер, с изменением морфологии красных клеток крови и присутствием шистоцитов либо только с присутствием шистоцитов как изолированным проявлением пойкилоцитоза. Рабочая группа Международного совета стандартизации в гематологии (МССГ (ICSH)) подготовила рекомендации для стандартизации, идентификации, подсчета и описания шистоцитов. Рекомендации определяют морфологическое описание шистоцитов, основанное на соответствующих критериях (в виде шлема; маленькие, неправильной треугольной формы, с наличием 2–3 углов; в форме полумесяца, с заостренными выступами, а также с отсутствием просветления в центре) [9–11]. В качестве полезного дополнения к микроскопу рекомендуется автоматизированный подсчет FRC. К сожалению, не все современные гематологические анализаторы демонстрируют сигналы тревоги («флаги»), сигнализирующие о наличии шистоцитов, а тем более проводят их подсчет. Да и специфичность автоматического метода очень низка (около 20%), требуется микроскопическое исследование для их подтверждения [9]. Поэтому общий анализ крови у пациентов с ИКС при подозрении на гемолиз необходимо дополнять микроскопией окрашенного мазка крови с описанием морфологии эритроцитов.
Выявленный шистоцитоз требует от врача-клинициста безотлагательных действий по установлению диагноза. При наличии клинической картины, лабораторных признаков гемолиза, нарастании в динамике процентного содержания шистоцитов диагноз механического разрушения эритроцитов становится очевидным. При подтверждении механической гемолитической анемии оправданным методом лечения является своевременное репротезирование клапанов сердца.
Источник
При патологии аортального клапана частота осложнения в виде инфекционного эндокардита выше, чем при патологии митрального клапана. Двустворчатый аортальный клапан – самый частый врожденный порок сердца (распространенность – 2%). При обнаружении данной аномалии в детском возрасте пациенты должны в течение всей жизни находиться под наблюдением кардиолога, а при появлении клинической симптоматики аортального стеноза – так же и кардиохирурга.
Этиология:
- Воспалительные поражения: ревматизм, системная склеродермия, аортоартериит.
- Дегенеративные процессы: миксоматозная дегенерация.
- Атеросклероз.
- Инфекционные процессы: инфекционный эндокардит.
- Врожденная патология: двустворчатый аортальный клапан.
Отмечается тенденция к увеличению частоты инволюционных (дегенеративно-атеросклеротических) причин аортального стеноза, что привело к увеличению возрастных пациентов старше 60-65 лет, нуждающихся в хирургической коррекции аортального порока.
При врожденном или ревматическом поражении клапана отмечается длительный латентный период без клинических проявлений. Летальность и риск осложнений существенно увеличиваются с появлением симптомов заболевания. При стенокардии, обмороках и проявлениях сердечной недостаточности, обусловленной систолической дисфункцией левого желудочка средняя продолжительность жизни 5, 3 и 2года соответственно. При бессимптомном течении риск внезапной смерти невелик (даже при тяжелом аортальном стенозе), тогда как при наличии симптомов 15 – 20% больных умирают внезапно.
Скорость прогрессирования поражения аортального клапана:
- легкий аортальный стеноз (площадь отверстия аортального клапана -1.2 – 2 см2) становится тяжелым, требующим протезирования аортального клапана, за 10 лет – у 10% больных, за 25 лет – у 38%;
- при умеренном бессимптомном аортальном стенозе (площадь отверстия аортального клапана – 0.75 – 1.2 см2) протезирование аортального клапана через 10 лет требуется в 25% случаев;
- бессимптомный тяжелый аортальный стеноз (площадь отверстия аортального клапана < 0,75 см2) обычно прогрессирует быстрее; у 30 – 40% больных в течение 2-х лет появляются симптомы и возникает потребность в протезировании аортального клапана.
Мерцательная аритмия, аортальная недостаточность (спонтанная или вызванная инфекционным эндокардитом), митральная недостаточность и острый инфаркт миокарда ускоряют декомпенсацию.
При неосложненном течении аортального стеноза характерная аускультативная картина: систолический шум в точке Боткина и на основании сердца справа, проводится на сосуды шеи, ослабление 2-го тона за счет аортального компонента. Интенсивность систолического шума может уменьшаться при развитии систолической дисфункции левого желудочка и не является критерием тяжести порока. Часто течение аортального стеноза осложняется патологией митрального клапана («митрализация»).
Диагностика аортального стеноза
- ЭКГ;
- Рентгенография грудной клетки;
- Коронароангиография – проводится при показаниях к хирургическому лечению или подозрении на коронарный атеросклероз;
- МСКТ восходящей аорты с контрастированием – показано при постстенотическом расширении корня аорты;
- ЭхоКГ. ЭХОКГ позволяет определить: структуру клапана (двустворчатый клапан, утолщение створок, фиброз, кальциноз, вегетации), характер его движения (подвижность створок, степень открытия) и площадь отверстия; изменения корня аорты (постстенотическая дилатация), объем левого желудочка, выраженность гипертрофии левого желудочка, нарушения локальной сократимости левого желудочка (указывающие на ИБС), ФВ, объем левого предсердия, состояние других клапанов. Доплеровское исследование позволяет с высокой точностью определить градиент давления между аортой и левым желудочком.
Эхокардиографические критерии тяжести аортального стеноза с учетом площади аортального клапана (в норме площадь составляет 3 – 4 см2):
- умеренный стеноз 1 – 1.4см2
- тяжелый стеноз < 1 см2
- критический стеноз < 0,75 см2
Средний систолический градиент между аортой и ЛЖ на уровне аортального клапана менее 50 мм рт. ст. – гемодинамически малозначимый аортальный стеноз, 50 – 80 мм рт.ст. – умеренный аортальный стеноз, более 80 мм рт.ст. – резкий аортальный стеноз.
Показания к хирургическому лечению (протезированию) аортального стеноза
(Американская Ассоциация сердца, Американская коллегия кардиологов)
Классификация рекомендаций и уровни достоверности в формате АКК/ААС:
- Класс I: Состояния, при которых есть доказательства и/или общее согласие, что процедура или метод лечения является благоприятным, полезным и эффективным.
- Класс II: Состояния, при которых есть противоречивые доказательства и/или расхождение во мнениях о полезности/эффективности процедуры или метода лечения.
- Класс IIА: Вес достоверность/мнение в пользу полезности/эффективности.
- Класс IIБ: Польза/эффективность менее хорошо установлены достоверностью/мнением.
- Класс III: Состояния, при которых есть доказательства и/или общее мнение, что процедура/метод лечения не полезны, не эффективны, а в некоторых случаях могут быть вредны.
Кроме того, уровни достоверности в поддержку рекомендаций изложены следующим образом:
- Уровень достоверности А: Данные получены из многочисленных рандомизированных клинических испытаний.
- Уровень достоверности В: Данные получены из единичных рандомизированных исследований или нерандомизированных испытаний.
- Уровень достоверности С: Только единодушное согласие экспертов, отдельные исследования случаев и стандарты лечения.
КЛАСС I
1. Протезирование аортального клапана показано симптомным пациентам с тяжелым аортальным стенозом (Уровень достоверности: B).
2. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции аорто-коронарного шунтирования (АКШ). (Уровень достоверности: С).
3. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом, при операции на аорте или других клапанах сердца. (Уровень достоверности: C).
4. Протезирование аортального клапана показано пациентам с тяжелым аортальным стенозом и систолической дисфункцией ЛЖ (ФВ менее 50%). (Уровень достоверности: C).
КЛАСС IIА
Протезирование аортального клапана показано пациентам с умеренным аортальным стенозом, при операции АКШ, операции на аорте или других клапанах сердца. (Уровень достоверности: B).
КЛАСС IIБ
1. Протезирование аортального клапана показано асимптомным пациентам с тяжелым аортальным стенозом и патологическим ответом на нагрузку (например, развитие симптомов гипотензии). (Уровень достоверности: C).
2. Протезирование аортального клапана показано возрастным пациентам с тяжелым асимптомным аортальным стенозом, если существует высокая вероятность быстрого прогрессирования (возраст, кальциноз). (Уровень достоверности: C).
3. Протезирование аортального клапана показано пациентам с легким аортальным стенозом, при операции АКШ, когда есть признаки умеренной – тяжелой кальцинации клапана, способной привести к быстрому прогрессированию. (Уровень достоверности: C).
4. Протезирование аортального клапана показано асимптомным пациентам с крайне тяжелым аортальным стенозом (площадь аортального клапана менее 0.6 cм2, средний градиент более 60 мм рт.ст. и скорость потока более 5.0 м/с), когда ожидаемая операционная летальность пациентов составляет менее 1.0%. (Уровень достоверности: C).
КЛАСС III
1. Протезирование аортального клапана не показано для предупреждения внезапной смерти у асимптомных пациентов с аортальным стенозом у кого нет ни одного показателя из списка рекомендаций Классов IIА/IIБ. (Уровень достоверности: B).
2. У возрастных пациентов с тяжелым, симптомным, кальцинированным аортальным стенозом протезирование аортального клапана является единственным эффективным методом лечения.
3. Молодые пациенты с врожденным или ревматическим аортальным стенозом могут быть кандидатами на вальвулотомию. Хотя нет единого мнения относительно оптимального срока проведения операции у асимптомных пациентов, для большинства пациентов можно разработать рациональные рекомендации.
Протезирование аортального клапана
За последние годы в хирургическом лечении клапанов сердца наблюдался значительный прогресс. Усовершенствование техники (в т.ч. аппаратов искусственного кровообращения), разработка единых стандартов и протоколов как предоперационного обследования, так и хода операции позволили снизить риски периоперационных осложнений, сделав саму операцию на клапанном аппарате сердца более безопасной, чем отказ от операции и попытка жить с дисфункцией клапана.
Виды хирургического лечения: операции по замене клапана сердца
Принципиально существует два вида операции на клапанах сердца: протезирование искусственным или биологическим протезом и пластика собственного клапана. Вполне естественно, что собственный клапан человека после удачной реконструкции функционирует лучше, чем искусственный протез. Но в случае невозможности сохранения собственного клапана единственный выход – замена его на протез.
Виды клапанов, используемых при протезировании
- Биологические клапаны. Могут быть выполнены из тканей животного или человека (гетеротрансплантаты, гомотрансплантаты, аутотрансплантаты). Биологические клапаны могут содержать некоторые искусственные компоненты для обеспечения поддержки клапана и его размещения. Основное преимущество такого клапана в отсутствии необходимости в пожизненной антикоагулянтной терапии (постоянном строгом приеме препаратов, значительно разжижающих кровь и требующем постоянной сдачи анализов крови), а основной минус – ограниченный срок службы (15 – 20 лет).
- Механические клапаны. Состоят целиком из механических элементов (титана и пиролитического углерода) и разработаны таким образом, чтобы заменять пациенту функции его собственного клапана. Механический клапан очень надёжен и долговечен, предназначен для многолетней полноценной работы, что является основным преимуществом, однако требует от пациента постоянного приема антикоагулянтов.
При протезировании аортального клапана доступ к клапану осуществляется посредством рассечения аорты в восходящем отделе (поперечная аортотомия). После иссечения створок аортального клапана и тщательной декальцинации фиброзного кольца последнее прошивается П-образными швами. С целью предотвращения прорезывания фиброзного кольца швы укрепляют тефлоновыми прокладками. Для выбора размера имплантируемого протеза диаметр фиброзного кольца измеряют специальными калибраторами. Выбранный протез имплантируют в аортальную позицию путем прошивания его оплетки. После фиксации протеза оценивают подвижность запирательных элементов механического протеза или коаптацию створок биологического клапана. При отсутствии ограничений их подвижности рассеченную аорту герметизируют двумя рядами швов.
Источник
