Распад и синтез гемоглобина в тканях
Тема 3 (вопрос 4 и 5).
Гем состоит из иона двухвалентного железа и порфирина. В основе структуры порфиринов находится порфин. Порфин представляет собой четыре пиррольных кольца, связанных между собой метеновыми мостиками. С наибольшей скоростью гем синтезируется в костном мозге (для синтеза гемоглобина ретикулоцитами) и в печени (для образования цитохрома Р-450).
Синтез гема происходит в несколько стадий:
1. На первой стадии в митохондриях сукцинил-КоА взаимодействует с глицином с образованием δ-аминолевулиновой кислоты. Эту реакцию катализирует специфический пиридоксальзависимый фермент δ-аминолевулинатсинтаза. Фермент активируется стероидами и ингибируется по типу обратной связи конечным продуктом – гемом. Продукт реакции из матрикса митохондрий переходит в цитозоль.
2. На второй стадии, в цитозоле, происходит конденсация 2-х молекул
δ-аминолевулиновой кислоты с образованием порфобилиногена. Фермент – порфобилиногенсинтаза – ингибируется конечным продуктом.
3. Из 4-х молекул порфобилиногена синтезируется протопорфирин IX, являющийся предшественником гема.
4. Протопорфирин IX присоединяет молекулу Fe при участии феррохелатазы (гемсинтаза) и образуется гем. Источником железа в этой реакции является белок ферритин, который депонирует железо.
Механизм регуляции синтеза тема в неэритроидных клетках имеет определенные отличия. Так, в клетках печени, где синтез гема происходит на высоком уровне, гем является отрицательным регулятором синтеза δ-аминолевулинатсинтазы по механизму репрессии-депрессии в процессе транскрипции. Главный регуляторный эффект гема состоит в том, что синтез фермента значительно ускоряется в отсутствии гема и замедляется в его присутствии.
Синтез белковой части гемоглобина происходит на рибосомах. Цепи α и β глобина синтезируются на полисомах, образованных, как правило, пятью рибосомами. Цепь α освобождается первой, присоединяется к β-цепи, еще связанной с рибосомой и отделяет ее, образуя димер αβ. Два димера соединяются в молекулу гемоглобина α2β2.
Соединение гема с глобином может происходить или в процессе синтеза полипептидных цепей, или после окончания синтеза глобина. Синтез полипептидных цепей происходит только в присутствии гема. При низкой концентрации гема синтез глобина замедляется. Отсюда следует, что синтез гема и глобина происходит координировано и ни один из этих компонентов не образуется в избыточном или недостаточном количестве.
Катаболизм гемоглобина
Эритроциты имеют короткое время жизни (примерно 120 дней). При физиологических условиях в организме взрослого человека разрушается около 1 – 2×1011 эритроцитов в сутки. Их катаболизм происходит, главным образом, в ретикулоэндотелиальных клетках селезёнки (РЭС), лимфатических узлов, костного мозга и печени. При распаде гемоглобина образуется билирубин. Билирубин является основным желчным пигментом у человека. При распаде 1 г гемоглобина образуется 35 мг билирубина, а в сутки у взрослого человека – примерно 250-350 мг. Дальнейший метаболизм билирубина происходит в печени.
Билирубин, образованный в клетках РЭС селезёнки и костного мозга, называется свободным (неконьюгированным)или непрямым, поскольку вследствие плохой растворимости в воде он легко адсорбируется на белках плазмы крови (альбуминах) и для его определения в крови необходимо предварительное осаждение белков спиртом. После этого билирубин определяют реакцией с диазореактивом Эрлиха. Свободный (непрямой) билирубин не проходит через почечный барьер и в мочу не попадает.
Каждая молекула альбумина связывает 2 (или 3) молекулы билирубина. При низком содержании альбумина в крови, а также при вытеснении билирубина из центров связывания на поверхности альбумина высокими концентрациями жирных кислот, лекарственных веществ (например, сульфаниламиды) увеличивается количество билирубина, не связанного с альбуминами. Он может проникать в клетки мозга и повреждать их.
Комплекс альбумин-билирубин с током крови попадает в печень, где происходит его превращение в прямой билирубин путем коньюгации с глюкуроновой кислотой. Реакцию катализирует УДФ-глюкуронилтрансфераза. Образующийся билирубиндиглюкуронид получил название прямого(коньюгированного) билирубина или связанного. Он растворим в воде и дает прямую реакцию с диазореактивом Эрлиха.
Прямой билирубин – это нормальный компонент желчи, попадающий в кровь в незначительном количестве. Он может проходить через почечный барьер, но в крови в норме его мало, поэтому в моче обычными лабораторными методами он не определяется.
Вместе с желчью прямой билирубин выводится в тонкий кишечник. В кишечнике билирубинглюкурониды гидролизуются специфическими бактериальными ферментами β-глюкуронидазами. Освободившийся билирубин под действием кишечной микрофлоры восстанавливается с образованием сначала мезобилирубина, а затем мезобилиногена(уробилиногена). Небольшая часть уробилиногенов, всасываясь в тонком кишечнике и верхнем отделе толстого, через систему воротной вены попадает в печень, где практически полностью разрушается до дипиррольных соединений. Уробилиноген при этом в общий кровоток не поступает и в моче не определяется.
Основная часть уробилиногена поступает в толстый кишечник, где под влиянием микрофлоры подвергается дальнейшему восстановлению с образованием стеркобилиногена. Образовавшийся стеркобилиноген почти полностью выделяется с калом. На воздухе он окисляется и превращается в стеркобилин, являющийся одним из пигментов кала. Небольшая часть стеркобилиногена попадает путем всасывания через слизистую толстого кишечника в систему нижней полой вены (через геморроидальные вены), доставляется в почки и выводится с мочой (4 мг/сутки).
Источник
Ответ: Гемоглобин, как и другие хромопротеиды(хлорофиллпротеиды, миогло-бин и др.), попав с пищей в пищеварительный канал, гидролизуется пищевари-тельными ферментами, распадаясь на белок и простетическую группу(гем). Глобиновая часть подвергается обычным превращениям, которые свойственны простым белкам. Простетическая же группа гемоглобина – гем – окисляется в гематин. Гематин, так же как и хлорофилл,всасывается в кишечнике очень плохо и поэтому выделяется, в основном, с калом. Таким образом, простетиче-ская группа хромопротеидов пищи не может быть использована для синтеза соответствующих сложных белков.
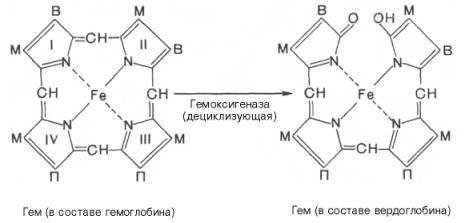
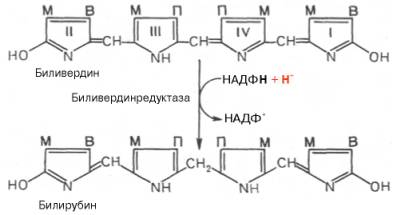
Иные превращения свойственны гемоглобину в тканях организма. В печени распад гемоглобина начинается с разрыва α-метиновой связи между 1 и 2 пиррольными кольцами порфиринового ядра. Реакция катализи-руется НАДФ-зависимой оксидазой и приводит к образованию вердоглобина (зеленого пигмента). В реакции участвуют в качестве кофакторов аскорбино-вая кислота, ионы двухвалентного железа и др.В дальнейшем происходит распад вердоглобина на глобин, биливердин и железо. Биливердин в основном в печени превращается при восстановлении в билирубин– главный желчный
пигмент у человека и плотоядных животных.Частично билирубин может об-разовываться также в селезенке и, по-видимому, в эритроцитах.
Образовавшийся свободный билирубин плохо растворим в воде и не дает прямой реакции с диазореактивом Эрлиха,так как легко адсорбируется на белках плазмы крови. Поэтому он получил название «непрямого билирубина».
Свободный билирубин (непрямой) является для организма токсическим веще-ством. Поступающий с током крови в печень и образовавшийся в печени сво-бодный («непрямой») билирубин подвергается обезвреживанию в печени пу-тем образования с глюкуроновой кислотой диглюкуронида билирубина(час-тично – моноглюкуронида). Он хорошо растворим в воде и дает прямую реак-цию с диазореактивом. Поэтому он получил название«прямой» билирубин. Глюкуроновая кислота вступает в реакцию с билирубином в виде уридинди-фосфатглюкуроновой кислоты в присутствии особого фермента глюкуронид-трансферазы.
Синтез гемоглобина характеризуется многостадийностью. Считается, что пиррольные кольца порфиринового ядра гема синтезируются в организме че-ловека и животных с использованием гликокола(глицина) и сукцинилкоэнзи-ма А при участии фермента, содержащего фосфопиридоксаль.
57. В тканях нуклеиновые кислоты распадаются до мононуклеотидов под влиянием тканевых нуклеаз – дезоксирибонуклеаз и рибонуклеаз, локали-зованных главным образом в митохондриях клеток.
Мононуклеотиды в тканях распадаются дальше до более простых соеди-нений. Первый этап состоит в отщеплении остатка фосфорной кислоты под влиянием тканевых фосфатаз (или нуклеотидаз).
Далее осуществляется перенос пентозы от нуклеозида на фосфорную ки-слоту. Реакция катализируется специфической для каждого нуклеозида рибо-зилтрансферазой (нуклеозидфосфорилазой).
Таким путем в результате распада нуклеозидов образуются пентозо-1-фосфат и все виды пуриновых и пиримидиновых оснований,участвующих в построении нуклеиновых кислот.
Надо сказать, что нуклеозиды могут расщепляться не только путем пере-носа пентозы от нуклеозида на фосфорную кислоту, но и гидролитическим пу-тем при участии ферментов нуклеозидаз:
Образующиеся пентозо-1-фосфат и пентоза включаются в реакции обме-на, характерные для углеводов.
Пуриновые основания претерпевают последующие из-менения и превращаются в те или иные простейшие азотсодержащие продук-ты, которые либо выводятся из организма, либо откладываются в нем. Первая фаза распада пуриновых оснований заключается в дезами-нировании под влиянием специфических аминогидролаз тех из них,которые имеют аминогруппу. В результате пуриновые основания – аденин превращает-ся в гипоксантин, а гуанин – в ксантин:
Гипоксантин и ксантин окисляются в мочевую кислоту. Ре-акция катализируется ксантиноксидазой, представляющей собой молибденсо-держащий флавопротеид.
Мочевая кислота является конечным продуктом распада пуриновых осно-ваний у человека и некоторых животных(чел В норме концентрация мочевой кислоты в цельной крови человека со-ставляет 0,18-0,24 ммоль/л, а в сыворотке крови 0,1-0,4 ммоль/л. При наруше-нии обмена пуриновых оснований(при подагре, заболеваниях почек, при за-болеваниях, сопровождающихся усиленным распадом нуклеопротеидов – лей-козах, диабете, аллергии и др.) содержание мочевой кислоты может значи-тельно увеличиваться (гиперурикемия).
58. Начальным этапом превращений нуклеопротеидов пищи в пищеваритель-ном канале следует считать отщепление нуклеиновой кислоты от белковой части нуклеопротеида. В желудке это происходит либо неферментативным пу-тем под действием кислоты желудочного сока(если разрываются солеобраз-ные связи между нуклеиновой кислотой и белком,имеющим щелочные свой-ства), либо под действием пепсина, либо, наконец, и под влиянием пепсина и под влиянием кислоты желудочного сока. В кишечнике расщепление нуклео-протеидов на белок и нуклеиновую кислоту происходит под влиянием соот-ветствующих протеолитических ферментов (трипсина и других).
Отщепившийся в желудочно-кишечном тракте белок подвергается обыч-ным для белка превращениям. Расщепление же нуклеиновых кислот происхо-дит далее под влиянием особых ферментов поджелудочной железы и тонкого кишечника – специфических нуклеаз и неспецифических фосфодиэстераз. Они ускоряют реакции разрыва межнуклеотидных связей в молекулах нуклеино-вых кислот. Нуклеазы, действующие на внутренние межнуклеотидные связи в молекулах РНК и ДНК, называются эндонуклеазами. При их участии осущест-вляется деполимеризация нуклеиновых кислот в основном до олигонуклеоти-дов. Нуклеазы, ускоряющие реакции последовательного отщепления нуклео-тидов от РНК и ДНК,начиная с конца полинуклеотидной цепи,называются экзонуклеазами. Эти ферменты обеспечивают распад нуклеиновых кислот до отдельных мононуклеотидов. При этом различают эндо- и экзорибонуклеазы и эндо- и экзо-дезоксирибонуклеазы. Первые ускоряют реакции распада внут-ренних и внешних(концевых) межнуклеотидных связей в молекулах РНК. Вторые выполняют ту же роль в молекулах ДНК.
Существует также группа неспецифических эндо-и экзонуклеаз, дейст-вующих одновременно на РНК и ДНК.
Большинство нуклеаз являются гидролазами, однако, часть из них при-надлежит к группе фосфотрансфераз (например, эндонуклеаза поджелудочной железы). В результате каталитического влияния разнообразных нуклеаз в по-лости пищеварительного тракта нуклеиновые кислоты распадаются на слож-ную смесь индивидуальных мононуклеотидов.
Образовавшиеся мононуклеотиды гидролизуются малоспецифическими и высокоспецифическими фосфатазами с образованием нуклеозидов и неорга-нического фосфата. В виде этих соединений(нуклеотидов и нуклеозидов) и происходит всасывание продуктов гидролиза нуклеиновых кислот.Всосав-шиеся нуклеотиды и нуклеозиды частично используются в организме для син-теза простетических групп нуклеопротеидов.
Пиримидиновые основания претерпевают последующие из-менения и превращаются в те или иные простейшие азотсодержащие продук-ты, которые либо выводятся из организма, либо откладываются в нем. Первая фаза распада пиримидиновых оснований заключается в дезами-нировании под влиянием специфических аминогидролаз тех из них,которые имеют аминогруппу.
В отличие от пуриновых оснований дезаминированные пиримидиновые основания подвергаются восстановлению. В частности, урацил переходит в
дигидроурацил. Донором атомов водорода служит НАД.Н.Далее дигидро-
урацил гидролизуется в N-карбамил-β-аланин, который гидролизуется в свою очередь до β-аланина и карбаминовой кислоты. Последняя либо используется для синтеза мочевины, либо распадается до углекислого газа и аммиака.Все эти реакции катализируются соответствующими ферментами:
59.Синтез ДНК (репликация) характеризуется рядом особенностей.
При биосинтезе ДНК первой характерной чертой специфического -био синтеза является то, что он протекает только при участии всех четырех видов дезоксирибонуклеозид-5’-трифосфатов (дАТФ, дГТФ, дЦТФ , дТТФ). Вторая особенность состоит в том, что биосинтез ДНК идет при каталитическом воз-действии комплекса ферментов: ДНК-репликазной системы или реплисемы, включающей более 20 т.н. репликативных ферментов и белковых факторов, в том числе ДНК-полимеразыI, II и III, РНК-полимеразы, ДНК-лигазы, ДНК-связывающего, ДНК-закручивающего и ДНК-раскручивающего белка и др. Наконец, третьей чертой биосинтеза ДНК является необходимость для его осуществления «затравки» в виде олигорибонуклеотида и ДНК-матрицы, что обеспечивает специфический биосинтез нуклеиновых кислот со строго задан-ной последовательностью нуклеотидных остатков в синтезируемой молекуле
по механизму комплементарности азотистых оснований дочерней ДНК и ДНК-матрицы. Общая схема биосинтеза ДНК может быть представлена,со-гласно Корнбергу, в следующем виде:
формула
Сталь и Меселсон установили, что в организме репликация ДНК осущест-вляется по полуконсервативному механизму, при котором цепи родительской ДНК расходятся и на каждой из них образуются комплементарные цепи до-черней ДНК. Механизм ферментативной реакции, происходящей при биосин-тезе ДНК, сводится к наращиванию полинуклеотидных фрагментов,закреп-ленных на одноцепочной ДНК-матрице, за счет переноса на их свободную гидроксильную группу при 3’-углеродном атоме пентозы нуклеозидмонофос-фатного остатка с дезоксирибонуклеозидтрифосфата, закрепленного в сосед-нем положении на матричной одноцепочной ДНК в соответствии с принципом комплементарности. Перенос идет в направлении5’ 3’ и сопровождается выделением пирофосфата, что обеспечивает синтез энергией.
Детали синтеза пока не ясны. Считается, что биосинтез ДНК начинается с раскручивания биспиральной цепи ДНК с образованием т.. нрепликативных вилок, двух репликативных вилок в фиксированной точке родительской ДНК под влиянием ДНК-раскручивающего белка у прокариот или сразу множества репликативных вилок у эукариот. Инициация синтеза дочерней ДНК предва-рительно требует синтеза на одной из одноцепочечных цепей(т.н. ведущей цепи) необычного затравочного олигорибонуклеотида (т.н. праймера – затрав-
| ки) со свободной ОН-группой | 3’у-углеродного | атома рибозы. С этой | |||
| ОН-группы праймера начинается затем истинный синтез дочерней ДНК по | |||||
| принципу | комплементарности | азотистых | оснований | под | влиянием |
ДНК-полимеразы III в направлении 5’ З’, обратному направлению исходной цепи ДНК. На второй цепи ДНК-матрицы(т.н. отстающей цепи) также идет синтез ДНК, но в виде фрагментов(т.н. фрагментов Оказаки) в направлении 5’ 3’. В последующем фрагменты ДНК объединяются при участии ДНК-лигаз в единую полинуклеотидную цепь. Праймер разрушается рибонуклеазой Н с последующей заменой на фрагмент ДНК с помощью ДНК-полимеразы I.
Источник
Продолжительность
жизни эритроцитов составляет 120 дней, затем они разрушаются и освобождается
гемоглобин. Главными органами, в которых происходят разрушение эритроцитов и
распад гемоглобина, являются печень, селезенка и костный мозг, хотя в принципе
оба процесса могут происходить и в клетках других органов. Распад гемоглобина в
печени начинается с разрыва α-метиновой связи между I и
II кольцами порфиринового кольца. Этот процесс катализируется НАДФ-содержащей
ок-сидазой и приводит к образованию зеленого пигмента вердоглобина
(холеглобина):

В приведенных
структурных формулах здесь и далее в желчных пигментах М – метильная СН3-группа,
В – (—СН=СН2) – винильная группа и П – (—СН2—СН2—СООН)
– остаток пропионовой кислоты.
Как видно из
приведенных формул, в молекуле вердоглобина еще сохраняются атом железа и
белковый компонент. Имеются экспериментальные доказательства, что в этом
окислительном превращении гемоглобина принимают участие витамин С, ионы Fe2+и другие кофакторы. Дальнейший распад вердоглобина, вероятнее всего, происходит
спонтанно с освобождением железа, белка-глобина и образованием одного из
желчных пигментов – биливердина. Спонтанный распад сопровождается
перераспределением двойных связей и атомов водорода в пиррольных кольцах и
метиновых мостиках. Образовавшийся биливердин ферментативным путем
восстанавливается в печени в билирубин, являющийся основным желчным пигментом у
человека и плотоядных животных:
Основное
место образования билирубина – печень, селезенка и, по-видимому, эритроциты
(при распаде их иногда разрывается одна из метиновых связей в протопорфирине).
Образовавшийся во всех этих клетках билирубин поступает в печень, откуда вместе
с желчью попадает в желчный пузырь (см. главу 16). Билирубин, образовавшийся в
клетках системы макрофагов, называется свободным, или непрямым, билирубином,
поскольку вследствие плохой растворимости в воде он легко адсорбируется на
белках плазмы крови и для его определения в крови необходимо предварительное
осаждение белков спиртом. После этого билирубин вступает во взаимодействие с
диазореактивом Эрлиха.
В крови
взрослого здорового человека содержится относительно постоянное количество общего билирубина – от 4 до 26 мкмоль/л, в среднем 15 мкмоль/л.
Около 75% этого количества приходится на долю непрямого билирубина. Повышение
его концентрации в крови до 35 мкмоль/л приводит к желтухе. Более высокий
уровень билирубина в крови вызывает явления тяжелого отравления. Непрямой
билирубин, поступая с током крови в печень, подвергается обезвреживанию путем
связывания с глюку-роновой кислотой. В этом процессе принимают участие особый
фермент УДФ-глюкуронилтрансфераза и УДФ-глюкуроновая кислота, являющаяся
донором глюкуроновой кислоты. При этом к билирубину присоединяются 2 остатка
глюкуроновой кислоты с образованием сравнительно индифферентного комплекса –
билирубин-диглюкуронида, хорошо растворимого в воде и дающего прямую реакцию с
диазореактивом. В желчи всегда присутствует прямой билирубин. В крови
количество прямого и непрямого билирубина, а также соотношение между ними резко
меняются при поражениях печени, селезенки, костного мозга, болезнях крови и
т.д., поэтому определение содержания обеих форм билирубина в крови имеет
существенное значение при дифференциальной диагностике различных форм желтухи.
При желчнокаменной болезни в составе желчных камней наряду с основным их
компонентом – холестерином всегда обнаруживается непрямой билирубин. Вследствие
плохой растворимости в воде он выпадает в осадок в желчном пузыре в виде
билирубината кальция, участвующего в формировании камней.
Дальнейшая
судьба желчных пигментов, точнее билирубина, связана с их превращениями в
кишечнике под действием бактерий. Сначала глю-куроновая кислота отщепляется от
комплекса с билирубином и освободившийся билирубин подвергается восстановлению
в стеркобилиноген, который выводится из кишечника. В сутки человек выделяет
около 300 мг стеркобилиногена. Последний легко окисляется под действием света и
воздуха в стеркобилин. Механизм бактериальных превращений билирубина до
стеркобилина до конца еще не расшифрован. Имеются данные, что промежуточными
продуктами восстановления являются последовательно мезобилирубин и
мезобилиноген (уробилиноген). После всасывания небольшая часть мезобилиногена
поступает через воротную вену в печень, где подвергается разрушению с образованием
моно- и дипиррольных соединений. Кроме того, очень небольшая часть
стеркобилиногена после всасывания через систему геморроидальных вен попадает в
большой круг кровообращения, минуя печень, и в таком виде выводится с мочой.
Однако называть его уробилиногеном не совсем точно (см. главу 18). Суточное
содержание стеркобилиногена в моче составляет около 4 мг, и, пожалуй, именно
стеркобилиноген является нормальной органической составной частью мочи. Если с
мочой выделяется повышенное содержание уробилиногена (точнее, мезобилиногена),
то это является свидетельством недостаточности функции печени, например, при
печеночной или гемолитической желтухе, когда печень частично теряет способность
извлекать этот пигмент из крови воротной вены. Химически уробилиноген
(мезо-билиноген) неидентичен стеркобилиногену (уробилиногену) мочи.
Исчезновение стеркобилиногена (уробилиногена) из мочи при наличии билирубина и
биливердина является свидетельством полного прекращения поступления желчи в
кишечник. Такое состояние часто наблюдается при закупорке протока желчного
пузыря (желчнокаменная болезнь) или общего желчного протока (желчнокаменная
болезнь, раковые поражения поджелудочной железы и др.).
Таким
образом, количественный и качественный анализ желчных пигментов в моче может
представлять большой клинический интерес.
Источник
