Разновидности гемоглобина их свойства
Оглавление темы “Функции клеток крови. Эритроциты. Нейтрофилы. Базофилы.”: Гемоглобин. Типы ( виды ) гемоглобина. Синтез гемоглобина. Функция гемоглобина. Строение гемоглобина.Гемоглобин — это гемопротеин, с молекулярной массой около 60 тыс., окрашивающий эритроцит в красный цвет после связывания молекулы O2 с ионом железа (Fe++). У мужчин в 1 л крови содержится 157 (140—175) г гемоглобина, у женщин — 138 (123—153) г. Молекула гемоглобина состоит из четырех субъединиц гема, связанных с белковой частью молекулы — глобином, сформированной из полипептидных цепей.
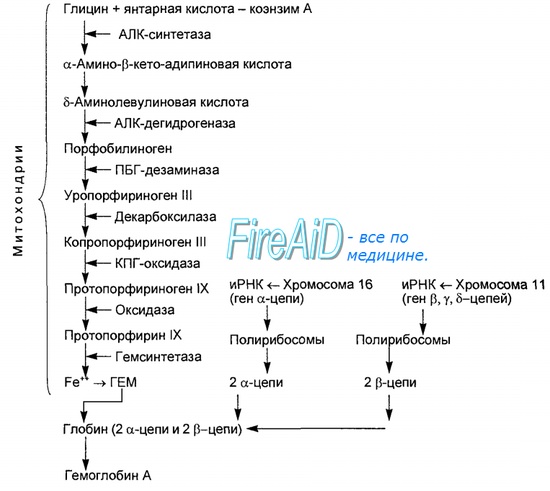
Синтез гема протекает в митохондриях эритробластов. Синтез цепей глобина осуществляется на полирибосомах и контролируется генами 11-й и 16-й хромосом. Схема синтеза гемоглобина у человека представлена на рис. 7.2. Гемоглобин, содержащий две а- и две В-цепи, называется А-тип (от adult — взрослый). 1 г гемоглобина А-типа связывает 1,34 мл O2. В первые три месяца жизни плода человека в крови содержатся эмбриональные гемоглобины типа Gower I (4 эпсилон цепи) и Gower II (2а и 25 цепи). Затем формируется гемоглобин F (от faetus — плод). Его глобин представлен двумя цепями а и двумя В. Гемоглобин F обладает на 20—30 % большим сродством к O2, чем гемоглобин А, что способствует лучшему снабжению плода кислородом. При рождении ребенка до 50—80 % гемоглобина у него представлены гемоглобином F и 15—40 % — типом А, а к 3 годам уровень гемоглобина F снижается до 2 %. Соединение гемоглобина с молекулой 02 называется оксигемоглобином. Сродство гемоглобина к кислороду и диссоциация оксигемоглобина (отсоединения молекул кислорода от оксигемоглобина) зависят от напряжения кислорода (Р02), углекислого газа (РС02) в крови, рН крови, ее температуры и концентрации 2,3-ДФГ в эритроцитах. Так, сродство повышают увеличение Р02 или снижение РС02 в крови, нарушение образования 2,3-ДФГ в эритроцитах. Напротив, повышение концентрации 2,3-ДФГ, снижение Р02 крови, сдвиг рН в кислую сторону, повышение РС02 и температуры крови — уменьшают сродство гемоглобина к кислороду, тем самым облегчая ее отдачу тканям. 2,3-ДФГ связывается с р-цепями гемоглобина, облегчая отсоединение 02 от молекулы гемоглобина. Увеличение концентрации 2,3-ДФГ наблюдается у людей, тренированных к длительной физической работе, адаптированных к длительному пребыванию в горах. Оксигемоглобин, отдавший кислород, называется восстановленным, или дезоксигемоглобином. В состоянии физиологического покоя у человека гемоглобин в артериальной крови на 97 % насыщен кислородом, в венозной — на 70 %. Чем выраженней потребление кислорода тканями, тем ниже насыщение венозной крови кислородом. Например, при интенсивной физической работе потребление кислорода мышечной тканью увеличивается в несколько десятков раз и насыщение кислородом оттекающей от мышц венозной крови снижается до 15 %. Содержание гемоглобина в отдельном эритроците составляет 27,5—33,2 пикограмма. Снижение этой величины свидетельствует о гипохромном (т. е. пониженном), увеличение — о гиперхромном (т. е. повышенном) содержании гемоглобина в эритроцитах. Этот показатель имеет диагностическое значение. Например, гиперхромия эритроцитов характерна для В|2-дефицитной анемии, гипохромия — для железодефицитной анемии. – Также рекомендуем “Старение эритроцитов. Разрушение эритроцитов. Длительность жизни эритроцита. Эхиноцит. Эхиноциты.” |

Виды гемоглобина.
Различают три вида гемоглобина; первоначально эмбрион имеет примитивный гемоглобин (HbP) – до 4-5 мес. внутриутробной жизни, затем начинает появляться фетальный гемоглобин (HbF), количество которого увеличивается до 6–7 мес. внутриутробной жизни. С этого срока происходит увеличение гемоглобина А (взрослого) максимальная величина которого достигает к 9 мес. внутриутробной жизни (90%). Количество фетального гемоглобина при рождении является одним из признаков доношенности: чем больше HbF, тем менее доношенный ребенок. Следует отметить, что HbF в присутствии 2,3 дифосфоглицерата (ДФГ – продукт метаболизма оболочки эритроцита при недостатки кислорода) не меняет своего сродства к кислороду в отличии от HbA, сродство которого к кислороду снижается.
Виды Нв отличаются друг от друга по степени химического сродства к О2. Так, НвF в физиологических условиях имеет более высокое сродство к О2, чем НвА. Эта важнейшая особенность НвF создает оптимальные условия для транспорта О2 кровью плода.
Гемоглобин представляет собой кровяной пигмент, роль которого заключается в транспорте кислорода к органам и тканям, транспорте двуокиси углерода от тканей к легким, кроме этого он является внутриклеточным буфером, который поддерживает оптимальную для метаболизма pH. Гемоглобин содержится в эритроцитах и составляет 90% их сухой массы. Вне эритроцитов гемоглобин практически не обнаруживается.
Химически гемоглобин относится к группе хромопротеидов. Его простетическая группа, включающая железо, называется гемом, белковый компонент – глобином. Молекула гемоглобина содержит 4 гема и 1 глобин.
К физиологическим гемоглобинам относятся НЬА (гемоглобин взрослого) и HbF (фетальный гемоглобин, составляющий основную массу гемоглобина плода и исчезающий почти полностью ко 2-му году жизни ребенка). Современными электрофоретическими исследованиями доказано существование по крайней мере двух разновидностей нормального гемоглобина А: А1 (главный) и А2 (медленный). Основную массу гемоглобина взрослого (96-99%) составляет HbAl, содержание других фракций (А2 F) не превышает 1 – 4%. Каждый вид гемоглобина, вернее его глобиновая часть, характеризуется своей «полипептидной формулой». Так, HbAl обозначается как ά2 β2, то есть он состоит из двух ά-цепей и двух β-цепей (всего 574 аминокислотных остатка, расположенных в строго определенном порядке). Другие виды нормальных гемоглобинов – F, A2 обладают общей с HbAl β-пептидной цепью, но отличаются структурой второй полипептидной цепи (например, структурная формула HbF – ά2γ2).
Помимо физиологических гемоглобинов, существуют еще несколько патологических разновидностей гемоглобина. Патологические гемоглобины возникают в результате врожденного, передаваемого по наследству дефекта образования гемоглобина.
В эритроцитах циркулирующей крови гемоглобин находится в состоянии беспрерывной обратимой реакции. Он то
присоединяет молекулу кислорода (в легочных капиллярах), то отдает ее (в тканевых капиллярах).
К основным соединениям гемоглобина относятся: ННв – восстановленный гемоглобин и НвСО2 – соединение с углекислым газом (карбогемоглобин). Они в основном находятся в венозной крови и придают ей темно-вишневый цвет.
НвО2 – оксигемоглобин– находится, в основном, в артериальной крови, придавая ей алый цвет. НвО2 – чрезвычайно нестойкое соединение, его концентрация определяется парциальным давлением О2 (рО2): чем больше рО2, тем больше образуется НвО2 и наоборот. Все вышеперечисленные соединения гемоглобина относятся к физиологическим.
Гемоглобин в венозной крови с низким парциальным давлением кислорода связан с 1 молекулой воды. Такой гемоглобин называется редуцированным (восстановленным) гемоглобином. В артериальной крови с высоким парциальным давлением кислорода гемоглобин соединен с 1 молекулой кислорода и имеет название – оксигемоглобин. Путем непрерывного превращения оксигемоглобина в редуцированный гемоглобин и обратно осуществляется перенос кислорода из легких к тканям. Восприятие углекислоты в тканевых капиллярах и доставка ее в легкие также является функцией гемоглобина. В тканях оксигемоглобин, отдавая кислород, превращается в редуцированный гемоглобин. Кислотные свойства редуцированного гемоглобина в 70 раз слабее свойств оксигемоглобина, поэтому свободные валентности его связывают углекислоту. Таким образом, углекислота доставляется из тканей в легкие с помощью гемоглобина. В легких образующийся оксигемоглобин в силу своих высоких кислотных свойств вступает в связь с щелочными валентностями карбогемоглобина, вытесняя углекислоту. Так как основной функцией гемоглобина является обеспечение тканей кислородом, то при всех состояниях, сопровождающихся снижением концентрации гемоглобина в крови, или при качественных его изменениях развивается гипоксия тканей.
Однако есть и патологические формы гемоглобина.
Гемоглобин обладает способностью вступать в диссоциирующие соединения не только с кислородом и углекислый газом, но и с другими газами. В результате образуются карбоксигемоглобин, оксиазотистый гемоглобинисульфгемоглобин.
Карбоксигемоглобин (оксиуглеродный) диссоциирует в несколько сотен раз медленнее, чем оксигемоглобин, поэтому даже незначительная концентрация (0,07%) в воздухе угарного газа (СО), связывая около 50% имеющегося в организме гемоглобина и лишая его способности переносить кислород, является смертельным. Карбоксигемоглобин (НвСО) – очень прочное соединение с угарным газом, обусловленное химическими свойствами угарного газа по отношению к Нв. Оказалось, что его родство к Нв в 400-500 раз больше, чем сродство О2 к Нв. Поэтому при незначительном повышении концентрации СО в окружающей среде образуется очень большое количество НвСО. Если в организме находится много НвСО, то возникает кислородное голодание. Фактически О2 в крови очень много, а клетки тканей его не получают, т.к. НвСО – прочное соединение с О2.
Метгемоглобин представляет собой более стойкое, чем оксигемоглобин, соединение гемоглобина с кислородом, получающееся при отравлениях некоторыми лекарственными препаратами – фенацетином, антипирином, сульфаниламидами. При этом двухвалентное железо простетической группы, окисляясь, превращается в трехвалентное. Метгемоглобин (MetНв) – окисленная форма Нв, крови придает коричневую окраску. Образуется MetНв при действии на Нв любым окислителями: нитраты, перекиси, перманганат калия, красная кровяная соль и т.д. Это стойкое соединение, потому что железо из ферроформы (Fe++) переходит в ферриформу (Fe+++), необратимо связывающую О2. При образовании в организме больших количеств MetНв также возникает кислородная недостаточность (гипоксия).
Сульфгемоглобин обнаруживается в крови иногда при применении лекарственных веществ (сульфаниламидов). Содержание сульфгемоглобина редко превышает 10%. Сульфгемоглобинемия – необратимый процесс. Так как пораженные эритроциты
разрушаются в те же сроки, что и нормальные, явлений гемолиза не наблюдается и сульфгемоглобин может находиться в крови в течение нескольких месяцев. На этом свойстве сульфгемоглобина основан метод определения сроков пребывания нормальных эритроцитов в периферической крови.
Дата добавления: 2015-11-05; просмотров: 4842 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org – Контакты – Последнее добавление
Клинический анализ крови – важная составляющая общеклинической диагностики пациентов с патологиями различного характера. В данное исследование входит анализ уровня красных кровяных телец и железосодержащего белка (ЖБ) в сыворотке крови. Данный показатель очень чувствителен к различным изменениям в работе внутренних органов.
Внимание! Эритроциты обеспечивают внутриклеточное дыхание в человеческом организме. Они выполняют жизненно важные функции – выводят углекислый газ из тела и поставляют кислород к органам. Красные кровяные тельца содержат гемоглобин, который транспортирует молекулы этих веществ.
Что такое гемоглобин?
Гемоглобин – пептидное соединение (ПС), содержащее железо, которое транспортирует кислород ко всем тканям человеческого организма. У всех позвоночных зверей данное белковое соединение содержится в красных кровяных клетках, а у беспозвоночных – в плазме. Как упоминалось выше, его функция заключается в том, чтобы выводить диоксид углерода и заниматься поставкой кислорода в органы.
Железосодержащий ген состоит из четырех базовых субъединиц – альфа и бета 1,2. Стоит отметить, что данное ПС имеет формулу тетрамера. Основными компонентами гемоглобина принято считать железосодержащий гем и белок глобин.
Виды гемоглобина:
- Дезоксигемоглобин,
- Карбоксигемоглобин (окрашивает кровь в синеватый цвет),
- Метгемоглобин,
- Фетальный ЖБ (присутствует у плода и исчезает в процессе онтогенеза),
- Оксигемоглобин (окрашивает кровь в светло-красный цвет),
- Миоглобин.
Дезоксигемоглобин – это свободный гемоглобин в крови человека. В такой форме это ПС способно присоединять к себе различные молекулы – углекислый/угарный газ, кислород.
Если дезоксигемоглобин связывается с кислородом, образуется оксигемоглобин. Этот тип белка поставляет кислород ко всем тканям. При наличие различных оксилителей железо в ЖБ из двухвалентного состояния переходит в трехвалентное. Такое соединение принято называть метгемоглобином, оно выполняет важную роль в физиологии органов.

Если восстановленный гемоглобин связывается с угарным газом, образуется токсичное соединение – карбоксигемоглобин. Необходимо отметить, что такое соединение связывается в 250 раз эффективнее, чем диоксид углерода. Карбоксигемоглобин имеет длительный период полураспада, поэтому способен сталь причиной сильного отравления.
Витамин С помогает восстанавливать ЖБ, благодаря чему применяется свободно в медицине для лечения отравлений угарными испрениями. Как правило, интоксикация оксидом углерода проявляется цианозом.
Миоглобин по структуре похож на гемоглобин и в большом количестве содержится в миоцитах, особенно кардиомиоцитах. Он связывает молекулы О₂ «на черный день», который впоследствии используется организмом при состояниях, вызывающих гипоксию. Миоглобин обеспечивает работающие мышцы кислородом.
Все вышеперечисленные типы имеют жизненно важное значения в организме человека, однако существуют патологические формы данного пептидного соединения.
Какие опасные разновидности гемоглобина существуют?
Патологические виды гемоглобина у человека, которые приводят к различным болезням:
- Гемоглобин D-Пенджаб,
- Гемоглобин S – форма, обнаруженная у людей с серповидно-клеточной анемией,
- Гемоглобин С – эта форма вызывает хроническую гемолитическую анемию,
- Гемоглобин H – тип гемоглобина, образованный тетрамером β-цепей, который может присутствовать при α-талассемии.
ЖБ D-Пенджаб является одним из вариантов гемоглобина. Он так назван из-за его высокой распространенности в Пенджабском районе Индии и Пакистана. Это также самый распространенный аномальный вариант железосодержащего белка в Синьцзян-Уйгурском автономном районе Китая. Исследования показывают, что D-Пенджаб составляет более 55% от общего числа патологического гемоглобина.
Он был впервые обнаружен в начале 1950-х годов в смешанной британской и американской семье индийского происхождения из района Лос-Анджелеса, поэтому его иногда называют D Los Angeles. ЖБ D является наиболее распространенным вариантом данного вещества. Он появился в результате распространенности малярии в разных частях Азии.
Гемоглобин S возник в Западной Африке, где распространен больше всего. Он присутствует в меньшей степени в Индии и Средиземноморском регионе. Полиморфизм гена бета S указывает на то, что он возник из пяти отдельных мутаций: четырех в Африке и одного в Индии и на Ближнем Востоке. Наиболее распространенной является аллель, обнаруженная в Бенине в Западной Африке. Другие гаплотипы обнаружены в Сенегале и Банту.
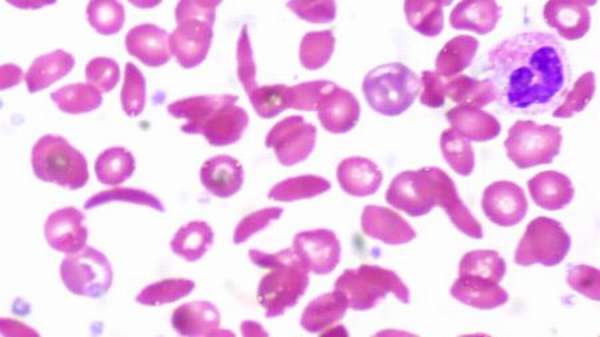
Важно! Ген HbS, присутствующий в гомозиготной форме, является нежелательной мутацией. Малярия, возможно, является фактором отбора, поскольку существует четкая корреляция между распространенностью этой болезни и серповидно-клеточной анемией. Дети с серповидно-клеточной характеристикой Hb SA, переносят малярию гораздо легче и чаще выздоравливают.
Железосодержащий белок C (Hb C) является одним из наиболее распространенных структурных вариантов гемоглобина. Люди со «здоровым» С (Hb C) фенотипически нормальны, тогда как пациенты с патологическим (Hb CC) могут страдать от гемолитической анемии. Хотя клинические осложнения, связанные с патологическим С, не являются серьезными.
Гемоглобин H вызывает тяжелое заболевание – альфа-талассемию. α-талассемия приводит к снижению продукции альфа-глобина, поэтому образуется меньше альфа-глобиновых цепей, что приводит к избытку β-цепей у взрослых и у новорожденных. Избыточные β-цепи образуют нестабильные тетрамеры, называемые гемоглобином H или HbH четырех бета-цепей. Избыточные γ-цепи образуют тетрамеры, которые слабо связываются с кислородом, поскольку их сродство к O2 слишком велико, поэтому оно не диссоциируется на периферии.
Как диагностируют патологические формы железосодержащего белка в крови?
Как упоминалось выше, анализ на содержание гемоглобина входит в клиническое исследование сыворотки крови. В некоторых случаях показано проведение биохимии крови для точного определения патологий данного ПС.
Кровь на анализ сдается натощак и в утреннее время. Рекомендуется не употреблять пищу за 12 часов до забора биологического материала (кала, мочи, крови), чтобы не исказить результаты анализов обследования. В особенности нежелательно заниматься физическими нагрузками, употреблять психотропные вещества или другие лекарственные средства. Диеты придерживаться не нужно, однако от жирной или жареной пищи воздержаться следует, чтобы не повлиять на различные параметры в кале.

Нормальные показатели железосодержащего белка
Расшифровкой анализа общеклинического исследования сыворотки крови должен заниматься только врач. Однако выделяют некоторые общие нормы гемоглобина, присущие всем людям. Уровень данного ПС измеряется в г/л (граммы на литр). В зависимости от лаборатории методики анализа могут различаться.
Норма дезоксигемоглобина в крови у различных возрастных групп:
- Мужчины от 18 лет – 120-150 г/л,
- Женщины от 18 лет – 110-130,
- Маленький ребенок – 200,
Повышение или снижение уровня свободного гемоглобина может приводить к патологиям. Первичная гемоглобинопатия обусловлена наследственными причинами, поэтому не лечится на любых этапах развития. Однако существуют методы стабилизации пациентов, поэтому в любом случае нужно обратиться к врачу. При серьезном снижении уровня данного ПС в кровеносном русле показан искусственный кровезаменитель.
Совет! Синтетическое соединение «перфторан» способно улучшить качество жизни больных с анемией. Искусственно повышать гемоглобин нужно с осторожностью, так как в некоторых случаях кровезаменители могут вызывать серьезные побочные эффекты.
Малокровие: негативные последствия и лечение явления
У взрослого пациента снижение гемоглобина провоцирует кислородный дефицит. Игнорирование этого может привести к:
- Снижению иммунитета. В итоге, человек начинает чаще болеть инфекционными недугами.
- Быстрой утомляемости и хронической слабости.
- Деформации эпителиальных тканей человека (слизистых, ротовой полости, ЖКТ, верхних слоев кожного покрова).
- Нарушению функциональности НС. Пациент может страдать от раздражительности, беспричинных перепадов настроения, пониженной концентрации внимания.
Также малокровие может стать причиной:
- трещин на губах,
- резких мышечных болей,
- выпадения волос,
- ломкости ногтевой пластины,
- пристрастия к неприятным запахам.
При беременности
Малокровие при вынашивании ребенка – частое явление среди женщин. Если отклонение от нормы очень большое, оно может спровоцировать:
- маточную гипотонию,
- гипоксию,
- задержку развития и роста будущего малыша,
- низкий вес ребенка при рождении,
- нарушения функциональности НС и системы дыхания.
Специалисты считают, что ребенок, родившейся у женщины с таким нарушением, будет неважно учиться, часто болеть и страдать от патологии внутренних органов.

Лечение
Для поднятия гемоглобина важно узнать причину его снижения. Можно заняться самолечением и добавить в свой рацион железосодержащие продукты и витамин В. Но если они не будут полноценно абсорбироваться в ЖКТ, эффекта придется ждать очень долго.
Чаще всего врачи прибегают к консервативной терапии и назначают пациенту железосодержащие медикаменты. Хороший результат показывают «Хеферол», «Ферроплекс» и «Ферлатум». Большинство пациентов потребляет лекарства перорально, но если это проблематично, врачи используют парентеральное введение.
Если пациент склонен к дисфункции ЖКТ, он может параллельно употреблять ферментные и обволакивающие лекарственные средства.
Если медикаментозная терапия не помогает, пациенту могут перелить цельную кровь или эритроцитарную массу.
Высокий гемоглобин: негативные последствия и лечение явления
Высокая концентрация эритроцитов провоцирует нарушение работы всего организма. В первую очередь, это влияет на головной мозг и кровоснабжение тканей. Селезенка, печень и печенка начинают увеличиваться в размерах. Человеческий организм не успевает справляться с негативным влиянием большого количества эритроцитов. Если не предпринимать ни каких действий, человек может умереть.
Лечение
Чтобы подобрать подходящее лечение, пациент должен описать врачу свой образ жизни.
В первую очередь, больному прописывают пить много чистой воды. Употребление воды с высоким содержанием хлора будет только способствовать росту гемоглобина. «Водный» рацион можно разбавлять компотами и соками без сахара.
В меню обязательно должны быть овощи и фрукты, обогащенные клетчаткой.
Важно! Клетчатка нормализует пищеварительные процессы, нарушение которых приводит к накоплению токсинов и самоотравлению организма. Ответной реакцией на это явление считается продуцирование мозгом большого количества эритроцитов.
Человек с высоким гемоглобином должен отказаться от:
- красного мяса,
- печени,
- гречки,
- красных овощей, фруктов и ягод.

Употребление жирных блюд и сладостей должно быть минимальным.
Пациентам нужно больше двигаться и пребывать на свежем воздухе.
Загрузка…